Aliphatische Verbindung - Aliphatic compound


In der organischen Chemie , Kohlenwasserstoffe ( Verbindungen allein zusammengesetzt Kohlenstoff und Wasserstoff ) sind in zwei Klassen unterteilt: aromatische Verbindungen und aliphatische Verbindungen ( / ˌ æ l ɪ f æ t ɪ k / ; G. aleiphar , Fett, Öl). Aliphatische Verbindungen können gesättigt sein , wie Hexan , oder ungesättigt, wie Hexen und Hexin . Offenkettige Verbindungen , ob gerade oder verzweigt, und die keinerlei Ringe enthalten, sind immer aliphatisch. Cyclische Verbindungen können aliphatisch sein, wenn sie nicht aromatisch sind .
Struktur
Aliphatische Verbindungen können gesättigt , durch Einfachbindungen ( Alkane ) verbunden oder ungesättigt mit Doppelbindungen ( Alkene ) oder Dreifachbindungen ( Alkine ) sein. Außer Wasserstoff können andere Elemente an die Kohlenstoffkette gebunden werden , am häufigsten sind Sauerstoff , Stickstoff , Schwefel und Chlor .
Die am wenigsten komplexe aliphatische Verbindung ist Methan (CH 4 ).
Eigenschaften
Die meisten aliphatischen Verbindungen sind brennbar und ermöglichen die Verwendung von Kohlenwasserstoffen als Brennstoff , wie Methan in Bunsenbrennern und als Flüssigerdgas (LNG) und Ethin ( Acetylen ) beim Schweißen .
Beispiele für aliphatische Verbindungen / nicht aromatisch
Die wichtigsten aliphatischen Verbindungen sind:
- n-, iso- und cyclo-Alkane (gesättigte Kohlenwasserstoffe)
- n-, iso- und cyclo-Alkene und -Alkine (ungesättigte Kohlenwasserstoffe).
Wichtige Beispiele für niedermolekulare aliphatische Verbindungen finden Sie in der folgenden Liste (sortiert nach der Anzahl der Kohlenstoffatome):
| Formel | Name | Strukturformel | Chemische Einstufung |
|---|---|---|---|
| CH 4 | Methan | 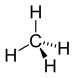 |
Alkan |
| C 2 H 2 | Acetylen | Alkin | |
| C 2 H 4 | Ethylen | 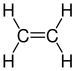 |
Alken |
| C 2 H 6 | Ethan |  |
Alkan |
| C 3 H 4 | Propin | Alkin | |
| C 3 H 6 | Propen | 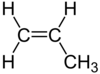 |
Alken |
| C 3 H 8 | Propan |  |
Alkan |
| C 4 H 6 | 1,2-Butadien |  |
Diene |
| C 4 H 6 | 1-Butin |  |
Alkin |
| C 4 H 8 | 1-Buten | Alken | |
| C 4 H 10 | Butan | 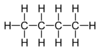 |
Alkan |
| C 6 H 10 | Cyclohexen | Cycloalken | |
| C 5 H 12 | n -Pentan | Alkan | |
| C 7 H 14 | Cycloheptan | Cycloalkan | |
| C 7 H 14 | Methylcyclohexan | 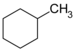 |
Cyclohexan |
| C 8 H 8 | Kubaner |  |
Oktan |
| C 9 H 20 | Nonan | Alkan | |
| C 10 H 12 | Dicyclopentadien |  |
Dien, Cycloalken |
| C 10 H 16 | Phellandrene |
 
|
Terpen, Dien Cycloalken |
| C 10 H 16 | α-Terpinen | Terpen, Cycloalken, Dien | |
| C 10 H 16 | Limonen |
 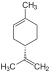
|
Terpen, Dien, Cycloalken |
| C 11 H 24 | Undecan | Alkan | |
| C 30 H 50 | Squalen | Terpen, Polyen | |
| C 2n H 4N | Polyethylen |  |
Alkan |
Verweise
- ^ IUPAC , Kompendium der chemischen Terminologie , 2. Aufl. (das "Goldene Buch") (1997). Korrigierte Online-Version: (1995) " aliphatische Verbindungen ". doi : 10.1351/goldbook.A00217
