Apigenin - Apigenin
|
|

|
|
| Namen | |
|---|---|
|
IUPAC-Name
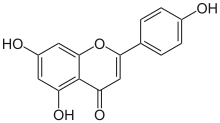
4′,5,7-Trihydroxyflavon
|
|
|
Bevorzugter IUPAC-Name
5,7-Dihydroxy-2-(4-hydroxyphenyl)-4 H -1-benzopyran-4-on |
|
| Andere Namen
Apigenin; Kamille; Apigenol; Spigenin; Versulin; CI Naturgelb 1
|
|
| Bezeichner | |
|
3D-Modell ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
| ECHA-Infokarte |
100.007.540 |
| KEGG | |
|
PubChem- CID
|
|
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| C 15 H 10 O 5 | |
| Molmasse | 270,240 g·mol -1 |
| Aussehen | Gelber kristalliner Feststoff |
| Schmelzpunkt | 345 bis 350 °C (653 bis 662 °F; 618 bis 623 K) |
| UV-Vis (λ max ) | 267, 296sh, 336 nm in Methanol |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Apigenin (4′,5,7-Trihydroxyflavon), das in vielen Pflanzen vorkommt, ist ein Naturprodukt der Flavon- Klasse, das das Aglykon mehrerer natürlich vorkommender Glykoside ist . Es ist ein gelber kristalliner Feststoff, der zum Färben von Wolle verwendet wurde.
Quellen in der Natur
Apigenin kommt in vielen Obst- und Gemüsesorten vor, aber Petersilie , Sellerie , Knollensellerie und Kamillentee sind die häufigsten Quellen. Apigenin ist in den Blüten von Kamillenpflanzen besonders reichlich vorhanden und macht 68 % der gesamten Flavonoide aus . Getrocknete Petersilie kann etwa 45 mg /Gramm und getrocknete Kamillenblüten etwa 3-5 mg/Gramm Apigenin enthalten. Der Apigeningehalt frischer Petersilie beträgt angeblich 215,5 mg/100 Gramm, was viel höher ist als die der nächsthöheren Nahrungsquelle, grüne Sellerieherzen mit 19,1 mg/100 Gramm.
Biosynthese
Apigenin wird biosynthetisch aus dem allgemeinen Phenylpropanoid-Weg und dem Flavon-Syntheseweg abgeleitet. Der Phenylpropanoid-Weg geht von den aromatischen Aminosäuren L-Phenylalanin oder L-Tyrosin aus, beides Produkte des Shikimat-Wegs . Ausgehend von L-Phenylalanin wird die Aminosäure zunächst nicht-oxidativ durch Phenylalanin-Ammoniak-Lyase (PAL) desaminiert , um Cinnamat herzustellen, gefolgt von Oxidation an der para- Position durch Cinnamat-4-Hydroxylase (C4H), um p- Cumarat herzustellen . Da L-Tyrosin bereits an der para- Position oxidiert wird , überspringt es diese Oxidation und wird einfach durch Tyrosin-Ammoniak-Lyase (TAL) desaminiert , um zu p- Cumarat zu gelangen . Um den allgemeinen Phenylpropanoid-Weg zu vervollständigen, ersetzt 4-Cumarat-CoA-Ligase (4CL) Coenzym A (CoA) an der Carboxygruppe von p- Cumarat. Beim Eintritt in den Flavon-Syntheseweg verwendet das Typ-III- Polyketid-Synthase- Enzym Chalcon-Synthase (CHS) aufeinanderfolgende Kondensationen von drei Äquivalenten Malonyl-CoA, gefolgt von einer Aromatisierung, um p- Cumaroyl-CoA in Chalcon umzuwandeln . Chalcon-Isomerase (CHI) isomerisiert dann das Produkt, um den Pyronring zu schließen, um Naringenin herzustellen. Schließlich oxidiert ein Flavanon-Synthase (FNS)-Enzym Naringenin zu Apigenin. Zwei Arten von FNS wurden zuvor beschrieben; FNS I, ein lösliches Enzym, das 2-Oxogluturat, Fe 2+ und Ascorbat als Cofaktoren verwendet, und FNS II, eine membrangebundene, NADPH-abhängige Cytochrom-p450-Monooxygenase.
Glykoside
Zu den natürlich vorkommenden Glykosiden, die durch die Kombination von Apigenin mit Zuckern gebildet werden, gehören:
- Apiin (Apigenin 7- O- apioglucosid), isoliert aus Petersilie und Sellerie
- Apigetrin (Apigenin-7-Glucosid), gefunden in Löwenzahnkaffee
- Vitexin (Apigenin 8- C- glucosid)
- Isovitexin (Apigenin 6- C- glucosid)
- Rhoifolin (Apigenin 7- O - Neohesperidosid )
- Schaftosid (Apigenin 6- C -Glucosid 8- C -Arabinosid)

