Bombykol - Bombykol

|
|
| Namen | |
|---|---|
|
Bevorzugter IUPAC-Name
(10 E ,12 Z )-Hexadeca-10,12-dien-1-ol |
|
| Bezeichner | |
|
3D-Modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
|
PubChem- CID
|
|
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| C 16 H 30 O | |
| Molmasse | 238,415 g·mol -1 |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Bombykol ist ein Pheromon, das von der weiblichen Seidenraupenmotte freigesetzt wird , um Partner anzuziehen. Es ist auch das Sexualpheromon der Wildseidenmotte ( Bombyx mandarina ). 1959 von Adolf Butenandt entdeckt , war es das erste chemisch charakterisierte Pheromon.
Geringfügige Mengen dieses Pheromons können pro Hektar Land verwendet werden, um männliche Insekten über den Standort ihrer weiblichen Partner zu verwirren. Es kann somit als Köder in Fallen dienen, um Insekten effektiv zu entfernen, ohne die Pflanzen mit großen Mengen an Pestiziden zu besprühen. Butenandt benannte die Substanz nach dem lateinischen Namen der Motte Bombyx mori.
In vivo scheint Bombykol der natürliche Ligand für ein Pheromon-bindendes Protein, BmorPBP, zu sein, das das Pheromon zum Pheromonrezeptor eskortiert.
Biosynthese
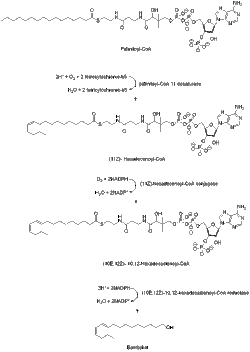
Es ist bekannt, dass Bombykol von Acetyl-CoA über das C-16- Fettacylpalmitoyl-CoA abgeleitet wird . Palmitoyl-CoA wird in Schritten, die Desaturierung und reduktive Modifikation des Carbonylkohlenstoffs beinhalten, in Bombykol umgewandelt. Im Vergleich zu anderen Pheromonen vom Typ I benötigt die Bombykol-Biosynthese keine Kettenverkürzung oder irgendeine andere Art von Modifikation der endständigen Hydroxylgruppe.
Ein Desaturase-Enzym, das durch das Gen Bmpgdesat1 (Desat1) kodiert wird, produziert das Monoen (11 Z )-Hexadecenoyl-CoA sowie das Dien (10 E , 12 Z )-10,12-Hexadecadienoyl-CoA. Diese Desaturase ist das einzige Enzym, das notwendig ist, um diese beiden aufeinanderfolgenden Desaturierungsschritte zu katalysieren.
Der Bombykol-Acyl-Vorläufer (10 E , 12 Z )-10,12-hexadecadienoat wird hauptsächlich als Triacylglycerinester in den zytoplasmatischen Lipidtröpfchen von Pheromondrüsenzellen der Motte gefunden. Und wenn die erwachsenen Weibchen aus ihren Puppen schlüpfen, beginnt das Neurohormon PBAN (pheromon biosynthesis-activating neuropeptide) Signalereignisse, die helfen, die Lipolyse der gespeicherten Triacylglycerine zu kontrollieren, und setzen (10 E , 12 Z )-10,12-Hexadecadienoat für seine endgültige Form frei reduktive Modifikation. Der Mechanismus der lipolytischen Freisetzung von (10 E , 12 Z )-10,12-Hexadecadienoat aus Triacylglycerolen ist nicht vollständig bekannt, aber die Lipase-kodierenden Kandidatengene wurden identifiziert.