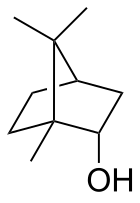
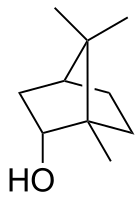
Borneol - Borneol
|
|
|||
|
|
|||
| Namen | |||
|---|---|---|---|
|
IUPAC-Name
rel - (1 R , 2 S , 4 R ) -1,7,7-Trimethylbicyclo [2.2.1] heptan-2-ol
|
|||
| Andere Namen
1,7,7-Trimethylbicyclo[2.2.1]heptan-2- endo -ol
endo -2-Bornanol |
|||
| Bezeichner | |||
|
3D-Modell ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA-Infokarte |
100.006.685 |
||
| EG-Nummer | |||
| KEGG | |||
|
PubChem- CID
|
|||
| UNII | |||
| UN-Nummer | 1312 | ||
|
CompTox-Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eigenschaften | |||
| C 10 H 18 O | |||
| Molmasse | 154,253 g·mol -1 | ||
| Aussehen | farblose bis weiße Klumpen | ||
| Geruch | stechend, Kampfer -ähnlichen | ||
| Dichte | 1,011 g/cm 3 (20 °C) | ||
| Schmelzpunkt | 208 °C (406 °F; 481 K) | ||
| Siedepunkt | 213 °C (415 °F; 486 K) | ||
| schwer löslich ( D- Form) | |||
| Löslichkeit | löslich in Chloroform , Ethanol , Aceton , Ether , Benzol , Toluol , Decalin , Tetralin | ||
| −1,26 × 10 −4 cm 3 /mol | |||
| Gefahren | |||
| Sicherheitsdatenblatt | Externes Sicherheitsdatenblatt | ||
| GHS-Piktogramme |

|
||
| GHS-Signalwort | Warnung | ||
| H228 | |||
| P210 , P240 , P241 , P280 , P370+378 | |||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 65 °C (149 °F; 338 K) | ||
| Verwandte Verbindungen | |||
|
Verwandte Verbindungen
|
Bornan (Kohlenwasserstoff) | ||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
Borneol ist eine bicyclische organische Verbindung und ein Terpenderivat . Die Hydroxylgruppe in dieser Verbindung befindet sich in einer Endo- Position. Borneol ist chiral und existiert als zwei Enantiomere . Sowohl (+)-borneol (ältere Bezeichnung d -borneol) als auch (−)- borneol ( l -borneol) kommen in der Natur vor.
Reaktionen
Borneol wird leicht zum Keton ( Kampfer ) oxidiert . Ein historischer Name für Borneol ist Borneo Campher, was den Namen erklärt.
Auftreten
Die Verbindung wurde 1842 von dem französischen Chemiker Charles Frédéric Gerhardt benannt . Borneol kommt in mehreren Arten von Heterotheca , Artemisia , Callicarpa , Dipterocarpaceae , Blumea balsamifera und Kaempferia galanga vor .
Es ist eine der chemischen Verbindungen, die in Bibergeil vorkommen . Diese Verbindung wird aus der Pflanzennahrung des Bibers gewonnen.
Synthese
Borneol kann durch Reduktion von Kampfer durch die Meerwein-Ponndorf-Verley-Reduktion (ein reversibler Prozess) synthetisiert werden . Die Reduktion von Campher mit Natriumborhydrid (schnell und irreversibel) ergibt stattdessen das Isobornenol als kinetisch kontrolliertes Reaktionsprodukt.
Verwendet
Während d -borneol war das Enantiomer , das am leichtesten im Handel erhältlich, die mehr im Handel erhältlichen Enantiomer nun verwendet werden sollen l -borneol, die auch in der Natur vorkommt.
Borneol aus Dipterocarpus spp. wird in der traditionellen chinesischen Medizin verwendet . Eine frühe Beschreibung findet sich im Bencao Gangmu .
Borneol ist Bestandteil vieler ätherischer Öle und ein natürliches Insektenschutzmittel . Es erzeugt auch ein TRPM8- vermitteltes Kühlgefühl, ähnlich wie Menthol .
Laevo-borneol wird als Aromachemikalie in der Parfümerie verwendet. Es hat einen balsamischen Geruchstyp mit kiefern-, holzigen und kampferartigen Facetten.
Verwendung in der organischen Chemie
Derivate des Isoborneols werden als Liganden in der asymmetrischen Synthese verwendet :
- (2 S )-(–)-3- exo -(Morpholino)isoborneol oder MIB mit einem Morpholin- Substituenten in der α-Hydroxyl-Position.
- (2 S )-(−)-3- exo -(dimethylamino)isoborneol oder DAIB mit einem Dimethylamino- Substituenten in der α-Hydroxyl-Position
Toxikologie
Borneol kann Augen-, Haut- und Atemwegsreizungen verursachen; es ist gesundheitsschädlich beim Verschlucken.
Hautreizung
Es hat sich gezeigt, dass Borneol in geringer Dosis auf die menschliche Haut wenig bis gar keine Reizwirkung hat. Eine langfristige Exposition gegenüber Borneol kann jedoch leichte Reizungen verursachen.
Phototoxizität und Photoallergie
Da Borneol kein UV-Licht bei 290 nm bis 400 nm absorbiert, besitzt es kein phototoxisches oder photoallergisches Potential.
Derivate
Die Bornylgruppe ist ein einwertiger Rest C 10 H 17 , der sich von Borneol durch Entfernung von Hydroxyl ableitet und auch als 2-Bornyl bekannt ist. Isobornyl ist der einwertige Rest C 10 H 17 , der sich von Isoborneol ableitet. Das Strukturisomer Fenchol ist ebenfalls eine weit verbreitete Verbindung, die aus bestimmten ätherischen Ölen gewonnen wird .
Bornylacetat ist der Acetat - Ester von Borneol.