Darmkrebs - Colorectal cancer
| Darmkrebs | |
|---|---|
| Andere Namen | Darmkrebs, Mastdarmkrebs, Darmkrebs |
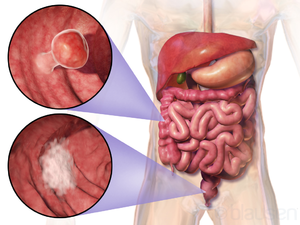 | |
| Lage und Aussehen von zwei Beispielen kolorektaler Tumoren | |
| Spezialität | Gastroenterologie Allgemeine Chirurgie Onkologie |
| Symptome | Erbrechen von Blut , Blut im Stuhl , Veränderung des Stuhlgangs, Gewichtsverlust , Müdigkeit. |
| Ursachen | Alter, Lebensstilfaktoren, genetische Störungen |
| Risikofaktoren | Ernährung, Fettleibigkeit , Rauchen, Bewegungsmangel , Alkoholkonsum |
| Diagnosemethode | Gewebebiopsie während einer Sigmoidoskopie oder Koloskopie |
| Verhütung | Screening im Alter von 50 bis 75 |
| Behandlung | Chirurgie, Strahlentherapie , Chemotherapie , gezielte Therapie |
| Prognose | 5-Jahres-Überlebensrate 65 % (USA) |
| Frequenz | 9,4 Millionen (2015) |
| Todesfälle | 551.000 (2018) |
Dickdarmkrebs ( CRC ), auch bekannt als Darmkrebs , Dickdarmkrebs oder Mastdarmkrebs , ist die Entwicklung von Krebs aus dem Dickdarm oder Mastdarm (Teilen des Dickdarms ). Anzeichen und Symptome können Blut im Stuhl , eine Veränderung des Stuhlgangs , Gewichtsverlust und Müdigkeit sein.
Die meisten kolorektalen Karzinome sind auf Alters- und Lebensstilfaktoren zurückzuführen, wobei nur eine kleine Anzahl von Fällen auf zugrunde liegende genetische Störungen zurückzuführen ist. Risikofaktoren sind Ernährung, Übergewicht , Rauchen und Bewegungsmangel . Zu den Ernährungsfaktoren, die das Risiko erhöhen, gehören rotes Fleisch , verarbeitetes Fleisch und Alkohol. Ein weiterer Risikofaktor sind entzündliche Darmerkrankungen , zu denen Morbus Crohn und Colitis ulcerosa gehören . Einige der vererbten genetischen Störungen , die Darmkrebs verursachen können, umfassen familiäre adenomatöse Polyposis und erblicher nicht-polypöser Dickdarmkrebs ; diese machen jedoch weniger als 5 % der Fälle aus. Es beginnt typischerweise als gutartiger Tumor , oft in Form eines Polypen , der mit der Zeit krebsartig wird .
Darmkrebs kann diagnostiziert werden, indem während einer Sigmoidoskopie oder Koloskopie eine Probe des Dickdarms entnommen wird . Es folgt eine medizinische Bildgebung, um festzustellen, ob sich die Krankheit ausgebreitet hat. Screening ist wirksam, um Todesfälle durch Darmkrebs zu verhindern und zu verringern. Ab einem Alter von 50 bis 75 Jahren wird ein Screening nach einer von mehreren Methoden empfohlen. Bei der Koloskopie können kleine Polypen entfernt werden, wenn sie gefunden werden. Wenn ein großer Polyp oder Tumor gefunden wird, kann eine Biopsie durchgeführt werden, um zu überprüfen, ob er krebsartig ist. Aspirin und andere nicht-steroidale entzündungshemmende Medikamente verringern das Risiko. Ihre generelle Anwendung wird für diesen Zweck jedoch aufgrund von Nebenwirkungen nicht empfohlen.
Behandlungen für Darmkrebs können eine Kombination aus Operation, Strahlentherapie , Chemotherapie und gezielter Therapie umfassen . Krebs, der innerhalb der Dickdarmwand begrenzt ist, kann durch eine Operation heilbar sein, während Krebs, der sich weit verbreitet hat, normalerweise nicht heilbar ist, wobei die Behandlung auf die Verbesserung der Lebensqualität und der Symptome ausgerichtet ist. Die Fünf-Jahres-Überlebensrate in den Vereinigten Staaten beträgt etwa 65 %. Die individuelle Überlebenswahrscheinlichkeit hängt davon ab, wie weit der Krebs fortgeschritten ist, ob der gesamte Krebs operativ entfernt werden kann oder nicht und vom allgemeinen Gesundheitszustand der Person. Darmkrebs ist weltweit die dritthäufigste Krebsart und macht etwa 10 % aller Fälle aus. Im Jahr 2018 gab es 1,09 Millionen neue Fälle und 551.000 Todesfälle durch die Krankheit. Es ist häufiger in entwickelten Ländern , wo mehr als 65% der Fälle gefunden werden. Es ist bei Frauen seltener als bei Männern.
Anzeichen und Symptome
Die Anzeichen und Symptome von Darmkrebs hängen davon ab, wo sich der Tumor im Darm befindet und ob er sich an anderer Stelle im Körper ausgebreitet hat ( Metastasierung ). Zu den klassischen Warnzeichen gehören: Verschlimmerung der Verstopfung , Blut im Stuhl, Abnahme des Stuhlkalibers (Dicke), Appetitlosigkeit, Gewichtsverlust und Übelkeit oder Erbrechen bei Personen über 50 Jahren. Etwa 50 % der Menschen mit Darmkrebs berichten über keine Symptome.
Rektale Blutungen oder Anämie sind Hochrisiko-Symptome bei Menschen über 50 Jahren. Gewichtsverlust und Veränderungen der Stuhlgewohnheiten einer Person sind normalerweise nur dann besorgniserregend, wenn sie mit rektalen Blutungen verbunden sind.
Ursache
75–95 % der Fälle von Darmkrebs treten bei Menschen mit geringem oder keinem genetischen Risiko auf. Zu den Risikofaktoren gehören höheres Alter, männliches Geschlecht, hohe Aufnahme von Fett, Zucker , Alkohol , rotes Fleisch , verarbeitetes Fleisch , Fettleibigkeit , Rauchen und Bewegungsmangel . Ungefähr 10 % der Fälle sind mit unzureichender Aktivität verbunden. Das Risiko durch Alkohol scheint bei mehr als einem Getränk pro Tag zu steigen. Das Trinken von 5 Gläsern Wasser pro Tag ist mit einer Verringerung des Risikos für Darmkrebs und adenomatöse Polypen verbunden. Streptococcus gallolyticus wird mit Darmkrebs in Verbindung gebracht. Einige Stämme des Streptococcus bovis/Streptococcus equinus- Komplexes werden täglich von Millionen von Menschen konsumiert und können daher sicher sein. 25 bis 80 % der Menschen mit Streptococcus bovis/Gallolyticus- Bakteriämie haben begleitende kolorektale Tumoren. Die Seroprävalenz von Streptococcus bovis/gallolyticus wird als praktischer Kandidat für die Frühvorhersage einer zugrunde liegenden Darmläsion in einer Hochrisikopopulation angesehen. Es wurde vermutet, dass die Anwesenheit von Antikörpern gegen Streptococcus bovis/gallolyticus- Antigene oder die Antigene selbst im Blutkreislauf als Marker für die Karzinogenese im Dickdarm wirken können.
Pathogene Escherichia coli kann das Risiko von Darmkrebs erhöhen , indem die Herstellung genotoxisch Metaboliten , colibactin .
Entzündliche Darmerkrankung
Menschen mit entzündlichen Darmerkrankungen ( Colitis ulcerosa und Morbus Crohn ) haben ein erhöhtes Risiko für Dickdarmkrebs. Das Risiko steigt, je länger eine Person die Krankheit hat und je schlimmer die Entzündung ist. In diesen Hochrisikogruppen wird sowohl die Vorbeugung mit Aspirin als auch regelmäßige Koloskopien empfohlen. Die endoskopische Überwachung in dieser Hochrisikopopulation kann durch eine frühzeitige Diagnose die Entwicklung von Dickdarmkrebs und auch die Wahrscheinlichkeit, an Dickdarmkrebs zu sterben, verringern. Menschen mit entzündlichen Darmerkrankungen machen jährlich weniger als 2% der Darmkrebsfälle aus. Bei Morbus Crohn erkranken 2 % nach 10 Jahren an Darmkrebs, 8 % nach 20 Jahren und 18 % nach 30 Jahren. Bei Menschen mit Colitis ulcerosa entwickeln etwa 16% im Laufe von 30 Jahren entweder eine Krebsvorstufe oder Dickdarmkrebs.
Genetik
Personen mit einer Familienanamnese bei zwei oder mehr Verwandten ersten Grades (wie einem Elternteil oder Geschwister) haben ein zwei- bis dreifach höheres Erkrankungsrisiko und diese Gruppe macht etwa 20 % aller Fälle aus. Eine Reihe genetischer Syndrome ist auch mit einer höheren Darmkrebsrate verbunden. Die häufigste davon ist der erbliche nichtpolypöse Dickdarmkrebs (HNPCC oder Lynch-Syndrom), der bei etwa 3% der Menschen mit Dickdarmkrebs auftritt. Andere Syndrome, die stark mit Darmkrebs assoziiert sind, sind das Gardner-Syndrom und die familiäre adenomatöse Polyposis (FAP). Bei Menschen mit diesen Syndromen tritt Krebs fast immer auf und macht 1 % der Krebsfälle aus. Eine totale Proktokolektomie kann aufgrund des hohen Malignitätsrisikos für Menschen mit FAP als vorbeugende Maßnahme empfohlen werden. Die Kolektomie, die Entfernung des Dickdarms, kann als vorbeugende Maßnahme wegen des hohen Risikos für Rektumkarzinom bei Verbleib des Rektums möglicherweise nicht ausreichen. Das häufigste Polyposis-Syndrom, das den Dickdarm betrifft, ist das serratierte Polyposis-Syndrom , das mit einem Risiko von 25-40% für CRC verbunden ist.
Mutationen im Genpaar ( POLE und POLD1 ) wurden mit familiärem Dickdarmkrebs in Verbindung gebracht.
Die meisten Todesfälle durch Dickdarmkrebs sind mit metastasierten Erkrankungen verbunden. Ein Gen, das zum Potenzial für eine metastasierende Erkrankung beizutragen scheint, Metastasierung im Zusammenhang mit Dickdarmkrebs 1 ( MACC1 ), wurde isoliert. Es ist ein Transkriptionsfaktor, der die Expression des Hepatozyten-Wachstumsfaktors beeinflusst . Dieses Gen ist mit der Proliferation, Invasion und Streuung von Dickdarmkrebszellen in Zellkulturen sowie mit Tumorwachstum und Metastasierung bei Mäusen verbunden. MACC1 kann ein potenzielles Ziel für Krebsinterventionen sein, aber diese Möglichkeit muss durch klinische Studien bestätigt werden.
Epigenetische Faktoren, wie eine abnorme DNA-Methylierung von Tumorsuppressor-Promotoren, spielen eine Rolle bei der Entstehung von Darmkrebs.
Aschkenasische Juden haben ein um 6% höheres Risiko, Adenome und dann Dickdarmkrebs zu bekommen, da Mutationen im APC-Gen häufiger auftreten.
Pathogenese
Dickdarmkrebs ist eine Erkrankung, die von den Epithelzellen des Dickdarms oder Rektums des Magen-Darm-Trakts ausgeht , am häufigsten als Folge von Mutationen im Wnt-Signalweg , die die Signalaktivität erhöhen. Die Mutationen werden können vererbt oder erworben , und höchstwahrscheinlich in der auftreten Darm-Krypta Stammzelle . Das am häufigsten mutierte Gen bei allen kolorektalen Karzinomen ist das APC- Gen, das das APC-Protein produziert. Das APC-Protein verhindert die Akkumulation von β-Catenin- Protein. Ohne APC reichert β-Catenin zu einem hohen Niveau und transloziert (bewegt sich) in den Zellkern, bindet an DNA und aktiviert die Transkription von Proto- Onkogenen . Diese Gene sind normalerweise für die Erneuerung und Differenzierung von Stammzellen wichtig, aber wenn sie in unangemessen hoher Konzentration exprimiert werden, können sie Krebs verursachen. Während APC bei den meisten Dickdarmkrebsarten mutiert ist, haben einige Krebsarten β-Catenin aufgrund von Mutationen in β-Catenin (CTNNB1), die seinen eigenen Abbau blockieren, oder Mutationen in anderen Genen mit ähnlicher Funktion wie APC wie AXIN1 , AXIN2 , TCF7L2 . erhöht , oder NKD1 .
Abgesehen von den Defekten im Wnt-Signalweg müssen andere Mutationen auftreten, damit die Zelle krebsartig wird. Das vom TP53- Gen produzierte p53- Protein überwacht normalerweise die Zellteilung und induziert ihren programmierten Tod, wenn sie Wnt-Weg-Defekte aufweisen. Schließlich erwirbt eine Zelllinie eine Mutation im TP53- Gen und verwandelt das Gewebe von einem gutartigen Epitheltumor in einen invasiven Epithelzellkrebs . Manchmal ist das für p53 kodierende Gen nicht mutiert, sondern stattdessen ein anderes schützendes Protein namens BAX mutiert.
Andere Proteine, die für den programmierten Zelltod verantwortlich sind und bei Darmkrebs häufig deaktiviert werden, sind TGF-β und DCC ( Deleted in Colorectal Cancer ). TGF-β weist bei mindestens der Hälfte der kolorektalen Karzinome eine deaktivierende Mutation auf. Manchmal wird TGF-β nicht deaktiviert, aber ein nachgeschaltetes Protein namens SMAD wird deaktiviert. DCC weist bei Darmkrebs häufig ein deletiertes Segment eines Chromosoms auf.
Ungefähr 70 % aller menschlichen Gene werden bei Darmkrebs exprimiert, wobei etwas mehr als 1 % bei Darmkrebs im Vergleich zu anderen Krebsarten eine erhöhte Expression aufweist. Einige Gene sind Onkogene : Sie werden bei Darmkrebs überexprimiert. Beispielsweise können Gene, die für die Proteine KRAS , RAF und PI3K kodieren , die normalerweise die Zellteilung als Reaktion auf Wachstumsfaktoren anregen , Mutationen erwerben, die zu einer Überaktivierung der Zellproliferation führen. Die chronologische Reihenfolge der Mutationen ist manchmal wichtig. Wenn eine frühere APC-Mutation aufgetreten ist, führt eine primäre KRAS-Mutation oft zu Krebs und nicht zu einer selbstlimitierenden hyperplastischen oder Borderline-Läsion. PTEN , ein Tumorsuppressor, hemmt normalerweise PI3K, kann aber manchmal mutiert und deaktiviert werden.
Umfassende Analysen auf Genomskala haben gezeigt, dass kolorektale Karzinome in hypermutierte und nicht-hypermutierte Tumortypen eingeteilt werden können. Zusätzlich zu den onkogenen und inaktivierenden Mutationen, die für die oben beschriebenen Gene beschrieben wurden, enthalten nicht-hypermutierte Proben auch mutiertes CTNNB1 , FAM123B , SOX9 , ATM und ARID1A . Durch eine bestimmte Reihe von genetischen Ereignissen fortschreitend , zeigen hypermutierte Tumoren mutierte Formen von ACVR2A , TGFBR2 , MSH3 , MSH6 , SLC9A9, TCF7L2 und BRAF . Das gemeinsame Thema dieser Gene bei beiden Tumorarten ist ihre Beteiligung an den Wnt- und TGF-β-Signalwegen, was zu einer erhöhten Aktivität von MYC führt , einem zentralen Akteur bei Darmkrebs.
Mismatch-Repair- (MMR)-defiziente Tumoren sind durch eine relativ hohe Anzahl von Polynukleotid-Tandem-Repeats gekennzeichnet. Dies wird durch einen Mangel an MMR-Proteinen verursacht – die typischerweise durch epigenetisches Silencing und/oder vererbte Mutationen (z . B. Lynch-Syndrom ) verursacht werden. 15 bis 18 Prozent der Darmkrebstumore weisen MMR-Mangel auf, 3 Prozent entwickeln sich aufgrund des Lynch-Syndroms. Die Rolle des Mismatch-Reparatursystems besteht darin, die Integrität des genetischen Materials innerhalb der Zellen zu schützen (dh: Fehlererkennung und -korrektur). Folglich kann ein Mangel an MMR-Proteinen dazu führen, dass genetische Schäden nicht erkannt und repariert werden können, was das Auftreten weiterer krebserzeugender Mutationen und das Fortschreiten von Darmkrebs ermöglicht.
Die Progressionssequenz von Polypen zu Krebs ist das klassische Modell der Pathogenese von Dickdarmkrebs. Die Polypen-zu-Krebs-Sequenz beschreibt die Phasen des Übergangs von gutartigen Tumoren zum Dickdarmkrebs über viele Jahre. Von zentraler Bedeutung für die Polypen- bis CRC-Sequenz sind Genmutationen, epigenetische Veränderungen und lokale entzündliche Veränderungen. Die Polypen-zu-CRC-Sequenz kann als zugrundeliegendes Gerüst verwendet werden, um zu veranschaulichen, wie spezifische molekulare Veränderungen zu verschiedenen Krebssubtypen führen.
Feldfehler

Der Begriff "Feldkanzerisierung" wurde erstmals 1953 verwendet, um einen Bereich oder ein "Feld" des Epithels zu beschreiben, das (durch damals weitgehend unbekannte Prozesse) präkonditioniert wurde, um es für die Entwicklung von Krebs zu prädisponieren. Seitdem werden die Begriffe „Feldkanzerisierung“, „Feld Karzinogenese“, „Felddefekt“ und „ Feldeffekt haben“ verwendet worden prämalignen oder präneoplastischen Gewebes zu beschreiben , in denen neue Krebserkrankungen wahrscheinlich auftreten werden.
Felddefekte sind wichtig bei der Progression zu Dickdarmkrebs.
Rubin weist jedoch darauf hin: „Die überwiegende Mehrheit der Studien in der Krebsforschung wurde an gut definierten Tumoren in vivo oder an diskreten neoplastischen Herden in vitro durchgeführt . Es gibt jedoch Hinweise darauf, dass mehr als 80% der gefundenen somatischen Mutationen beim Mutator-Phänotyp treten humane kolorektale Tumoren vor dem Einsetzen der terminalen klonalen Expansion auf." In ähnlicher Weise haben Vogelstein et al. wiesen darauf hin, dass mehr als die Hälfte der in Tumoren identifizierten somatischen Mutationen in einer präneoplastischen Phase (in einem Felddefekt) während des Wachstums scheinbar normaler Zellen auftraten. Ebenso können epigenetische Veränderungen in Tumoren bei präneoplastischen Felddefekten aufgetreten sein.
Eine erweiterte Sichtweise des Feldeffekts wurde als "ätiologischer Feldeffekt" bezeichnet, der nicht nur molekulare und pathologische Veränderungen in präneoplastischen Zellen umfasst, sondern auch Einflüsse exogener Umweltfaktoren und molekularer Veränderungen in der lokalen Mikroumgebung auf die neoplastische Evolution von der Tumorinitiierung bis zum Tod .
Epigenetik
Epigenetische Veränderungen sind bei Dickdarmkrebs viel häufiger als genetische (mutationsbedingte) Veränderungen. Wie von Vogelstein et al. beschrieben, weist ein durchschnittlicher Dickdarmkrebs nur 1 oder 2 Onkogen-Mutationen und 1 bis 5 Tumorsuppressor-Mutationen (zusammen als „Driver-Mutationen“ bezeichnet) mit etwa 60 weiteren „Passenger“-Mutationen auf. Die Onkogene und Tumorsuppressorgene sind gut untersucht und oben unter Pathogenese beschrieben .
Neben der epigenetischen Veränderung der Expression von miRNAs umfassen andere häufige Arten epigenetischer Veränderungen bei Krebs, die die Genexpressionsniveaus verändern, die direkte Hypermethylierung oder Hypomethylierung von CpG-Inseln von Protein-kodierenden Genen und Veränderungen der Histone und der chromosomalen Architektur, die die Genexpression beeinflussen. Beispielsweise wurden 147 Hypermethylierungen und 27 Hypomethylierungen von proteinkodierenden Genen häufig mit Darmkrebs in Verbindung gebracht. Von den hypermethylierten Genen waren 10 bei 100 % der Dickdarmkrebsarten hypermethyliert, und viele andere waren bei mehr als 50 % der Dickdarmkrebsarten hypermethyliert. Darüber hinaus wurden 11 Hypermethylierungen und 96 Hypomethylierungen von miRNAs auch mit kolorektalen Karzinomen in Verbindung gebracht. Eine abnormale (aberrante) Methylierung tritt als normale Folge des normalen Alterns auf und das Risiko für Darmkrebs steigt mit zunehmendem Alter einer Person. Quelle und Auslöser dieser altersbedingten Methylierung sind unbekannt. Ungefähr die Hälfte der Gene, die altersbedingte Methylierungsveränderungen aufweisen, sind die gleichen Gene, die an der Entstehung von Dickdarmkrebs beteiligt sind. Diese Ergebnisse könnten darauf hindeuten, dass das Alter mit dem erhöhten Risiko, an Darmkrebs zu erkranken, in Verbindung gebracht wird.
Epigenetische Reduktionen der DNA-Reparaturenzymexpression können wahrscheinlich zu der für Krebs charakteristischen genomischen und epigenomischen Instabilität führen. Wie in den Artikeln Carcinogenesis and Neoplasma zusammengefasst , ist bei sporadischen Krebsarten im Allgemeinen ein Mangel an DNA-Reparatur gelegentlich auf eine Mutation in einem DNA-Reparaturgen zurückzuführen, aber viel häufiger auf epigenetische Veränderungen, die die Expression von DNA-Reparaturgenen reduzieren oder zum Schweigen bringen .
Epigenetische Veränderungen, die an der Entstehung von Darmkrebs beteiligt sind, können das Ansprechen einer Person auf eine Chemotherapie beeinflussen.
Genomik | Epigenomik
Die konsensuelle Klassifikation der molekularen Subtypen (CMS) von Dickdarmkrebs wurde erstmals im Jahr 2015 eingeführt. Die CMS-Klassifikation gilt bisher als das robusteste Klassifikationssystem für CRC, das eine klare biologische Interpretierbarkeit und die Grundlage für zukünftige klinische Stratifizierung und subtypbasierte zielgerichtete Interventionen bietet .
2021 wurde eine neue epigenombasierte Klassifikation (EpiC) von Darmkrebs vorgeschlagen, die 4 Enhancer-Subtypen bei Menschen mit CRC einführt. Chromatinzustände unter Verwendung von 6 Histonmarkierungen werden charakterisiert, um EpiC-Subtypen zu identifizieren. Ein kombinatorischer Therapieansatz basierend auf den zuvor eingeführten molekularen Konsensus-Subtypen (CMS) und EpiCs könnte aktuelle Behandlungsstrategien deutlich verbessern.
Diagnose
Die Diagnose von Dickdarmkrebs wird durch Probenahme von Bereichen des Dickdarms durchgeführt, die auf eine mögliche Tumorentwicklung verdächtig sind, typischerweise während der Koloskopie oder Sigmoidoskopie, abhängig von der Lokalisation der Läsion. Sie wird durch mikroskopische Untersuchung einer Gewebeprobe bestätigt.
Medizinische Bildgebung
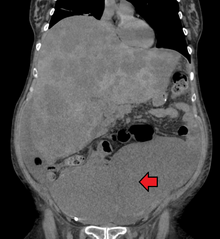
Ein Dickdarmkrebs wird manchmal zuerst im CT-Scan entdeckt .
Das Vorhandensein von Metastasen wird durch eine CT-Untersuchung von Brust, Bauch und Becken festgestellt . Andere mögliche bildgebende Verfahren wie PET und MRT können in bestimmten Fällen verwendet werden. Letzteres wird häufig bei rektalen Läsionen verwendet, um das lokale Stadium zu bestimmen und die präoperative Planung zu erleichtern.
Histopathologie

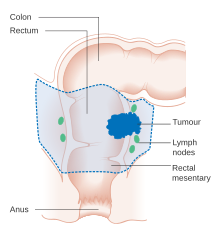
Die histopathologischen Merkmale des Tumors werden aus der Analyse von Gewebe berichtet, das aus einer Biopsie oder einem chirurgischen Eingriff entnommen wurde. Ein Pathologiebericht enthält eine Beschreibung der mikroskopischen Eigenschaften des Tumorgewebes, einschließlich beider Tumorzellen und wie der Tumor in gesundes Gewebe eindringt und schließlich, ob der Tumor vollständig entfernt zu sein scheint. Die häufigste Form von Dickdarmkrebs ist das Adenokarzinom , das zwischen 95 und 98 % aller Fälle von Dickdarmkrebs ausmacht. Andere, seltenere Arten sind Lymphome , adenosquamöse und Plattenepithelkarzinome . Es wurde festgestellt, dass einige Subtypen aggressiver sind. Immunhistochemie kann in unsicheren Fällen verwendet werden.
Inszenierung
Das Staging des Krebses basiert sowohl auf radiologischen als auch auf pathologischen Befunden. Wie bei den meisten anderen Krebsarten basiert das Tumor-Staging auf dem TNM-System, das berücksichtigt, wie weit sich der ursprüngliche Tumor ausgebreitet hat und ob Metastasen in Lymphknoten und weiter entfernten Organen vorhanden sind. Die 8. Ausgabe des AJCC wurde 2018 veröffentlicht.
Verhütung
Es wurde geschätzt, dass etwa die Hälfte der Fälle von Dickdarmkrebs auf Lebensstilfaktoren zurückzuführen sind und etwa ein Viertel aller Fälle vermeidbar sind. Eine verstärkte Überwachung, körperliche Aktivität, eine ballaststoffreiche Ernährung und eine Reduzierung des Rauchens und Alkoholkonsums verringern das Risiko.
Lebensstil
Risikofaktoren für den Lebensstil mit starker Evidenz sind Bewegungsmangel, Zigarettenrauchen, Alkohol und Fettleibigkeit. Das Darmkrebsrisiko kann durch die Aufrechterhaltung eines normalen Körpergewichts durch eine Kombination aus ausreichender Bewegung und gesunder Ernährung gesenkt werden .
Die aktuelle Forschung verbindet konsequent den Verzehr von mehr rotem Fleisch und verarbeitetem Fleisch mit einem höheren Krankheitsrisiko. Ab den 1970er Jahren umfassten die Ernährungsempfehlungen zur Vorbeugung von Darmkrebs häufig die Erhöhung des Verzehrs von Vollkornprodukten, Obst und Gemüse sowie die Reduzierung des Verzehrs von rotem Fleisch und verarbeitetem Fleisch . Dies basierte auf Tierstudien und retrospektiven Beobachtungsstudien. Allerdings haben groß angelegte prospektive Studien keinen signifikanten protektiven Effekt gezeigt, und aufgrund der vielfältigen Ursachen von Krebs und der Komplexität der Untersuchung von Korrelationen zwischen Ernährung und Gesundheit ist es ungewiss, ob spezifische Ernährungsinterventionen (außerhalb einer gesunden Ernährung) wird erhebliche Schutzwirkungen haben. Im Jahr 2018 erklärte das National Cancer Institute : „Es gibt keine zuverlässigen Beweise dafür, dass eine Ernährung, die im Erwachsenenalter begonnen hat und wenig Fett und Fleisch enthält und reich an Ballaststoffen, Obst und Gemüse ist, das CRC-Risiko um einen klinisch bedeutsamen Grad reduziert.“
Laut World Cancer Research Fund erhöhen sowohl der Konsum von alkoholischen Getränken als auch der Konsum von verarbeitetem Fleisch das Risiko für Darmkrebs
In Bezug auf Ballaststoffe stellte der Krebsbericht der Weltgesundheitsorganisation von 2014 fest, dass die Hypothese aufgestellt wurde, dass Ballaststoffe zur Vorbeugung von Darmkrebs beitragen könnten, aber die meisten Studien haben dies nicht bestätigt, und der Stand der Wissenschaft blieb bis 2014 unklar. Eine Überprüfung aus dem Jahr 2019 , jedoch Beweise für den Nutzen von Ballaststoffen und Vollkornprodukten. Der World Cancer Research Fund hat den Nutzen von Ballaststoffen zur Vorbeugung von Darmkrebs ab 2017 als "wahrscheinlich" eingestuft.
Höhere körperliche Aktivität wird empfohlen. Körperliche Bewegung ist mit einer mäßigen Verringerung des Dickdarmkrebsrisikos verbunden, jedoch nicht mit einem Rektumkarzinomrisiko. Ein hohes Maß an körperlicher Aktivität senkt das Darmkrebsrisiko um etwa 21 %. Regelmäßiges Sitzen über einen längeren Zeitraum ist mit einer höheren Sterblichkeit durch Dickdarmkrebs verbunden. Das Risiko wird durch regelmäßige Bewegung nicht negiert, obwohl es gesenkt wird.
Medikamente und Nahrungsergänzungsmittel
Aspirin und Celecoxib scheinen das Darmkrebsrisiko bei Hochrisikopatienten zu senken. Aspirin wird Personen im Alter von 50 bis 60 Jahren empfohlen, die kein erhöhtes Blutungsrisiko haben und ein Risiko für Herz-Kreislauf-Erkrankungen haben, um Darmkrebs zu verhindern. Es wird nicht bei Personen mit durchschnittlichem Risiko empfohlen.
Es gibt vorläufige Evidenz für eine Kalziumergänzung , die jedoch nicht ausreicht, um eine Empfehlung abzugeben. Die Vitamin-D- Aufnahme und der Blutspiegel sind mit einem geringeren Risiko für Dickdarmkrebs verbunden.
Screening
Da mehr als 80 % der kolorektalen Karzinome von adenomatösen Polypen ausgehen , ist das Screening auf diesen Krebs sowohl für die Früherkennung als auch für die Prävention wirksam. Die Diagnose von Darmkrebsfällen durch Screening erfolgt in der Regel 2–3 Jahre vor der Diagnose von Fällen mit Symptomen. Gefundene Polypen können in der Regel durch Koloskopie oder Sigmoidoskopie entfernt werden und verhindern so, dass sie zu Krebs werden. Das Screening hat das Potenzial, die Todesfälle durch Darmkrebs um 60 % zu reduzieren.
Die drei wichtigsten Screening-Tests sind die Koloskopie , der Test auf okkultes Blut im Stuhl und die flexible Sigmoidoskopie . Von den dreien kann nur die Sigmoidoskopie die rechte Seite des Dickdarms nicht untersuchen, wo 42 % der Krebsarten gefunden werden. Die flexible Sigmoidoskopie hat jedoch die beste Evidenz für die Verringerung des Sterberisikos jeglicher Ursache.
Stuhluntersuchungen auf okkultes Blut (FOBT) des Stuhls werden in der Regel alle zwei Jahre empfohlen und können entweder auf Guajak-Basis oder immunchemisch sein . Wenn abnormale FOBT-Ergebnisse gefunden werden, werden die Teilnehmer in der Regel zu einer Nachsorgeuntersuchung zur Koloskopie überwiesen. Wenn das FOBT-Screening alle 1–2 Jahre durchgeführt wird, reduziert das FOBT-Screening die Todesfälle durch Dickdarmkrebs um 16% und bei denjenigen, die an der Vorsorgeuntersuchung teilnehmen, können die Todesfälle durch Dickdarmkrebs um bis zu 23% reduziert werden, obwohl nicht nachgewiesen wurde, dass es die Gesamtmortalität senkt. Immunchemische Tests sind genau und erfordern keine Änderungen der Ernährung oder Medikation vor dem Test.
Weitere Optionen sind die virtuelle Koloskopie und der Stuhl-DNA-Screening-Test (FIT-DNA). Die virtuelle Koloskopie über einen CT-Scan erscheint genauso gut wie die Standard-Koloskopie zur Erkennung von Krebs und großen Adenomen, ist jedoch teuer, mit Strahlenbelastung verbunden und kann keine erkannten abnormalen Wucherungen entfernen, wie dies bei der Standard-Koloskopie der Fall ist. Der Stuhl-DNA-Screening-Test sucht nach Biomarkern, die mit Darmkrebs und präkanzerösen Läsionen verbunden sind, einschließlich veränderter DNA und Bluthämoglobin . Bei positivem Ergebnis sollte eine Koloskopie erfolgen . FIT-DNA hat mehr falsch positive Ergebnisse als FIT und führt daher zu mehr Nebenwirkungen. Ab 2016 sind weitere Studien erforderlich, um festzustellen, ob ein dreijähriges Screening-Intervall richtig ist.
Empfehlungen
In den Vereinigten Staaten wird ein Screening in der Regel im Alter zwischen 50 und 75 Jahren empfohlen. Die American Cancer Society empfiehlt, ab dem 45. Lebensjahr zu beginnen. Für Personen zwischen 76 und 85 Jahren sollte die Entscheidung zum Screening individuell getroffen werden. Bei Hochrisikopatienten beginnen die Screenings in der Regel bei etwa 40.
Mehrere Screening-Methoden werden empfohlen, darunter stuhlbasierte Tests alle 2 Jahre, Sigmoidoskopie alle 10 Jahre mit immunchemischen Tests im Stuhl alle zwei Jahre und Koloskopie alle 10 Jahre. Welche dieser beiden Methoden besser ist, ist unklar. Die Koloskopie kann mehr Krebs im ersten Teil des Dickdarms finden, ist jedoch mit höheren Kosten und mehr Komplikationen verbunden. Für Personen mit durchschnittlichem Risiko, die eine qualitativ hochwertige Koloskopie mit normalen Ergebnissen hatten, empfiehlt die American Gastroenterological Association in den 10 Jahren nach der Koloskopie keine Art von Screening. Für Personen über 75 oder Personen mit einer Lebenserwartung von weniger als 10 Jahren wird ein Screening nicht empfohlen. Nach dem Screening dauert es etwa 10 Jahre, bis eine von 1000 Personen davon profitiert. Die USPSTF listet sieben potenzielle Strategien für das Screening auf, wobei das Wichtigste ist, dass mindestens eine dieser Strategien angemessen angewendet wird.
In Kanada wird bei den 50- bis 75-Jährigen mit normalem Risiko eine fäkale immunchemische Untersuchung oder FOBT alle zwei Jahre oder eine Sigmoidoskopie alle 10 Jahre empfohlen. Koloskopie wird weniger bevorzugt.
Einige Länder haben nationale kolorektale Screening-Programme, die FOBT-Screening für alle Erwachsenen innerhalb einer bestimmten Altersgruppe anbieten, typischerweise im Alter zwischen 50 und 60 Jahren. Beispiele für Länder mit organisierten Screenings sind das Vereinigte Königreich, Australien, die Niederlande, Hongkong und Taiwan.
Behandlung
Die Behandlung von Darmkrebs kann auf Heilung oder Linderung ausgerichtet sein. Die Entscheidung, welches Ziel verfolgt wird, hängt von verschiedenen Faktoren ab, darunter der Gesundheitszustand und die Vorlieben der Person sowie das Stadium des Tumors. Die Beurteilung in multidisziplinären Teams ist ein entscheidender Teil der Entscheidung, ob der Patient für eine Operation geeignet ist oder nicht. Wenn Darmkrebs früh erkannt wird, kann eine Operation kurativ sein. Wenn es jedoch in späteren Stadien (bei denen Metastasen vorhanden sind) entdeckt wird, ist dies weniger wahrscheinlich und die Behandlung zielt oft auf eine Linderung ab, um die durch den Tumor verursachten Symptome zu lindern und die Person so angenehm wie möglich zu machen.
Operation
Wenn der Krebs in einem frühen Stadium entdeckt wird, kann er während einer Koloskopie mit einer von mehreren Techniken entfernt werden, einschließlich der endoskopischen Schleimhautresektion oder der endoskopischen Submukosadissektion . Für Menschen mit lokalisiertem Krebs ist die bevorzugte Behandlung eine vollständige chirurgische Entfernung mit ausreichenden Rändern mit dem Versuch, eine Heilung zu erreichen. Das Verfahren der Wahl ist eine partielle Kolektomie (oder Proktokolektomie bei Rektumläsionen), bei der der betroffene Teil des Dickdarms oder Rektums zusammen mit Teilen seines Mesokolons und der Blutversorgung entfernt wird , um die Entfernung der drainierenden Lymphknoten zu erleichtern . Dies kann entweder durch eine offene Laparotomie oder laparoskopisch erfolgen , je nach individuellen Faktoren und Läsionsfaktoren. Der Dickdarm kann dann wieder verbunden werden oder eine Person kann eine Kolostomie haben .
Sind nur wenige Metastasen in Leber oder Lunge vorhanden, können diese auch entfernt werden. Eine Chemotherapie kann vor der Operation verwendet werden, um den Krebs zu verkleinern, bevor versucht wird, ihn zu entfernen. Die beiden häufigsten Rezidive von Darmkrebs sind die Leber und die Lunge . Bei der zytoreduktiven Chirurgie der Peritonealkarzinose kann manchmal in Kombination mit HIPEC versucht werden, den Krebs zu entfernen.
Chemotherapie
Sowohl bei Krebs des Dickdarms und Mastdarms , Chemotherapie kann zusätzlich zu der Operation in bestimmten Fällen eingesetzt werden. Die Entscheidung, eine Chemotherapie zur Behandlung von Dickdarm- und Mastdarmkrebs hinzuzufügen, hängt vom Stadium der Erkrankung ab.
Bei Dickdarmkrebs im Stadium I wird keine Chemotherapie angeboten und eine Operation ist die definitive Behandlung. Die Rolle der Chemotherapie bei Dickdarmkrebs im Stadium II ist umstritten und wird normalerweise nicht angeboten, es sei denn, Risikofaktoren wie T4-Tumor, undifferenzierter Tumor, vaskuläre und perineurale Invasion oder unzureichende Lymphknotenentnahme werden identifiziert. Es ist auch bekannt, dass die Menschen, die Anomalien der Mismatch-Reparatur-Gene tragen, nicht von einer Chemotherapie profitieren. Bei Dickdarmkrebs im Stadium III und IV ist die Chemotherapie ein wesentlicher Bestandteil der Behandlung.
Wenn sich der Krebs auf Lymphknoten oder entfernte Organe ausgebreitet hat , was bei Dickdarmkrebs im Stadium III bzw. IV der Fall ist, erhöht die Zugabe der Chemotherapeutika Fluorouracil , Capecitabin oder Oxaliplatin die Lebenserwartung. Wenn die Lymphknoten keinen Krebs enthalten, sind die Vorteile einer Chemotherapie umstritten. Wenn der Krebs weitestgehend metastasiert oder nicht resezierbar ist, ist die Behandlung dann palliativ . Typischerweise können in dieser Umgebung eine Reihe verschiedener Chemotherapie-Medikamente verwendet werden. Chemotherapeutika für diese Erkrankung können Capecitabin , Fluorouracil , Irinotecan , Oxaliplatin und UFT umfassen . Die Medikamente Capecitabin und Fluorouracil sind austauschbar, wobei Capecitabin ein orales Medikament und Fluorouracil ein intravenöses Medikament ist. Einige spezifische Therapien verwendet für CRC sind CAPOX , FOLFOX , FOLFOXIRI und FOLFIRI . Antiangiogene Medikamente wie Bevacizumab werden häufig in der Erstlinientherapie hinzugefügt. Eine weitere Klasse von Medikamenten, die in der Second-Line-Einstellung verwendet werden, sind epidermale Wachstumsfaktor-Rezeptor- Inhibitoren, von denen die drei von der FDA zugelassenen sind Aflibercept , Cetuximab und Panitumumab .
Der Hauptunterschied in der Herangehensweise an Rektumkarzinom im niedrigen Stadium ist die Einbeziehung der Strahlentherapie. Häufig wird sie neoadjuvant in Verbindung mit einer Chemotherapie eingesetzt, um eine chirurgische Resektion zu ermöglichen, so dass letztlich keine Kolostomie erforderlich ist. Bei tiefliegenden Tumoren ist dies jedoch möglicherweise nicht möglich, in diesem Fall kann eine dauerhafte Kolostomie erforderlich sein. Rektumkarzinom im Stadium IV wird ähnlich wie Dickdarmkrebs im Stadium IV behandelt.
Dickdarmkrebs im Stadium IV aufgrund einer Peritonealkarzinomatose kann bei einigen Patienten mit HIPEC in Kombination mit zytoreduktiver Chirurgie behandelt werden .
Strahlentherapie
Während eine Kombination aus Bestrahlung und Chemotherapie bei Rektumkarzinom nützlich sein kann, kann die Radiochemotherapie bei einigen Patienten, die eine Behandlung benötigen, die akute behandlungsbedingte Toxizität erhöhen und hat nicht gezeigt, dass sie die Überlebensraten im Vergleich zur alleinigen Bestrahlung verbessert, obwohl sie mit weniger lokalen Wiederauftreten. Die Strahlentherapie bei Dickdarmkrebs ist aufgrund der Strahlenempfindlichkeit des Darms nicht routinemäßig. Wie die Chemotherapie kann die Strahlentherapie neoadjuvant in den klinischen Stadien T3 und T4 bei Rektumkarzinom eingesetzt werden. Dies führt zu einem Downsizing oder Downstaging des Tumors, der Vorbereitung auf die chirurgische Resektion und verringert auch die Lokalrezidivrate. Bei lokal fortgeschrittenem Rektumkarzinom hat sich die neoadjuvante Radiochemotherapie zur Standardtherapie entwickelt. Wenn eine Operation nicht möglich ist, wurde außerdem vorgeschlagen, dass die Strahlentherapie eine wirksame Behandlung gegen CRC-Lungenmetastasen ist, die von 10-15% der Menschen mit CRC entwickelt werden.
Immuntherapie
Eine Immuntherapie mit Immun-Checkpoint-Inhibitoren hat sich bei einer Art von Dickdarmkrebs mit Mismatch-Repair-Mangel und Mikrosatelliten-Instabilität als nützlich erwiesen. Pembrolizumab ist für fortgeschrittene CRC-Tumoren zugelassen, die einen MMR-Mangel aufweisen und bei denen die üblichen Behandlungen fehlgeschlagen sind. Die meisten Menschen, die sich verbessern, verschlechtern sich jedoch auch nach Monaten oder Jahren. Andere Arten von Darmkrebs ab 2017 werden noch untersucht.
Palliativpflege
Palliativmedizin wird allen Personen empfohlen, die an fortgeschrittenem Dickdarmkrebs erkrankt sind oder signifikante Symptome aufweisen.
Die Einbeziehung der Palliativmedizin kann die Lebensqualität sowohl der Person als auch ihrer Familie verbessern, indem Symptome und Angstzustände gelindert und Krankenhauseinweisungen verhindert werden.
Bei Menschen mit unheilbarem Darmkrebs kann die Palliativversorgung aus Maßnahmen bestehen, die Symptome oder Komplikationen des Krebses lindern, aber nicht versuchen, den zugrunde liegenden Krebs zu heilen, wodurch die Lebensqualität verbessert wird . Chirurgische Optionen können die nicht-kurative chirurgische Entfernung eines Teils des Krebsgewebes, die Umgehung eines Teils des Darms oder die Platzierung eines Stents umfassen. Es kann davon ausgegangen werden, dass diese Verfahren die Symptome verbessern und Komplikationen wie Blutungen aus dem Tumor, Bauchschmerzen und Darmverschluss reduzieren. Zu den nicht-operativen Methoden der symptomatischen Behandlung gehören die Strahlentherapie zur Verkleinerung des Tumors sowie Schmerzmittel.
Nachverfolgen
Das US National Comprehensive Cancer Network und die American Society of Clinical Oncology stellen Leitlinien für die Nachsorge von Dickdarmkrebs bereit. Eine Anamnese und körperliche Untersuchung werden alle 3 bis 6 Monate für 2 Jahre, dann alle 6 Monate für 5 Jahre empfohlen. Die Blutspiegelmessungen an karzinoembryonalem Antigen erfolgen nach dem gleichen Zeitpunkt, werden jedoch nur Personen mit T2- oder größeren Läsionen empfohlen, die für eine Intervention in Frage kommen. Eine CT-Untersuchung des Brustkorbs, des Abdomens und des Beckens kann in den ersten 3 Jahren bei Personen mit hohem Rezidivrisiko (z Operation (mit dem Ziel der Heilung). Eine Koloskopie kann nach 1 Jahr durchgeführt werden, es sei denn, sie konnte während des initialen Staging wegen einer obstruierenden Raumforderung nicht durchgeführt werden. In diesem Fall sollte sie nach 3 bis 6 Monaten durchgeführt werden. Wird ein Zottenpolyp, ein Polyp >1 Zentimeter oder eine hochgradige Dysplasie festgestellt, kann diese nach 3 Jahren, dann alle 5 Jahre wiederholt werden. Bei anderen Auffälligkeiten kann die Koloskopie nach 1 Jahr wiederholt werden.
Routinemäßige PET- oder Ultraschalluntersuchungen , Röntgenaufnahmen des Brustkorbs , ein großes Blutbild oder Leberfunktionstests werden nicht empfohlen.
Bei Patienten, die sich einer kurativen Operation oder einer adjuvanten Therapie (oder beidem) zur Behandlung von nicht metastasiertem Dickdarmkrebs unterzogen haben, hat sich durch intensive Überwachung und engmaschige Nachsorge kein zusätzlicher Überlebensvorteil gezeigt.
Übung
Sport könnte in Zukunft als Sekundärtherapie für Krebsüberlebende empfohlen werden. In epidemiologischen Studien kann körperliche Bewegung die kolorektale Karzinommortalität und die Gesamtmortalität senken. Die Ergebnisse für die spezifischen Trainingsmengen, die zum Beobachten eines Nutzens erforderlich waren, waren widersprüchlich. Diese Unterschiede können Unterschiede in der Tumorbiologie und der Expression von Biomarkern widerspiegeln. Menschen mit Tumoren ohne CTNNB1- Expression (β-Catenin), die am Wnt-Signalweg beteiligt sind , benötigten mehr als 18 Stunden Metabolisches Äquivalent (MET) pro Woche, ein Maß an körperlicher Betätigung, um eine Verringerung der Darmkrebsmortalität zu beobachten. Der Mechanismus, wie Bewegung das Überleben fördert, könnte an der Immunüberwachung und an Entzündungswegen beteiligt sein. In klinischen Studien wurde eine proinflammatorische Reaktion bei Patienten mit Dickdarmkrebs im Stadium II-III festgestellt, die sich nach Abschluss ihrer Primärtherapie 2 Wochen lang moderater körperlicher Aktivität unterzogen. Das oxidative Gleichgewicht kann ein weiterer möglicher Mechanismus für beobachtete Vorteile sein. Eine signifikante Abnahme von 8-oxo-dG wurde im Urin von Personen gefunden, die sich nach der Primärtherapie 2 Wochen lang moderater körperlicher Aktivität unterzogen. Andere mögliche Mechanismen können metabolische Hormone und Sexualsteroidhormone beinhalten, obwohl diese Signalwege auch bei anderen Krebsarten beteiligt sein können
Ein weiterer potentieller Biomarker kann p27 sein . Es wurde festgestellt, dass Überlebende mit Tumoren, die p27 exprimierten und mehr oder gleich 18 MET-Stunden pro Woche leisteten, eine geringere Sterblichkeitsrate bei Darmkrebs im Vergleich zu denen mit weniger als 18 MET-Stunden pro Woche hatten. Überlebende ohne p27-Expression, die trainierten, hatten schlechtere Ergebnisse. Die konstitutive Aktivierung des PI3K/AKT/mTOR-Signalwegs könnte den Verlust von p27 erklären und ein übermäßiger Energiehaushalt kann p27 hochregulieren, um die Teilung von Krebszellen zu stoppen.
Prognose
Weniger als 600 Gene sind mit den Ergebnissen bei Darmkrebs verbunden. Dazu gehören sowohl ungünstige Gene, bei denen eine hohe Expression mit einem schlechten Outcome verbunden ist, zum Beispiel das Hitzeschock-70-kDa-Protein 1 (HSPA1A) , als auch günstige Gene, bei denen eine hohe Expression mit einem besseren Überleben verbunden ist, zum Beispiel das mutmaßliche RNA-bindende Protein 3 ( RBM3) .
Wiederholungsraten
Die durchschnittliche 5-Jahres-Rezidivrate bei Patienten, bei denen die Operation erfolgreich war, beträgt 5 % bei Krebs im Stadium I, 12 % im Stadium II und 33 % im Stadium III. Sie beträgt jedoch je nach Anzahl der Risikofaktoren 9–22 % im Stadium II und 17–44 % im Stadium III.
Überlebensraten
In Europa beträgt die 5-Jahres-Überlebensrate bei Dickdarmkrebs weniger als 60 %. In der entwickelten Welt stirbt etwa ein Drittel der Menschen, die an der Krankheit leiden.
Das Überleben steht in direktem Zusammenhang mit der Erkennung und der Art des betroffenen Krebses, ist aber insgesamt bei symptomatischen Krebsarten schlecht, da sie in der Regel ziemlich fortgeschritten sind. Die Überlebensraten für die Früherkennung sind etwa fünfmal so hoch wie die von Krebs im Spätstadium. Menschen mit einem Tumor, der die Muscularis-Schleimhaut nicht durchbrochen hat (TNM-Stadium Tis, N0, M0) haben eine 5-Jahres-Überlebensrate von 100 %, während diejenigen mit invasivem Krebs von T1 (innerhalb der submukösen Schicht) oder T2 (innerhalb der Muskulatur) Schicht) haben eine durchschnittliche 5-Jahres-Überlebensrate von etwa 90 %. Diejenigen mit einem stärker invasiven Tumor ohne Lymphknotenbefall (T3-4, N0, M0) haben eine durchschnittliche 5-Jahres-Überlebensrate von etwa 70 %. Menschen mit positiven regionalen Lymphknoten (beliebige T, N1-3, M0) haben eine durchschnittliche 5-Jahres-Überlebensrate von ca. 40%, während diejenigen mit Fernmetastasen (beliebige T, alle N, M1) eine schlechte Prognose haben und die 5 Jahresüberleben reicht von <5 Prozent bis 31 Prozent. Die Prognose hängt von einer Vielzahl von Faktoren ab, darunter die körperliche Fitness der Person, das Ausmaß der Metastasen und der Tumorgrad.
Obwohl die Auswirkungen von Darmkrebs auf die Überlebenden sehr unterschiedlich sind, besteht häufig die Notwendigkeit, sich sowohl an die physischen als auch an die psychischen Folgen der Krankheit und ihrer Behandlung anzupassen. Beispielsweise treten häufig Inkontinenz, sexuelle Dysfunktion, Probleme bei der Stomaversorgung und Angst vor einem Wiederauftreten des Krebses nach Abschluss der Primärbehandlung auf.
Ein im Jahr 2021 veröffentlichter qualitativer systematischer Review zeigte, dass drei Hauptfaktoren die Anpassung an ein Leben mit und darüber hinaus beeinflussen: Unterstützungsmechanismen, Schwere der Spätfolgen der Behandlung und psychosoziale Anpassung. Daher ist es wichtig, dass den Menschen eine angemessene Unterstützung angeboten wird, damit sie sich besser an das Leben nach der Behandlung anpassen können.
Epidemiologie
Weltweit erkranken jedes Jahr mehr als 1 Million Menschen an Darmkrebs, was im Jahr 2010 zu etwa 715.000 Todesfällen führte, gegenüber 490.000 im Jahr 1990.
Seit 2012 ist es die zweithäufigste Krebsursache bei Frauen (9,2% der Diagnosen) und die dritthäufigste bei Männern (10,0%), wobei es nach Lunge , Magen und Leber die vierthäufigste Krebstodesursache ist Krebs . Es ist in entwickelten Ländern häufiger als in Entwicklungsländern. Weltweit schwanken die Inzidenzen um das Zehnfache mit den höchsten Raten in Australien, Neuseeland, Europa und den USA und den niedrigsten Raten in Afrika und Süd-Zentralasien.
Vereinigte Staaten
Dickdarmkrebs ist die zweithäufigste Ursache für das Auftreten und den Tod von Krebs bei Männern und Frauen in den Vereinigten Staaten zusammen. Im Jahr 2011 wurden schätzungsweise 141.210 Fälle diagnostiziert.
Basierend auf den Raten von 2007 bis 2009 wird bei 5,0% der heute geborenen US-amerikanischen Männer und Frauen im Laufe ihres Lebens Darmkrebs diagnostiziert. Von 2005 bis 2009 lag das Durchschnittsalter bei der Diagnose von Dickdarm- und Mastdarmkrebs in den USA bei 69 Jahren. Ungefähr 0,1% wurden unter 20 Jahren diagnostiziert; 1,1% zwischen 20 und 34; 4,0 % zwischen 35 und 44; 13,4% zwischen 45 und 54; 20,4 % zwischen 55 und 64; 24,0 % zwischen 65 und 74; 25,0 % zwischen 75 und 84; und 12,0% über 85 Jahre alt. Die Raten sind bei Männern höher (54 pro 100.000 cf 40 pro 100.000 für Frauen).
Vereinigtes Königreich
In Großbritannien erkranken jährlich etwa 41.000 Menschen an Dickdarmkrebs, was ihn zur vierthäufigsten Form macht.
Australien
Einer von 19 Männern und eine von 28 Frauen in Australien erkranken vor dem 75. Lebensjahr an Darmkrebs; einer von 10 Männern und eine von 15 Frauen wird es im Alter von 85 Jahren entwickeln.
Geschichte
Bei einer altägyptischen Mumie , die während der ptolemäischen Zeit in der Oase Dakhleh gelebt hatte, wurde Rektumkarzinom diagnostiziert .
Gesellschaft und Kultur
In den Vereinigten Staaten ist der März der Monat des Bewusstseins für Darmkrebs .
Forschung
Vorläufige in-vitro- Beweise deuten darauf hin, dass Milchsäurebakterien (z. B. Laktobazillen , Streptokokken oder Laktokokken ) durch verschiedene Mechanismen wie antioxidative Aktivität, Immunmodulation , Förderung des programmierten Zelltods , antiproliferative Wirkungen und epigenetische Modifikation vor der Entwicklung und dem Fortschreiten von Dickdarmkrebs schützen können von Krebszellen.
Mausmodelle für Darm- und Darmkrebs wurden entwickelt und werden in der Forschung verwendet.
- Der Krebsgenom-Atlas
- Der Darmkrebsatlas, der genomische und proteomische Daten zu Darmkrebsgeweben und -zelllinien integriert, wurde entwickelt.
Verweise
Externe Links
| Einstufung | |
|---|---|
| Externe Ressourcen |