Dioxolan - Dioxolane
|
|
|||
| Namen | |||
|---|---|---|---|
|
Bevorzugter IUPAC-Name
1,3-Dioxolan |
|||
|
Systematischer IUPAC-Name
1,3-Dioxacyclopentan |
|||
| Andere Namen
Dioxolan
5-Crown-2 Formales Glykol |
|||
| Bezeichner | |||
|
3D-Modell ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA-Infokarte |
100.010.422 |
||
| EG-Nummer | |||
|
PubChem- CID
|
|||
| UNII | |||
|
CompTox-Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eigenschaften | |||
| C 3 H 6 O 2 | |||
| Molmasse | 74,08 g/mol | ||
| Dichte | 1,06 g / cm 3 | ||
| Schmelzpunkt | −95 °C (−139 °F; 178 K) | ||
| Siedepunkt | 75 °C (167 °F; 348 K) | ||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
Dioxolan ist ein heterocyclisches Acetal mit der chemischen Formel (CH 2 ) 2 O 2 CH 2 . Es ist mit Tetrahydrofuran durch Austausch eines Sauerstoffs gegen eine CH 2 -Gruppe verwandt. Die entsprechenden gesättigten 6-gliedrigen C 4 O 2 -Ringe werden als Dioxane bezeichnet . Das isomere 1,2-Dioxolan (wobei die beiden Sauerstoffzentren benachbart sind) ist ein Peroxid . 1,3-Dioxolan wird als Lösungsmittel und als Co- Monomer in Polyacetalen verwendet .
Als Klasse von Verbindungen
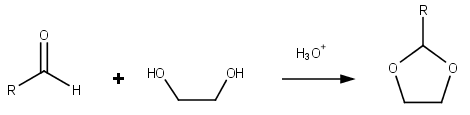
Dioxolane sind eine Gruppe organischer Verbindungen, die den Dioxolanring enthalten. Dioxolane können durch Acetalisierung von Aldehyden und Ketalisierung von Ketonen mit Ethylenglykol hergestellt werden .
(+)- cis- Dioxolan ist der Trivialname für L -(+)- cis-2 -Methyl-4-trimethylammoniummethyl-1,3-dioxolaniodid, das ein muskarinischer Acetylcholin-Rezeptor- Agonist ist .
Gruppen schützen
Organische Verbindungen, die Carbonylgruppen enthalten, müssen manchmal geschützt werden, damit sie bei Umwandlungen anderer möglicherweise vorhandener funktioneller Gruppen keine Reaktionen eingehen . Eine Vielzahl von Ansätzen zum Schützen und Entschützen von Carbonylen, einschließlich als Dioxolane, sind bekannt. Betrachten Sie zum Beispiel die Verbindung Methylcyclohexanon-4-carboxylat, bei der die Lithiumaluminiumhydrid- Reduktion 4-Hydroxymethylcyclohexanol erzeugt. Die funktionelle Estergruppe kann reduziert werden, ohne das Keton zu beeinträchtigen, indem das Keton als Ketal geschützt wird . Das Ketal wird durch eine säurekatalysierte Reaktion mit Ethylenglycol hergestellt , die Reduktionsreaktion durchgeführt und die Schutzgruppe durch Hydrolyse entfernt, um 4-Hydroxymethylcyclohexanon herzustellen.
NaBArF 4 kann auch zur Entschützung von Acetal- oder Ketal-geschützten Carbonylverbindungen verwendet werden. Beispielsweise kann die Entschützung von 2-Phenyl-1,3-dioxolan zu Benzaldehyd in Wasser in fünf Minuten bei 30 °C erreicht werden.
Natürliche Produkte
Neosporol ist ein Naturprodukt , das eine 1,3-Dioxolan- Einheit enthält , und ist ein Isomer von Sporol mit einem 1,3-Dioxan-Ring. Die Totalsynthese beider Verbindungen wurde beschrieben und umfasst jeweils einen Schritt, in dem ein Dioxolansystem unter Verwendung von Trifluorperessigsäure (TFPAA), hergestellt nach der Wasserstoffperoxid-Harnstoff- Methode, gebildet wird. Bei dieser Methode wird kein Wasser verwendet, so dass eine vollständig wasserfreie Persäure entsteht, die in diesem Fall erforderlich ist, da die Anwesenheit von Wasser zu unerwünschten Nebenreaktionen führen würde .
-
CF
3COOCOCF
3 + H
2Ö
2•CO(NH
2)
2 → CF
3COOOH + CF
3COOH + CO(NH
2)
2
Im Fall von Neosporol wird eine Prilezhaev-Reaktion mit Trifluorperessigsäure verwendet, um einen geeigneten Allylalkohol- Vorläufer in ein Epoxid umzuwandeln , das dann eine Ringerweiterungsreaktion mit einer benachbarten funktionellen Carbonylgruppe durchläuft , um den Dioxolanring zu bilden.
Ein ähnlicher Ansatz wird bei der Totalsynthese von Sporol verwendet, wobei der Dioxolanring später zu einem Dioxansystem erweitert wird.




![{\displaystyle {\ce {->[{\ce {NaBAr4}}][{\text{30 °C / 5 min}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fb42849d6133fe653a7fe5dd019b12e0f6184b5)
