Embryotransfer - Embryo transfer
| Embryotransfer 123 | |
|---|---|
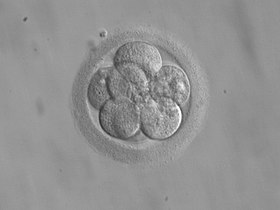 8-zelliger Embryo zum Transfer 3 Tage nach der Befruchtung
| |
| Gittergewebe | D004624 |
Embryotransfer bezieht sich auf einen Schritt im Prozess der assistierten Reproduktion, bei dem Embryonen in die Gebärmutter einer Frau eingesetzt werden, um eine Schwangerschaft zu begründen . Diese Technik (die häufig in Verbindung mit der In-vitro-Fertilisation (IVF) verwendet wird) kann bei Menschen oder Tieren angewendet werden, wobei die Ziele unterschiedlich sein können.
Der Embryotransfer kann am zweiten oder dritten Tag oder später im Blastozystenstadium erfolgen , das erstmals 1984 durchgeführt wurde.
Zu den Faktoren, die den Erfolg des Embryotransfers beeinflussen können, gehören die Aufnahmefähigkeit des Endometriums, die Embryoqualität und die Embryotransfertechnik.
Frisch versus gefroren
Embryonen können entweder „frisch“ aus befruchteten Eizellen desselben Menstruationszyklus oder „gefroren“ sein, d.h. sie wurden in einem vorhergehenden Zyklus erzeugt und einer Kryokonservierung des Embryos unterzogen und werden kurz vor dem Transfer aufgetaut, was dann als bezeichnet wird "Eingefrorener Embryotransfer" (FET). Das Ergebnis der Verwendung kryokonservierter Embryonen war einheitlich positiv ohne Zunahme von Geburtsfehlern oder Entwicklungsanomalien, auch zwischen frischen und gefrorenen Eizellen, die für die intrazytoplasmatische Spermieninjektion (ICSI) verwendet wurden. Tatsächlich sind die Schwangerschaftsraten nach FET erhöht und die perinatalen Ergebnisse werden weniger beeinflusst als beim Embryotransfer im selben Zyklus, in dem die ovarielle Hyperstimulation durchgeführt wurde. Es wird angenommen, dass das Endometrium nach einer ovariellen Hyperstimulation nicht optimal auf die Implantation vorbereitet ist . Kinder, die aus vitrifizierten Blastozysten geboren wurden, haben ein signifikant höheres Geburtsgewicht als solche, die aus nicht gefrorenen Blastozysten geboren wurden. Bei der Übertragung einer gefrorenen und aufgetauten Eizelle ist die Wahrscheinlichkeit einer Schwangerschaft im Wesentlichen gleich, unabhängig davon, ob sie in einem natürlichen Zyklus oder einem mit Ovulationsinduktion übertragen wird .
Es gibt wahrscheinlich wenig oder keinen Unterschied zwischen FET- und frischen Embryonentransfers in Bezug auf die Lebendgeburtenrate und die fortlaufende Schwangerschaftsrate, und das Risiko eines ovariellen Überstimulationssyndroms kann bei der „Freeze All“-Strategie geringer sein. Das Risiko, ein für das Gestationsalter zu großes Baby und eine höhere Geburtenrate zu bekommen, zusätzlich zu mütterlichen hypertensiven Schwangerschaftsstörungen, kann durch eine „Alles einfrieren“-Strategie erhöht werden.
Uterusvorbereitung
Beim Menschen muss die Gebärmutterschleimhaut ( Endometrium ) entsprechend vorbereitet werden, damit sich der Embryo einnisten kann. In einem natürlichen Zyklus findet der Embryotransfer in der Lutealphase zu einem Zeitpunkt statt, zu dem die Schleimhaut im Verhältnis zum aktuellen luteinisierenden Hormon entsprechend unentwickelt ist. In einem stimulierten oder Zyklus, bei dem ein "gefrorener" Embryo übertragen wird, könnte die Empfängerin zuerst Östrogenpräparate (ca. 2 Wochen) erhalten, dann eine Kombination aus Östrogen und Progesteron, damit die Schleimhaut für den Embryo empfänglich wird. Der Zeitpunkt der Empfänglichkeit ist das Implantationsfenster . Eine wissenschaftliche Überprüfung aus dem Jahr 2013 kam zu dem Ergebnis, dass es nicht möglich ist, eine Methode der Endometriumpräparation beim gefrorenen Embryotransfer als wirksamer zu identifizieren als eine andere.
Begrenzte Beweise unterstützen auch die Entfernung von Zervixschleim vor dem Transfer.
Zeitliche Koordinierung
Der Embryotransfer kann nach unterschiedlicher Dauer der Embryokultur durchgeführt werden , was verschiedene Stadien der Embryogenese verleiht . Die Hauptstadien, in denen der Embryotransfer durchgeführt wird, sind das Spaltungsstadium (Tag 2 bis 4 nach der Koinkubation ) oder das Blastozystenstadium (Tag 5 oder 6 nach der Koinkubation ).
Da sich in vivo ein Embryo im Spaltungsstadium immer noch im Eileiter befindet und bekannt ist, dass sich die Ernährungsumgebung der Gebärmutter von der der Eileiter unterscheidet, wird postuliert, dass dies zu Stress für den Embryo führen kann, wenn er am dritten Tag übertragen wird bei reduziertem Implantationspotential. Ein Embryo im Blastozystenstadium hat dieses Problem nicht, da er am besten für die Gebärmutterumgebung geeignet ist [1]
Embryonen, die das Zellstadium Tag 3 erreichen, können vor einer möglichen Übertragung durch genetische Präimplantationsdiagnostik (PID) auf chromosomale oder spezifische genetische Defekte getestet werden . Der Transfer im Blastozystenstadium führt zu einem signifikanten Anstieg der Lebendgeburtenrate pro Transfer, aber auch zu einer geringeren Anzahl von Embryonen, die für den Transfer und die Kryokonservierung von Embryonen verfügbar sind , so dass die kumulativen klinischen Schwangerschaftsraten mit dem Transfer im Spaltungsstadium erhöht werden. Es ist ungewiss, ob es einen Unterschied in der Lebendgeburtenrate zwischen der Übertragung am zweiten oder dritten Tag nach der Befruchtung gibt.
Eine monozygote Zwillingsbildung ist nach dem Blastozystentransfer im Vergleich zum Embryotransfer im Teilungsstadium nicht erhöht .
Es gibt eine signifikant höhere Wahrscheinlichkeit für Frühgeburten ( Odds Ratio 1,3) und angeborene Anomalien ( Odds Ratio 1,3) bei Geburten, die das Blastozystenstadium erreicht haben, verglichen mit dem Spaltungsstadium. Aufgrund der erhöhten Sterblichkeit weiblicher Embryonen aufgrund epigenetischer Veränderungen, die durch eine verlängerte Kultur induziert werden, führt der Blastozystentransfer zu mehr männlichen Geburten (56,1 % männlich) im Vergleich zum 2- oder 3-tägigen Transfer (ein normales Geschlechterverhältnis von 51,5 % männlich).
Embryoauswahl
Laboratorien haben Bewertungsmethoden entwickelt, um die Qualität von Eizellen und Embryonen zu beurteilen . Um die Schwangerschaftsraten zu optimieren , gibt es signifikante Hinweise darauf, dass ein morphologisches Bewertungssystem die beste Strategie für die Auswahl von Embryonen ist. Seit 2009, als das erste Zeitraffer-Mikroskopiesystem für IVF für den klinischen Einsatz zugelassen wurde, haben morphokinetische Scoring-Systeme gezeigt, dass sie die Schwangerschaftsraten weiter verbessern . Wenn jedoch alle verschiedenen Arten von Zeitraffer-Bildgebungsgeräten für Embryonen , mit oder ohne morphokinetische Bewertungssysteme, mit der konventionellen Embryonenbewertung für IVF verglichen werden, gibt es keine ausreichenden Beweise für einen Unterschied zwischen Lebendgeburt, Schwangerschaft, Totgeburt oder Fehlgeburt, um zwischen denen zu wählen Sie. Eine kleine prospektiv randomisierte Studie aus dem Jahr 2016 berichtete über eine schlechtere Embryonenqualität und mehr Personalzeit in einem automatisierten Zeitraffer-Bildgebungsgerät für Embryonen im Vergleich zur konventionellen Embryologie. Aktive Bemühungen zur Entwicklung einer genaueren Analyse der Embryonenauswahl basierend auf künstlicher Intelligenz und Deep Learning sind im Gange. Embryo Ranking Intelligent Classification Algorithm (ERICA) ist ein klares Beispiel. Diese Deep-Learning-Software ersetzt manuelle Klassifikationen auf nicht-invasive Weise durch ein Ranking-System, das auf dem vorhergesagten genetischen Status eines einzelnen Embryos basiert. Studien zu diesem Bereich stehen noch aus und aktuelle Machbarkeitsstudien belegen das Potenzial.
Verfahren
Der Embryotransfer beginnt mit dem Einführen eines Spekulums in die Vagina, um den Gebärmutterhals sichtbar zu machen, der mit Kochsalzlösung oder Kulturmedien gereinigt wird. Ein weicher Transferkatheter wird mit den Embryonen beladen und dem Kliniker nach Bestätigung der Identität des Patienten ausgehändigt. Der Katheter wird durch den Zervikalkanal eingeführt und in die Gebärmutterhöhle vorgeschoben.
Es gibt gute und konsistente Belege für den Nutzen der Ultraschallführung , d. h. die Durchführung eines Abdomenultraschalls zur Sicherstellung der korrekten Platzierung, die 1–2 cm vom Uterusfundus entfernt ist. Es gibt Hinweise auf eine signifikante Zunahme klinischer Schwangerschaften unter Ultraschallkontrolle im Vergleich zu nur "klinischer Berührung". Eine Anästhesie ist in der Regel nicht erforderlich. Insbesondere der Transfer einzelner Embryonen erfordert Genauigkeit und Präzision bei der Platzierung in der Gebärmutterhöhle. Das optimale Ziel für die Embryoplatzierung, bekannt als der Punkt des maximalen Implantationspotentials (MIP), wird mit 3D/4D-Ultraschall identifiziert. Es gibt jedoch nur begrenzte Beweise, die die Ablagerung von Embryonen im mittleren Teil der Gebärmutter unterstützen.
Nach dem Einführen des Katheters wird der Inhalt ausgestoßen und die Embryonen abgelegt. Begrenzte Beweise sprechen dafür, dass Probetransfers durchgeführt werden, bevor das Verfahren mit Embryonen durchgeführt wird. Nach der Austreibung hat die Verweildauer des Katheters in der Gebärmutter keinen Einfluss auf die Schwangerschaftsraten. Begrenzte Evidenz legt nahe, einen negativen Druck aus dem Katheter nach der Expulsion zu vermeiden. Nach der Entnahme wird der Katheter dem Embryologen übergeben, der ihn auf zurückbehaltene Embryonen untersucht.
Beim Zygoten-Intraeileiter-Transfer (ZIFT) werden der Frau Eizellen entnommen, befruchtet und dann in die Eileiter der Frau statt in die Gebärmutter gelegt.
Embryonummer
Eine wichtige Frage ist, wie viele Embryonen übertragen werden sollten, da die Platzierung mehrerer Embryonen das Risiko einer Mehrlingsschwangerschaft birgt. Während frühere Ärzte mehrere Embryonen platzierten, um die Wahrscheinlichkeit einer Schwangerschaft zu erhöhen, ist dieser Ansatz in Ungnade gefallen. Fachgesellschaften und gesetzgebende Körperschaften in vielen Ländern haben Richtlinien oder Gesetze erlassen, um diese Praxis einzuschränken. Es gibt geringe bis mäßige Hinweise darauf, dass ein doppelter Embryotransfer während eines Zyklus zu einer höheren Lebendgeburtenrate führt als ein einzelner Embryotransfer; aber die Durchführung von zwei einzelnen Embryotransfers in zwei Zyklen hat die gleiche Lebendgeburtenrate und würde Mehrlingsschwangerschaften vermeiden.
Die geeignete Anzahl der zu übertragenden Embryonen hängt vom Alter der Frau ab, ob es sich um den ersten, zweiten oder dritten vollständigen IVF-Zyklusversuch handelt und ob Embryonen von höchster Qualität zur Verfügung stehen. Gemäß einer Richtlinie des National Institute for Health and Care Excellence (NICE) aus dem Jahr 2013 sollte die Anzahl der in einem Zyklus übertragenen Embryonen wie in der folgenden Tabelle gewählt werden:
| Alter | Versuch Nr. | Embryonen übertragen |
|---|---|---|
| <37 Jahre | 1 | 1 |
| 2. | 1 wenn Top-Qualität | |
| 3. | Nicht mehr als 2 | |
| 37–39 Jahre | 1. 2 | 1 wenn Top-Qualität |
| 2 wenn keine Top-Qualität | ||
| 3. | Nicht mehr als 2 | |
| 40–42 Jahre | 2 |
e-SET
Die Technik, nur einen Embryo auszuwählen, der auf die Frau übertragen wird, wird als elektiver einzelner Embryotransfer ( e-SET ) oder, wenn sich die Embryonen im Blastozystenstadium befinden, auch als elektiver einzelner Blastozystentransfer (eSBT) bezeichnet . Es senkt signifikant das Risiko von Mehrlingsschwangerschaften, verglichen mit zB Doppelembryotransfer (DET) oder doppeltem Blastozystentransfer (2BT), mit einer Zwillingsrate von ca. 3,5 % bei sET im Vergleich zu ca. 38 % bei DET oder 2 % bei eSBT im Vergleich mit etwa 25 % in 2BT. Gleichzeitig sind die Schwangerschaftsraten bei eSBT nicht signifikant geringer als bei 2BT. Das heißt, die kumulative Lebendgeburtenrate im Zusammenhang mit dem Transfer eines einzelnen frischen Embryos, gefolgt von einem einzelnen gefrorenen und aufgetauten Embryotransfer, ist vergleichbar mit der nach einem Zyklus des doppelten Transfers frischer Embryonen. Darüber hinaus hat SET bessere Ergebnisse in Bezug auf das durchschnittliche Gestationsalter bei der Entbindung, die Art der Entbindung, das Geburtsgewicht und das Risiko der Notwendigkeit einer neonatalen Intensivstation als DET. e-SET von Embryonen im Teilungsstadium reduziert die Wahrscheinlichkeit einer Lebendgeburt um 38 % und einer Mehrlingsgeburt um 94 %. Hinweise aus randomisierten, kontrollierten Studien deuten darauf hin, dass eine Erhöhung der Anzahl der e-SET-Versuche (frisch und/oder eingefroren) zu einer kumulativen Lebendgeburtenrate ähnlich der von DET führt.
Der Einsatz von Einzelembryotransfer ist in Schweden am höchsten (69,4%), in den USA jedoch nur mit 2,8%. Der Zugang zu öffentlicher Finanzierung für ART, die Verfügbarkeit guter Kryokonservierungseinrichtungen , eine effektive Aufklärung über die Risiken einer Mehrlingsschwangerschaft und die Gesetzgebung scheinen die wichtigsten Faktoren für die regionale Nutzung des Einzelembryotransfers zu sein. Auch die persönliche Wahl spielt eine wichtige Rolle, da viele subfertile Paare eine starke Präferenz für Zwillinge haben.
Ergänzende Verfahren
Es ist ungewiss, ob der mechanische Verschluss des Gebärmutterhalskanals nach dem Embryotransfer Wirkung zeigt.
Ob Frauen nach dem Embryotransfer für eine gewisse Zeit liegen bleiben oder nicht, kann wenig oder keinen Unterschied machen.
Die Verwendung von Hyaluronsäure als Adhärenzmedium für den Embryo kann die Lebendgeburtenrate erhöhen. Eine volle Blase, die Entfernung von Zervixschleim oder das Spülen der Gebärmutterschleimhaut oder der Gebärmutterhöhle zum Zeitpunkt des Embryotransfers können wenig oder vorteilhaft sein. Eine begleitende Antibiotikagabe in Form von Amoxicillin plus Clavulansäure erhöht wahrscheinlich die klinische Schwangerschaftsrate im Vergleich zu keiner Antibiotikagabe.
Für den gefrorenen-aufgetauten Embryotransfer oder den Transfer von Embryonen aus einer Eizellspende ist für die Empfängerin vor dem Transfer keine vorherige ovarielle Hyperstimulation erforderlich, die in spontanen Ovulationszyklen durchgeführt werden kann. Es existieren jedoch auch verschiedene Protokolle für gefrorene-aufgetaute Embryotransfers, wie Protokolle mit ovarieller Hyperstimulation , Protokolle, bei denen das Endometrium künstlich durch Östrogen und/oder Progesteron präpariert wird . Es gibt Hinweise darauf, dass es in Zyklen, in denen das Endometrium künstlich durch Östrogen oder Progesteron präpariert wird, von Vorteil sein kann, ein zusätzliches Medikament zu verabreichen, das die Hormonproduktion durch die Eierstöcke unterdrückt, wie die kontinuierliche Gabe eines Gonadotropin-Releasing-Hormon-Agonisten (GnRHa). Bei der Eizellspende gibt es Hinweise auf eine niedrigere Schwangerschaftsrate und eine höhere Zyklusabbruchrate, wenn die Progesteron-Supplementierung bei der Empfängerin vor der Eizellentnahme durch die Spenderin begonnen wird, verglichen mit dem Tag, an dem die Eizellenentnahme begonnen wurde oder am Tag danach.
Die Samenflüssigkeit enthält mehrere Proteine, die mit Epithelzellen des Gebärmutterhalses und der Gebärmutter interagieren und eine aktive gestationale Immuntoleranz induzieren . Es gibt signifikant verbesserte Ergebnisse, wenn Frauen zum Zeitpunkt des Embryotransfers Samenplasma ausgesetzt sind, mit statistischer Signifikanz für die klinische Schwangerschaft , jedoch nicht für laufende Schwangerschaften oder Lebendgeburten mit den begrenzten verfügbaren Daten.
Nachverfolgen
Patienten beginnen normalerweise nach der Entnahme von Eizellen (auch Eizellen genannt) mit Progesteron-Medikamenten. Während tägliche intramuskuläre Injektionen von Progesteron-in-Öl (PIO) der Standard-Verabreichungsweg waren, sind PIO-Injektionen nicht für die Anwendung in der Schwangerschaft zugelassen. Eine kürzlich durchgeführte Metaanalyse hat gezeigt, dass die intravaginale Verabreichung mit einer geeigneten Dosis und Dosierungsfrequenz der täglichen intramuskulären Injektion entspricht. Darüber hinaus zeigte eine aktuelle Fallstudie zum Vergleich von vaginalem Progesteron mit PIO-Injektionen, dass die Lebendgeburtenraten bei beiden Methoden nahezu identisch waren. Eine Dauer der Progesterongabe von 11 Tagen führt zu fast gleichen Geburtenraten wie eine längere Dauer.
Nach dem Embryotransfer erhalten die Patienten in einigen Fällen auch Östrogen-Medikamente. Schwangerschaftstests werden in der Regel zwei Wochen nach der Eizellentnahme durchgeführt.
Reproduktion durch Dritte
Es ist nicht erforderlich, dass der Embryotransfer bei dem Weibchen durchgeführt wird, das die Eier bereitgestellt hat. So kann eine andere Frau, deren Gebärmutter entsprechend vorbereitet ist, den Embryo erhalten und schwanger werden. Der Embryotransfer kann verwendet werden, wenn eine Frau Eizellen, aber keine Gebärmutter hat und ein biologisches Baby haben möchte; sie würde die Hilfe einer Gestationsträgerin oder einer Leihmutter benötigen , um die Schwangerschaft zu tragen. Auch eine Frau, die keine Eizellen, aber eine Gebärmutter hat, kann eine Eizellspender- IVF verwenden. In diesem Fall würde eine andere Frau Eizellen zur Befruchtung bereitstellen und die resultierenden Embryonen werden in die Gebärmutter der Patientin eingesetzt. Die Befruchtung kann mit dem Sperma des Partners der Frau oder mit Spendersamen erfolgen. „Ersatz“-Embryonen, die für ein anderes Paar erzeugt wurden, das sich einer IVF-Behandlung unterzieht, aber dann den Bedarf dieses Paares übersteigen, können ebenfalls übertragen werden (sogenannte Embryonenspende ). Embryonen können gezielt durch die Verwendung von Eizellen und Samenzellen von Spendern erzeugt werden und diese können dann in die Gebärmutter einer anderen Frau übertragen werden. Eine Leihmutter kann ein durch Embryotransfer hervorgebrachtes Baby für ein anderes Paar tragen, obwohl weder sie noch das „beauftragende“ Paar mit dem Kind biologisch verwandt sind. Die Vervielfältigung durch Dritte ist umstritten und in vielen Ländern reguliert. Personen, die eine Leihmutterschaftsvereinbarung eingehen, müssen einen völlig neuen Beziehungstyp verstehen, der in keine der traditionellen Schriften passt, die wir verwenden, um Beziehungen als Verwandtschaft, Freundschaft, romantische Partnerschaft oder Marktbeziehungen zu kategorisieren. Leihmütter haben die Erfahrung, ein Baby zu tragen, von dem sie sich vorstellen, dass es nicht von ihrer eigenen Verwandtschaft ist, während beabsichtigte Mütter die Erfahrung machen, neun Monate der Schwangerschaft zu warten und von außerhalb des schwangeren Körpers zur Mutterschaft überzugehen. Dies kann zu neuen Konzeptualisierungen von Körper und Selbst führen.
Geschichte
Der erste Transfer eines Embryos von einem Menschen auf einen anderen, der zu einer Schwangerschaft führte, wurde im Juli 1983 gemeldet und führte anschließend zur Bekanntgabe der ersten menschlichen Geburt am 3. Februar 1984. Dieses Verfahren wurde am Harbour UCLA Medical Center unter der Leitung von Dr. John Buster und der University of California an der Los Angeles School of Medicine.
Dabei wurde ein sich gerade entwickelnder Embryo von einer Frau, bei der er durch künstliche Befruchtung gezeugt worden war, auf eine andere Frau übertragen, die 38 Wochen später das Kind zur Welt brachte. Das bei der künstlichen Befruchtung verwendete Sperma stammte vom Ehemann der Gebärenden.
Dieser wissenschaftliche Durchbruch setzte Maßstäbe und wurde zu einem Mittel der Veränderung für Frauen, die an Unfruchtbarkeit leiden und für Frauen, die genetische Störungen nicht an ihre Kinder weitergeben wollten. Der Spenderembryotransfer hat Frauen einen Mechanismus gegeben, um schwanger zu werden und ein Kind zur Welt zu bringen, das die genetische Ausstattung ihres Mannes enthält. Obwohl der Spenderembryotransfer, wie er heute praktiziert wird, sich aus der ursprünglichen nicht-chirurgischen Methode entwickelt hat, macht er heute etwa 5 % der registrierten Geburten durch In-vitro-Fertilisation aus.
Zuvor hatten Tausende von Frauen, die unfruchtbar waren , die Adoption als einzigen Weg zur Elternschaft. Dies schaffte die Voraussetzungen für eine offene und offene Diskussion über Embryonenspende und -transfer. Dieser Durchbruch hat der Spende menschlicher Embryonen als gängige Praxis Platz gemacht, ähnlich wie bei anderen Spenden wie Blut- und größeren Organspenden. Zum Zeitpunkt dieser Ankündigung wurde die Veranstaltung von großen Nachrichtensendern aufgezeichnet und förderte eine gesunde Debatte und Diskussion über diese Praxis, die die Zukunft der Reproduktionsmedizin beeinflusste, indem sie eine Plattform für weitere Fortschritte in der Gesundheit von Frauen schuf.
Diese Arbeit legte die technische Grundlage und den rechtlich-ethischen Rahmen rund um die klinische Verwendung der menschlichen Eizell- und Embryonenspende , einer klinischen Mainstream-Praxis, die sich in den letzten 25 Jahren entwickelt hat.
Wirksamkeit
Ein im Jahr 2012 aktualisierter systematischer Review von Cochrane zeigte, dass der Transfer des Blastozystenstadiums bei assistierten Reproduktionstechnologien effektiver ist als der Transfer im Stadium der Spaltung (Tag 2 oder 3). Es zeigte sich eine geringfügige Verbesserung der Lebendgeburtenrate pro Paar bei Blastozystentransfers. Dies würde bedeuten, dass bei einer typischen Rate von 31 % in Kliniken, die Zyklen im frühen Spaltungsstadium verwenden, die Rate auf 32 % bis 42 % Lebendgeburten steigen würde, wenn Kliniken den Blastozystentransfer verwenden. Eine kürzlich durchgeführte systematische Überprüfung hat gezeigt, dass neben der Auswahl des Embryos die während des Transferverfahrens angewendeten Techniken zu einem erfolgreichen Schwangerschaftsausgang führen können. Die folgenden Interventionen werden von der Literatur zur Verbesserung der Schwangerschaftsraten unterstützt:
• Ultraschallkontrolle des Abdomens für den Embryotransfer
• Entfernung von Zervixschleim
• Verwendung von weichen Embryotransferkathetern
• Platzierung der Embryotransferspitze im oberen oder mittleren (zentralen) Bereich der Gebärmutterhöhle, mehr als 1 cm vom Fundus entfernt, um den Embryo auszutreiben
• Sofortige Ambulanz nach Abschluss des Embryotransferverfahrens
Embryotransfer bei Tieren
Embryotransfertechniken ermöglichen es, dass weibliche Nutztiere von höchster Qualität einen größeren Einfluss auf den genetischen Fortschritt einer Herde oder Herde haben, ähnlich wie die künstliche Besamung einen größeren Einsatz von überlegenen Bullen ermöglicht hat. ET erlaubt auch die fortgesetzte Verwendung von Tieren wie Wettkampfstuten, um das Training und die Ausstellung fortzusetzen und gleichzeitig Fohlen zu produzieren . Die allgemeinen epidemiologischen Aspekte des Embryotransfers weisen darauf hin, dass der Embryotransfer die Möglichkeit bietet, genetisches Material in Nutztierpopulationen einzubringen und gleichzeitig das Risiko der Übertragung von Infektionskrankheiten erheblich zu verringern. Die jüngsten Entwicklungen bei der Geschlechtsbestimmung von Embryonen vor dem Transfer und der Implantation haben großes Potenzial in der Milch- und anderen Viehwirtschaft.
Der Embryotransfer wird auch bei Labormäusen verwendet . Embryonen von genetisch veränderten Stämmen, die schwer zu züchten oder teuer zu halten sind, können beispielsweise eingefroren und nur bei Bedarf aufgetaut und in einen scheinträchtigen Muttertier implantiert werden .
Am 19. Februar 2020 wurde im Columbus Zoo in Ohio das erste Paar Gepardenbabys geboren, das durch Embryotransfer von einer Leihgepardenmutter gezeugt wurde.
Gefrorener Embryotransfer bei Tieren
Die Entwicklung der verschiedenen Methoden der Kryokonservierung von Rinderembryonen verbesserten Embryotransfer Technik wesentlich effiziente Technik, nicht mehr abhängig von der unmittelbaren Bereitschaft geeigneten Empfängers. Die Schwangerschaftsraten liegen nur geringfügig unter denen mit frischen Embryonen. In letzter Zeit hat die Verwendung von Kryoschutzmitteln wie Ethylenglykol den direkten Transfer von Rinderembryonen ermöglicht. Das weltweit erste lebende gekreuzte Rinderkalb, das unter tropischen Bedingungen durch Direkttransfer (DT) von in Ethylenglykol-Gefriermedien eingefrorenen Embryonen hergestellt wurde, wurde am 23. Juni 1996 geboren. Dr. Binoy Sebastian Vettical vom Kerala Livestock Development Board Ltd Ethylenglycol Einfrieren Medien durch langsame programmierbare Einfrieren (SPF) Technik und direkt an den Empfänger übertragen Rinder unmittelbar nach dem Auftauen des gefrorenen Stroh in Wasser für die Geburt dieses Kalb. In einer Studie wurden in vivo produzierte gekreuzte Rinderembryonen, die eingefroren in Ethylenglykol-Gefriermedien gelagert wurden, unter tropischen Bedingungen direkt auf Empfänger übertragen und erreichten eine Schwangerschaftsrate von 50 Prozent. In einer Umfrage der nordamerikanischen Embryotransferindustrie waren die Erfolgsraten des Embryotransfers beim direkten Transfer von Embryonen genauso gut wie bei Glycerin . Darüber hinaus wurden im Jahr 2011 mehr als 95 % der gefrorenen und aufgetauten Embryonen per Direkttransfer transferiert.


