Exozytose - Exocytosis
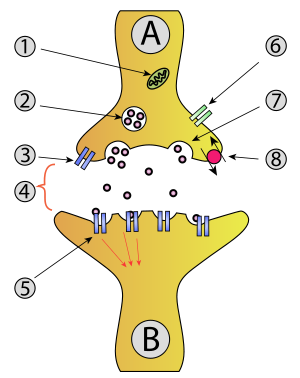
- Mitochondrium
- Synaptische Vesikel mit Neurotransmittern
- Autorezeptor
- Synapse mit freigesetztem Neurotransmitter ( Serotonin )
- Durch Neurotransmitter aktivierte postsynaptische Rezeptoren (Induktion eines postsynaptischen Potenzials)
- Kalziumkanal
- Exozytose eines Vesikels
- Wiedererlangter Neurotransmitter
Exozytose ( / ˌ ɛ k s oʊ s aɪ t oʊ s ɪ s / ) ist eine Form des aktiven Transport und den Schüttguttransport in dem eine Zelle Transportmoleküle (zB Neurotransmitter und Proteine ) aus der Zelle ( exo- + cytosis ) . Als aktiver Transportmechanismus erfordert die Exozytose den Einsatz von Energie, um Material zu transportieren. Exozytose und ihr Gegenstück, die Endozytose , werden von allen Zellen verwendet, da die meisten chemischen Substanzenfür sie wichtig sind , große polare Moleküle , die nicht durch den passieren kann hydrophoben Abschnitt des Zellmembran durch passive Mittel. Exozytose ist der Prozess, bei dem eine große Menge an Molekülen freigesetzt wird; es handelt sich also um eine Form des Massentransports. Die Exozytose erfolgt über sekretorische Portale an der Zellplasmamembran, die als Porosomen bezeichnet werden . Porosomen sind permanente becherförmige Lipoproteinstrukturen an der Zellplasmamembran, an denen sekretorische Vesikel vorübergehend andocken und fusionieren, um intravesikulären Inhalt aus der Zelle freizusetzen .
Bei der Exozytose werden membrangebundene sekretorische Vesikel zur Zellmembran transportiert , wo sie an Porosomen andocken und fusionieren und ihr Inhalt (dh wasserlösliche Moleküle) in die extrazelluläre Umgebung sezerniert wird. Diese Sekretion ist möglich, weil das Vesikel vorübergehend mit der Plasmamembran verschmilzt . Im Zusammenhang mit der Neurotransmission werden Neurotransmitter typischerweise durch Exozytose aus synaptischen Vesikeln in den synaptischen Spalt freigesetzt; Neurotransmitter können jedoch auch über den umgekehrten Transport durch Membrantransportproteine freigesetzt werden .
Exozytose ist auch ein Mechanismus, durch den Zellen Membranproteine (wie Ionenkanäle und Zelloberflächenrezeptoren ), Lipide und andere Komponenten in die Zellmembran einbringen können. Vesikel, die diese Membrankomponenten enthalten, verschmelzen vollständig mit der äußeren Zellmembran und werden ein Teil davon.
Geschichte
Der Begriff wurde 1963 von De Duve vorgeschlagen .
Typen
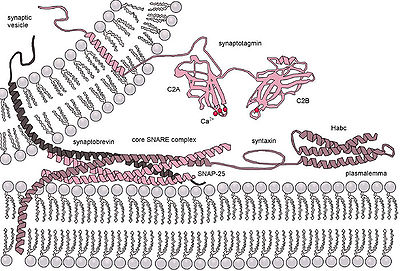
Bei Eukaryoten gibt es zwei Arten von Exozytose: 1) Ca 2+ ausgelöste nicht-konstitutive (dh regulierte Exozytose) und 2) nicht durch Ca 2+ ausgelöste konstitutive (dh nicht regulierte). Ca 2+ ausgelöste nicht-konstitutive Exozytose erfordert ein externes Signal, ein spezifisches Sortiersignal an den Vesikeln, eine Clathrinhülle sowie eine Erhöhung des intrazellulären Calciums. In vielzelligen Organismen initiiert dieser Mechanismus viele Formen der interzellulären Kommunikation wie die synaptische Übertragung, die Hormonsekretion durch neuroendokrine Zellen und die Sekretion von Immunzellen. In Neuronen und endokrinen Zellen katalysieren die SNARE-Proteine und SM-Proteine die Fusion, indem sie einen Komplex bilden, der die beiden Fusionsmembranen zusammenbringt. In Synapsen wird der SNARE-Komplex beispielsweise von Syntaxin-1 und SNAP25 an der Plasmamembran und VAMP2 an der Vesikelmembran gebildet. Die Exozytose in neuronalen chemischen Synapsen wird durch Ca 2+ ausgelöst und dient der intereuronalen Signalübertragung. Die Calciumsensoren, die die Exozytose auslösen, könnten entweder mit dem SNARE-Komplex oder mit den Phospholipiden der Fusionsmembranen interagieren. Synaptotagmin wurde als der wichtigste Sensor für die durch Ca 2+ ausgelöste Exozytose bei Tieren erkannt . Synaptotagmin-Proteine fehlen jedoch in Pflanzen und einzelligen Eukaryoten. Andere potenzielle Kalziumsensoren für die Exozytose sind EF-Handproteine (Bsp: Calmodulin) und C2-Domänen (Bsp: Ferlins, E-Synaptotagmin, Doc2b), die Proteine enthalten. Es ist unklar, wie die unterschiedlichen Calciumsensoren zusammenarbeiten und die durch Calcium ausgelöste Exozytosekinetik auf spezifische Weise vermitteln können.
Die konstitutive Exozytose wird von allen Zellen durchgeführt und dient der Freisetzung von Bestandteilen der extrazellulären Matrix oder der Abgabe neu synthetisierter Membranproteine, die nach Fusion des Transportvesikels in die Plasmamembran eingebaut werden . Es gibt keinen klaren Konsens über die Maschinen und molekularen Prozesse, die die Bildung, Knospung, Translokation und Fusion der Post-Golgi-Vesikel an die Plasmamembran antreiben. Die Fusion beinhaltet Membran-Tethering (Erkennung) und Membran-Fusion. Es ist noch unklar, ob die Maschinerie zwischen der konstitutiven und der regulierten Sekretion unterschiedlich ist. Die für die konstitutive Exozytose erforderliche Maschinerie wurde nicht so gut untersucht wie der Mechanismus der regulierten Exozytose. Zwei Bindungskomplexe sind mit der konstitutiven Exozytose bei Säugetieren verbunden, ELKS und Exocyst. ELKS ist ein großes Coiled-Coil-Protein, das auch an der synaptischen Exozytose beteiligt ist und die „Hotspots“-Fusionspunkte der sekretorischen Trägerfusion markiert. Exocyst ist ein octamerer Proteinkomplex. Bei Säugetieren lokalisieren Exozystenkomponenten sowohl in der Plasmamembran als auch im Golgi-Apparat und die Exozystenproteine sind am Fusionspunkt der Post-Golgi-Vesikel kolokalisiert. Die Membranfusion der konstitutiven Exozytose wird wahrscheinlich durch SNAP29 und Syntaxin19 an der Plasmamembran und YKT6 oder VAMP3 an der Vesikelmembran vermittelt.
Die vesikuläre Exozytose bei prokaryotischen gramnegativen Bakterien ist ein dritter Mechanismus und der neueste Befund bei der Exozytose. Das Periplasma wird als bakterielle äußere Membranvesikel (OMVs) abgeschnürt, um mikrobielle biochemische Signale in eukaryotische Wirtszellen oder andere in der Nähe befindliche Mikroben zu übertragen, um die Kontrolle der sezernierenden Mikrobe in ihrer Umgebung zu erreichen - einschließlich Invasion des Wirts, Endotoxämie, Konkurrenz mit anderen Mikroben um Ernährung usw. Dieser Befund des Membranvesikeltransports an der Wirt-Pathogen-Grenzfläche widerlegt auch den Mythos, dass die Exozytose ein reines eukaryotisches Zellphänomen ist.
Schritte
An der Exozytose sind fünf Schritte beteiligt:
Vesikelhandel
Bestimmte Vesikeltransportschritte erfordern den Transport eines Vesikels über eine mäßig kleine Distanz. Zum Beispiel werden Vesikel, die Proteine vom Golgi-Apparat zur Zelloberfläche transportieren, wahrscheinlich Motorproteine und eine zytoskelettale Spur verwenden, um ihrem Ziel näher zu kommen. Bevor das Tethering sinnvoll gewesen wäre, wären viele der für den aktiven Transport verwendeten Proteine stattdessen auf den passiven Transport eingestellt worden, da der Golgi-Apparat kein ATP zum Transport von Proteinen benötigt. Sowohl die Aktin- als auch die Mikrotubuli-Basis sind an diesen Prozessen beteiligt, zusammen mit mehreren Motorproteinen . Sobald die Vesikel ihr Ziel erreichen, kommen sie mit Bindungsfaktoren in Kontakt, die sie zurückhalten können.
Vesikel-Tethering
Es ist nützlich, zwischen der anfänglichen, lockeren Bindung der Vesikel an ihr Ziel von den stabileren Packungswechselwirkungen zu unterscheiden . Beim Tethering handelt es sich um Verbindungen über Distanzen von mehr als etwa dem halben Durchmesser eines Vesikels von einer gegebenen Membranoberfläche (>25 nm). An der Konzentrierung synaptischer Vesikel an der Synapse sind wahrscheinlich Bindungswechselwirkungen beteiligt .
Angebundene Vesikel sind auch an den Transkriptionsprozessen normaler Zellen beteiligt.
Vesikel-Docking
Sekretorische Vesikel docken vorübergehend an und verschmelzen über einen engen t-/v-SNARE-Ringkomplex am Porosom an der Zellplasmamembran.
Vesikel-Priming
In der neuronalen Exozytose wurde der Begriff Priming verwendet, um alle molekularen Umlagerungen und ATP-abhängigen Protein- und Lipidmodifikationen zu umfassen, die nach dem anfänglichen Andocken eines synaptischen Vesikels, aber vor der Exozytose stattfinden, so dass der Einstrom von Calciumionen allein ist erforderlich, um eine fast sofortige Freisetzung von Neurotransmittern auszulösen . Bei anderen Zelltypen, deren Sekretion konstitutiv (dh kontinuierlich, Calciumionen-unabhängig, nicht getriggert) ist, findet kein Priming statt.
Vesikelfusion

Die transiente Vesikelfusion wird durch SNARE- Proteine angetrieben , was zur Freisetzung von Vesikelinhalt in den extrazellulären Raum (oder im Falle von Neuronen im synaptischen Spalt) führt.
Die Verschmelzung der Donor- und Akzeptormembran erfüllt drei Aufgaben:
- Die Oberfläche der Plasmamembran vergrößert sich (um die Oberfläche des fusionierten Vesikels). Dies ist wichtig für die Regulierung der Zellgröße, zB während des Zellwachstums.
- Die Stoffe innerhalb der Vesikel werden nach außen abgegeben. Dies können Abfallprodukte oder Toxine sein oder Signalmoleküle wie Hormone oder Neurotransmitter während der synaptischen Übertragung .
- Proteine, die in die Vesikelmembran eingebettet sind, sind jetzt Teil der Plasmamembran. Die Seite des Proteins, die dem Inneren des Vesikels zugewandt war, zeigt jetzt das Äußere der Zelle. Dieser Mechanismus ist wichtig für die Regulation von Transmembranen und Transportern.
Vesikelgewinnung
Die Gewinnung synaptischer Vesikel erfolgt durch Endozytose . Die meisten synaptischen Vesikel werden ohne vollständige Fusion in die Membran ( Kiss-and-Run-Fusion ) über das Porosom recycelt . Nicht-konstitutive Exozytose und nachfolgende Endozytose sind stark energieverbrauchende Prozesse und daher von Mitochondrien abhängig .
Die Untersuchung von Zellen nach der Sekretion mittels Elektronenmikroskopie zeigt eine erhöhte Anwesenheit von teilweise leeren Vesikel nach der Sekretion. Dies deutet darauf hin, dass während des sekretorischen Prozesses nur ein Teil des vesikulären Inhalts die Zelle verlassen kann. Dies könnte nur möglich sein, wenn das Vesikel vorübergehend eine Kontinuität mit der Zellplasmamembran an den Porosomen herstellen würde , einen Teil seines Inhalts ausstößt, sich dann ablöst, wieder verschließt und sich in das Zytosol zurückzieht (Endocytose). Auf diese Weise konnte das sekretorische Vesikel für nachfolgende Exo-Endocytose-Runden wiederverwendet werden, bis es seinen Inhalt vollständig entleert hatte.
Siehe auch
- Endozytose
- Pinozytose
- Phagozytose
- Membran-Nanoröhre
- Virusausscheidung
- Präsynaptische aktive Zone
- Restkörper
- Degranulation
Verweise
Externe Links
- Exozytose an der US National Library of Medicine Medical Subject Headings (MeSH)