Fluoreszenzmikroskop - Fluorescence microscope
Ein Fluoreszenzmikroskop ist ein optisches Mikroskop , das Fluoreszenz anstelle von oder zusätzlich zu Streuung , Reflexion und Dämpfung oder Absorption verwendet , um die Eigenschaften organischer oder anorganischer Substanzen zu untersuchen. "Fluoreszenzmikroskop" bezieht sich auf jedes Mikroskop, das Fluoreszenz verwendet, um ein Bild zu erzeugen, sei es ein einfacher Aufbau wie ein Epifluoreszenzmikroskop oder ein komplizierteres Design wie ein konfokales Mikroskop , das optische Schnitte verwendet , um eine bessere Auflösung des Fluoreszenzbildes zu erzielen .
Prinzip
Die Probe wird mit Licht einer bestimmten Wellenlänge (oder Wellenlängen) beleuchtet, das von den Fluorophoren absorbiert wird , wodurch sie Licht längerer Wellenlängen (dh einer anderen Farbe als das absorbierte Licht) emittieren. Das Beleuchtungslicht wird durch die Verwendung eines spektralen Emissionsfilters von der viel schwächer emittierten Fluoreszenz getrennt. Typische Komponenten eines Fluoreszenzmikroskops sind eine Lichtquelle ( Xenonbogenlampe oder Quecksilberdampflampe sind üblich; fortgeschrittenere Formen sind Hochleistungs- LEDs und Laser ), der Anregungsfilter , der dichroitische Spiegel (oder dichroitische Strahlteiler ) und die Emission filtern (siehe Abbildung unten). Die Filter und der dichroitische Strahlteiler werden so gewählt, dass sie den spektralen Anregungs- und Emissionseigenschaften des zur Markierung der Probe verwendeten Fluorophors entsprechen. Auf diese Weise wird die Verteilung eines einzelnen Fluorophors (Farbe) gleichzeitig abgebildet. Mehrfarbenbilder von mehreren Arten von Fluorophoren müssen durch Kombinieren mehrerer Einfarbenbilder zusammengesetzt werden.
Die meisten verwendeten Fluoreszenzmikroskope sind Epifluoreszenzmikroskope, bei denen die Anregung des Fluorophors und die Detektion der Fluoreszenz durch denselben Lichtweg (dh durch das Objektiv) erfolgen. Diese Mikroskope sind in der Biologie weit verbreitet und bilden die Grundlage für fortschrittlichere Mikroskopdesigns, wie das konfokale Mikroskop und das Fluoreszenzmikroskop mit totaler interner Reflexion (TIRF).
Epifluoreszenzmikroskopie
Die meisten Fluoreszenzmikroskope, insbesondere in den Life Sciences , haben das in der Abbildung gezeigte Epifluoreszenz-Design. Licht der Anregungswellenlänge beleuchtet die Probe durch die Objektivlinse. Die von der Probe emittierte Fluoreszenz wird durch das gleiche Objektiv, das für die Anregung verwendet wird, auf den Detektor fokussiert, was für eine höhere Auflösung ein Objektiv mit höherer numerischer Apertur benötigt . Da der größte Teil des Anregungslichts durch die Probe transmittiert wird, gelangt nur reflektiertes Anregungslicht zusammen mit dem emittierten Licht zum Objektiv und das Epifluoreszenzverfahren liefert daher ein hohes Signal-Rausch-Verhältnis. Der dichroitische Strahlteiler wirkt als wellenlängenspezifischer Filter, der fluoresziertes Licht zum Okular oder Detektor durchlässt, aber verbleibendes Anregungslicht zurück zur Quelle reflektiert.
Lichtquellen
Die Fluoreszenzmikroskopie erfordert eine intensive, nahezu monochromatische Beleuchtung, die einige weit verbreitete Lichtquellen wie Halogenlampen nicht bieten können. Vier Haupttypen von Lichtquellen werden verwendet, darunter Xenonbogenlampen oder Quecksilberdampflampen mit Anregungsfilter , Laser , Superkontinuumquellen und Hochleistungs- LEDs . Laser werden am häufigsten für komplexere Fluoreszenzmikroskopietechniken wie konfokale Mikroskopie und Totalreflexions-Fluoreszenzmikroskopie verwendet, während Xenonlampen und Quecksilberlampen sowie LEDs mit einem dichroitischen Anregungsfilter häufig für Weitfeld-Epifluoreszenzmikroskope verwendet werden. Durch die Anordnung von zwei Mikrolinsenarrays im Beleuchtungspfad eines Weitfeld-Epifluoreszenzmikroskops kann eine sehr gleichmäßige Beleuchtung mit einem Variationskoeffizienten von 1-2% erreicht werden.
Probenvorbereitung
Zeigt Überlagerungen von vier Fluoreszenzkanälen an
(b) Cyan: [PLL-A546-Fluoreszenz] – generisches Gegenfärbemittel zur Visualisierung eukaryotischer Zelloberflächen
(c) Blau: [Hoechst-Fluoreszenz] – färbt DNA, identifiziert Kerne
(d) Rot: [Chlorophyll-Autofluoreszenz] - löst Chloroplasten auf

Damit eine Probe für die Fluoreszenzmikroskopie geeignet ist, muss sie fluoreszierend sein. Es gibt mehrere Methoden, um eine fluoreszierende Probe zu erzeugen; die wichtigsten Techniken sind die Markierung mit fluoreszierenden Farbstoffen oder bei biologischen Proben die Expression eines fluoreszierenden Proteins . Alternativ kann die Eigenfluoreszenz einer Probe (dh Autofluoreszenz ) verwendet werden. In den Biowissenschaften ist die Fluoreszenzmikroskopie ein leistungsstarkes Werkzeug, das die spezifische und empfindliche Färbung einer Probe ermöglicht, um die Verteilung von Proteinen oder anderen interessierenden Molekülen zu erkennen . Als Ergebnis gibt es eine Vielzahl von Techniken zur Fluoreszenzfärbung von biologischen Proben.
Biologische fluoreszierende Flecken
Viele fluoreszierende Farbstoffe wurden für eine Reihe biologischer Moleküle entwickelt. Einige davon sind kleine Moleküle, die intrinsisch fluoreszieren und ein interessierendes biologisches Molekül binden. Wichtige Beispiele hierfür sind Nukleinsäure- Färbungen wie DAPI und Hoechst (anregt durch UV-Wellenlängenlicht) und DRAQ5 und DRAQ7 (optimal angeregt durch rotes Licht), die alle die kleine Furche der DNA binden und so die Zellkerne markieren . Andere sind Medikamente, Toxine oder Peptide, die spezifische Zellstrukturen binden und mit einem fluoreszierenden Reporter derivatisiert wurden. Ein Hauptbeispiel dieser Klasse von Fluoreszenzfarbstoffen ist Phalloidin , das verwendet wird, um Aktinfasern in Säugerzellen zu färben . Ein neues Peptid, das als Collagen Hybridizing Peptide bekannt ist , kann auch mit Fluorophoren konjugiert und zum Färben von denaturierten Kollagenfasern verwendet werden. Die Färbung der Pflanzenzellwände wird unter Verwendung von Flecken oder Farbstoffe , die bind Cellulose oder Pektin . Die Suche nach fluoreszierenden Sonden mit hoher Spezifität, die auch Live-Imaging von Pflanzenzellen ermöglichen, ist im Gange.
Es gibt viele fluoreszierende Moleküle, die Fluorophore oder Fluorochrome genannt werden, wie Fluorescein , Alexa Fluors oder DyLight 488 , die chemisch mit einem anderen Molekül verbunden werden können, das das interessierende Ziel in der Probe bindet.
Immunfluoreszenz
Immunfluoreszenz ist eine Technik, die die hochspezifische Bindung eines Antikörpers an sein Antigen nutzt, um spezifische Proteine oder andere Moleküle innerhalb der Zelle zu markieren. Eine Probe wird mit einem primären Antikörper behandelt, der für das interessierende Molekül spezifisch ist. Ein Fluorophor kann direkt an den primären Antikörper konjugiert werden. Alternativ kann ein an einen Fluorophor konjugierter sekundärer Antikörper verwendet werden, der spezifisch an den ersten Antikörper bindet. Zum Beispiel könnte ein primärer Antikörper, der in einer Maus gezüchtet wurde , der Tubulin erkennt, kombiniert mit einem sekundären Anti-Maus-Antikörper, der mit einem Fluorophor derivatisiert ist, verwendet werden, um Mikrotubuli in einer Zelle zu markieren .
Fluoreszierende Proteine
Das moderne Verständnis der Genetik und die verfügbaren Techniken zur Modifikation von DNA ermöglichen es Wissenschaftlern, Proteine genetisch so zu modifizieren, dass sie auch einen fluoreszierenden Protein-Reporter tragen. In biologischen Proben ermöglicht dies einem Wissenschaftler, ein interessierendes Protein direkt fluoreszierend zu machen. Der Ort des Proteins kann dann direkt verfolgt werden, auch in lebenden Zellen.
Einschränkungen
Fluorophore verlieren ihre Fähigkeit zu fluoreszieren, wenn sie in einem Prozess namens Photobleaching beleuchtet werden . Photobleaching tritt auf, wenn die fluoreszierenden Moleküle chemische Schäden durch die während der Fluoreszenz angeregten Elektronen ansammeln. Photobleaching kann die Zeit, über die eine Probe durch Fluoreszenzmikroskopie beobachtet werden kann, stark einschränken. Es gibt mehrere Techniken, um das Photobleichen zu reduzieren, wie die Verwendung robusterer Fluorophore, durch Minimieren der Beleuchtung oder durch die Verwendung von lichtschützenden Scavenger- Chemikalien.
Die Fluoreszenzmikroskopie mit fluoreszierenden Reporterproteinen hat die Analyse von lebenden Zellen durch Fluoreszenzmikroskopie ermöglicht, jedoch sind Zellen anfällig für Phototoxizität, insbesondere bei kurzwelligem Licht. Darüber hinaus neigen fluoreszierende Moleküle dazu, unter Beleuchtung reaktive chemische Spezies zu erzeugen, was den phototoxischen Effekt verstärkt.
Im Gegensatz zu Durchlicht- und Auflichtmikroskopie-Techniken erlaubt die Fluoreszenzmikroskopie nur die Beobachtung der spezifischen Strukturen, die für die Fluoreszenz markiert wurden. Beispielsweise zeigt die Beobachtung einer mit einer fluoreszierenden DNA-Färbung präparierten Gewebeprobe durch Fluoreszenzmikroskopie nur die Organisation der DNA innerhalb der Zellen und nichts anderes über die Zellmorphologien.
Computertechniken, die vorschlagen, das Fluoreszenzsignal von nicht-fluoreszierenden Bildern (wie Hellfeld) zu schätzen, können diese Bedenken verringern. Im Allgemeinen beinhalten diese Ansätze das Trainieren eines tiefen konvolutionellen neuronalen Netzwerks auf gefärbten Zellen und das anschließende Schätzen der Fluoreszenz auf ungefärbten Proben. Durch die Entkopplung der untersuchten Zellen von den zum Trainieren des Netzwerks verwendeten Zellen kann die Bildgebung somit schneller und mit geringerer Phototoxizität durchgeführt werden.
Subbeugungstechniken
Die Wellennatur des Lichts begrenzt die Größe des Flecks, auf den Licht aufgrund der Beugungsgrenze fokussiert werden kann . Diese Einschränkung wurde im 19. Jahrhundert von Ernst Abbe beschrieben und „begrenzt die Auflösung eines Lichtmikroskops auf etwa die Hälfte der Wellenlänge des verwendeten Lichts“. Die Fluoreszenzmikroskopie ist von zentraler Bedeutung für viele Techniken, die darauf abzielen, diese Grenze durch spezielle optische Konfigurationen zu überschreiten.
Im 20. Jahrhundert wurden mehrere Verbesserungen der Mikroskopietechniken erfunden, die in gewissem Maße zu einer höheren Auflösung und einem höheren Kontrast führten. Die Beugungsgrenze wurde jedoch nicht überschritten. 1978 wurden erste theoretische Ideen entwickelt, um diese Barriere zu durchbrechen, indem ein 4Pi-Mikroskop als konfokales Laser-Scanning-Fluoreszenzmikroskop verwendet wird, bei dem das Licht ideal von allen Seiten auf einen gemeinsamen Fokus fokussiert wird, der verwendet wird, um das Objekt "Punkt für- Punkt-Anregung kombiniert mit 'Punkt-für-Punkt'-Erkennung. Die erste experimentelle Demonstration des 4pi-Mikroskops fand jedoch 1994 statt. Die 4Pi-Mikroskopie maximiert die Menge der verfügbaren Fokussierrichtungen durch die Verwendung zweier gegenüberliegender Objektivlinsen oder die Zwei-Photonen-Anregungsmikroskopie mit rotverschobenem Licht und Mehrphotonenanregung.
Die integrierte korrelative Mikroskopie kombiniert ein Fluoreszenzmikroskop mit einem Elektronenmikroskop. Dies ermöglicht es, Ultrastruktur- und Kontextinformationen mit dem Elektronenmikroskop zu visualisieren und gleichzeitig die Daten des Fluoreszenzmikroskops als Markierungswerkzeug zu verwenden.
Die erste Technik, die wirklich eine Subbeugungsauflösung erreichte , war die 1994 vorgeschlagene STED-Mikroskopie . Diese Methode und alle Techniken, die dem RESOLFT- Konzept folgen, beruhen auf einer starken nichtlinearen Wechselwirkung zwischen Licht und fluoreszierenden Molekülen. Die Moleküle werden an jedem bestimmten Ort stark zwischen unterscheidbaren Molekülzuständen getrieben, so dass schließlich Licht auf nur einem kleinen Bruchteil des Raums emittiert werden kann, also eine erhöhte Auflösung.
Ebenfalls in den 1990er Jahren wurde ein weiteres superauflösendes Mikroskopieverfahren basierend auf der Weitfeldmikroskopie entwickelt. Durch die Entwicklung der SPDM-Lokalisierungsmikroskopie und der strukturierten Laserbeleuchtung (Spatial modulated Illumination, SMI) wurde eine wesentlich verbesserte Größenauflösung von zellulären Nanostrukturen erreicht, die mit einem Fluoreszenzmarker angefärbt wurden. Die Kombination des SPDM-Prinzips mit SMI führte zur Entwicklung des Vertico SMI- Mikroskops. Die Einzelmoleküldetektion von normalen blinkenden Fluoreszenzfarbstoffen wie dem grün fluoreszierenden Protein (GFP) kann durch eine Weiterentwicklung von SPDM erreicht werden, die sogenannte SPDMphymod-Technologie, die es ermöglicht, zwei verschiedene fluoreszierende Molekültypen auf molekularer Ebene zu erkennen und zu zählen (diese Technologie wird als Zweifarben-Lokalisationsmikroskopie oder 2CLM bezeichnet).
Alternativ könnte das Aufkommen der photoaktivierten Lokalisationsmikroskopie ähnliche Ergebnisse erzielen, indem man sich auf das Blinken oder Umschalten einzelner Moleküle verlässt, wobei der Anteil der fluoreszierenden Moleküle jedes Mal sehr klein ist. Diese stochastische Reaktion von Molekülen auf das zugeführte Licht entspricht auch einer stark nichtlinearen Wechselwirkung, die zu einer Subbeugungsauflösung führt.
Fluoreszenzmikroskopische Galerie
Epifluoreszenz-Bildgebung der drei Komponenten in einer sich teilenden menschlichen Krebszelle. DNA ist blau gefärbt, ein Protein namens INCENP ist grün und die Mikrotubuli sind rot. Jeder Fluorophor wird separat unter Verwendung einer anderen Kombination von Anregungs- und Emissionsfiltern abgebildet, und die Bilder werden sequentiell mit einer digitalen CCD-Kamera aufgenommen und dann überlagert, um ein vollständiges Bild zu ergeben.
Mit DAPI gefärbter humaner Lymphozytenkern mit Chromosom 13 (grün) und 21 (rot) hybridisierte Zentromersonden ( Fluoreszierende in situ Hybridisierung (FISH))
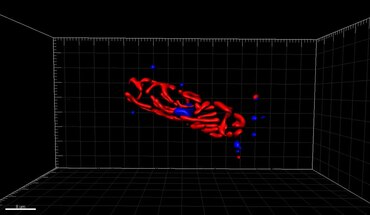
Fluoreszenzmikroskopie der DNA-Expression im menschlichen Wildtyp- und P239S-Mutanten Palladin .
Siehe auch
- Fluoreszenz-Bildgebung
- Fluoreszenz in den Life Sciences
- Korrelative Licht-Elektronen-Mikroskopie
- Elizabeth Harry , Pionierin der Fluoreszenzmikroskopietechniken zur Visualisierung bakterieller subzellulärer Proteine
- Grün fluoreszierendes Protein (GFP)
- Quecksilberdampflampe
- Mikroskop
- Rasterelektronenmikroskop#Kathodolumineszenz
- Stokes-Shift
- Xenon-Bogenlampe
Verweise
Externe Links
|
Bibliothek Ressourcen über Fluoreszenzmikroskopie |
- Fluorophore.org , die Datenbank der Fluoreszenzfarbstoffe
- Ressourcenzentrum für Mikroskopie
- Animationen und Erläuterungen zu verschiedenen Mikroskoptypen, einschließlich Fluoreszenz- und Konfokalmikroskopen (Université Paris Sud)