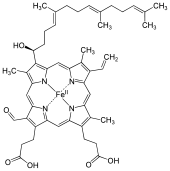
Häm A - Heme A
|
|
|||
| Namen | |||
|---|---|---|---|
| Andere Namen
Eisenzytoporphyrin IX, Formilporphyrin
|
|||
| Bezeichner | |||
|
3D-Modell ( JSmol )
|
|||
| ChemSpider | |||
| Gittergewebe | Häm+a | ||
|
PubChem- CID
|
|||
|
CompTox-Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eigenschaften | |||
| C 49 H 56 O 6 N 4 Fe | |||
| Molmasse | 852.837 | ||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
Häm A (oder Häm A ) ist ein Häm , ein Koordinationskomplex, bestehend aus einem makrocyclischen Liganden namens Porphyrin , der ein Eisenatom chelatisiert . Häm A ist ein Biomolekül und wird natürlich von vielen Organismen produziert. Häm A, erscheint in Lösung oft ein dichroitisches Grün/Rot, ist ein struktureller Verwandter von Häm B , einem Bestandteil von Hämoglobin , dem roten Farbstoff im Blut.
Beziehung zu anderen Hämen
Häm A unterscheidet sich von Häm - B , daß eine Methylseitenkette an Ringposition 8 zu einer oxydiert Formyl - Gruppe und einer hydroxyethylfarnesyl Gruppe , einer Isoprenoid - Kette, wurde auf die beigefügte Vinylseitenkette an Ringposition 2 des Bügeleisens Tetrapyrrol Häm . Häm A ist Häm o ähnlich , da beide diese Farnesyl-Addition an Position 2 aufweisen, aber Häm O hat keine Formylgruppe an Position 8, enthält aber noch die Methylgruppe. Die korrekte Struktur von Häm A, basierend auf NMR- und IR-Experimenten der reduzierten Fe(II)-Form des Häms, wurde 1975 veröffentlicht. Die Struktur wurde durch die Synthese des Dimethylesters der eisenfreien Form bestätigt.
Geschichte
Häm A wurde zuerst von dem deutschen biochemist isoliert Otto Warburg in 1951 und von ihm gezeigt , wird die aktive Komponente des integralen Membran Metalloprotein Cytochrom - c - Oxidase.
Stereochemie
Die letzte strukturelle Frage der genauen geometrischen Konfiguration des ersten Kohlenstoffs an Ringposition 3 von Ring I, dem an die Hydroxylgruppe gebundenen Kohlenstoff, wurde kürzlich als chirale S-Konfiguration veröffentlicht.
Wie Häm B ist Häm A oft über eine koordinative Bindung zwischen dem Häm-Eisen und einer konservierten Aminosäure-Seitenkette an das Apoprotein gebunden. In der wichtigen respiratorischen Protein Cytochrom c Oxidase (CCO) ist dieser Ligand 5 für das Häm A am Sauerstoffreaktionszentrum eine Histidylgruppe. Dies ist ein üblicher Ligand für viele Hämproteine, einschließlich Hämoglobin und Myoglobin .

Häm A im Cytochrom ein Teil der Cytochrom-c-Oxidase, gebunden von zwei Histidinresten (in Rosa dargestellt)
Ein Beispiel für ein Metalloprotein, das Häm A enthält, ist Cytochrom-c-Oxidase. Dieses sehr komplizierte Protein enthält Häm A an zwei verschiedenen Stellen mit jeweils unterschiedlichen Funktionen. Das Eisen des Häms A von Cytochrom a ist hexakoordiniert, also mit 6 anderen Atomen verbunden. Das Eisen des Häms A von Cytochrom a3 wird manchmal von 5 anderen Atomen gebunden, wodurch die sechste Stelle zur Verfügung steht, um Disauerstoff (molekularen Sauerstoff ) zu binden . Darüber hinaus bindet dieses Enzym 3 Kupfer-, Magnesium-, Zink- und mehrere Kalium- und Natriumionen. Es wird angenommen, dass die beiden Häm-A-Gruppen in CCO leicht Elektronen zwischen den Kupferionen und dem eng verbundenen Protein Cytochrom c austauschen.
Es wird angenommen, dass sowohl die Formylgruppe als auch die Isoprenoid- Seitenkette eine wichtige Rolle bei der Erhaltung der Energie der Sauerstoffreduktion durch Cytochrom-c-Oxidase spielen . Es wird angenommen, dass CCO für die Erhaltung der Energie der Disauerstoffreduktion verantwortlich ist, indem Protonen in den Zwischenmembran-Mitochondrienraum gepumpt werden. Es wird angenommen, dass sowohl die Formyl- als auch die Hydroxyethylfarnesylgruppe von Häm A eine wichtige Rolle in diesem kritischen Prozess spielen, wie von der einflussreichen Gruppe von S. Yoshikawa veröffentlicht wurde.
Siehe auch
- Häm
- Hämoprotein
- Cytochrom-c-Oxidase (Komplex IV der Zellatmung )