Langzeitpotenzierung - Long-term potentiation

In den Neurowissenschaften ist die Langzeitpotenzierung ( LTP ) eine anhaltende Stärkung von Synapsen basierend auf aktuellen Aktivitätsmustern. Dabei handelt es sich um synaptische Aktivitätsmuster, die eine lang anhaltende Steigerung der Signalübertragung zwischen zwei Neuronen bewirken . Das Gegenteil von LTP ist die Langzeitdepression , die zu einer lang anhaltenden Abnahme der synaptischen Stärke führt.
Es ist eines von mehreren Phänomenen, die der synaptischen Plastizität zugrunde liegen , der Fähigkeit chemischer Synapsen , ihre Stärke zu ändern. Da angenommen wird , dass Erinnerungen durch Modifikation der synaptischen Stärke kodiert werden , wird LTP weithin als einer der wichtigsten zellulären Mechanismen angesehen , die dem Lernen und Gedächtnis zugrunde liegen .
LTP wurde 1966 von Terje Lømo im Kaninchen- Hippocampus entdeckt und ist seitdem ein beliebtes Forschungsobjekt geblieben. Viele moderne LTP-Studien versuchen, ihre grundlegende Biologie besser zu verstehen, während andere darauf abzielen, einen kausalen Zusammenhang zwischen LTP und Verhaltenslernen herzustellen. Wieder andere versuchen, pharmakologische oder andere Methoden zur Verbesserung von LTP zu entwickeln, um Lernen und Gedächtnis zu verbessern. LTP ist auch Gegenstand der klinischen Forschung , beispielsweise in den Bereichen Alzheimer und Suchtmedizin .
Geschichte
Frühe Theorien des Lernens

Ende des 19. Jahrhunderts erkannten Wissenschaftler allgemein, dass die Zahl der Neuronen im erwachsenen Gehirn (ungefähr 100 Milliarden) mit dem Alter nicht signifikant zunahm, was Neurobiologen gute Gründe zu der Annahme gab, dass Erinnerungen im Allgemeinen nicht das Ergebnis einer neuen Neuronenproduktion sind. Mit dieser Erkenntnis entstand die Notwendigkeit zu erklären, wie sich Erinnerungen ohne neue Neuronen bilden können.
Der spanische Neuroanatom Santiago Ramón y Cajal war einer der ersten, der einen Lernmechanismus vorschlug, der keine Bildung neuer Neuronen erfordert. In seiner Croonian Lecture von 1894 schlug er vor, dass Erinnerungen stattdessen durch die Stärkung der Verbindungen zwischen bestehenden Neuronen gebildet werden könnten, um die Effektivität ihrer Kommunikation zu verbessern. Die 1949 von Donald Hebb eingeführte hebbianische Theorie wiederholte die Ideen von Ramón y Cajal und schlug weiter vor, dass Zellen neue Verbindungen aufbauen oder metabolische und synaptische Veränderungen durchmachen können, die ihre Fähigkeit zur Kommunikation verbessern und ein neuronales Netzwerk von Erfahrungen schaffen:
Nehmen wir an, dass die Persistenz oder Wiederholung einer hallenden Aktivität (oder "Spur") dazu neigt, dauerhafte zelluläre Veränderungen zu induzieren, die zu ihrer Stabilität beitragen.... Wenn ein Axon von Zelle A nahe genug ist, um eine Zelle B zu erregen und wiederholt oder beharrlich daran beteiligt ist, es zu feuern, findet in einer oder beiden Zellen ein Wachstumsprozess oder eine metabolische Veränderung statt, so dass die Effizienz von A als einer der Zellen, die B feuert, erhöht wird.
Eric Kandel (1964) und Mitarbeiter waren einige der ersten Forscher, die während ihrer Arbeit mit Meeresschnecken Aplysia eine langfristige Potenzierung entdeckten. Sie versuchten, Verhaltenskonditionierungen auf verschiedene Zellen im neuronalen Netzwerk der Nacktschnecke anzuwenden. Ihre Ergebnisse zeigten Veränderungen der synaptischen Stärke und die Forscher vermuteten, dass dies auf eine grundlegende Form des Lernens innerhalb der Schnecke zurückzuführen sein könnte.
Obwohl diese Theorien der Gedächtnisbildung heute gut etabliert sind, waren sie für ihre Zeit weitsichtig: Neurowissenschaftler und Psychologen des späten 19. und frühen 20. Jahrhunderts waren nicht mit den neurophysiologischen Techniken ausgestattet, die notwendig waren, um die biologischen Grundlagen des Lernens bei Tieren aufzuklären. Diese Fähigkeiten kamen erst in der zweiten Hälfte des 20. Jahrhunderts, etwa zeitgleich mit der Entdeckung der langfristigen Potenzierung.
Entdeckung
LTP wurde erstmals 1966 von Terje Lømo im Oslo , Norwegen , Labor von Per Andersen beobachtet . Dort führte Lømo eine Reihe neurophysiologischer Experimente an narkotisierten Kaninchen durch, um die Rolle des Hippocampus im Kurzzeitgedächtnis zu untersuchen .
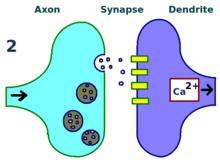
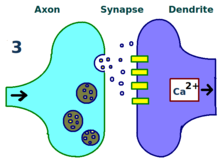
Lømos Experimente konzentrierten sich auf Verbindungen oder Synapsen vom perforanten Weg zum Gyrus dentatus . Diese Experimente wurden durchgeführt, indem präsynaptische Fasern des Perforationswegs stimuliert und Reaktionen von einer Sammlung postsynaptischer Zellen des Gyrus dentatus aufgezeichnet wurden. Wie erwartet, verursachte ein einzelner elektrischer Stimulationsimpuls auf Fasern des Perforationswegs exzitatorische postsynaptische Potentiale (EPSPs) in Zellen des Gyrus dentatus. Was Lømo unerwartet beobachtete, war, dass die Reaktion der postsynaptischen Zellen auf diese Einzelimpuls-Stimuli über einen langen Zeitraum verstärkt werden konnte, wenn er zuerst eine Hochfrequenz-Stimulationskette an die präsynaptischen Fasern abgab. Wenn ein solcher Reizzug angewendet wurde, riefen nachfolgende Einzelimpuls-Stimuli stärkere, verlängerte EPSPs in der postsynaptischen Zellpopulation hervor. Dieses Phänomen, bei dem ein hochfrequenter Stimulus eine dauerhafte Verbesserung der Reaktion der postsynaptischen Zellen auf nachfolgende Einzelimpuls-Stimuli bewirken kann, wurde zunächst als "lang anhaltende Potenzierung" bezeichnet.
Timothy Bliss , der 1968 in das Andersen-Labor eintrat, arbeitete mit Lømo zusammen und 1973 veröffentlichten die beiden die erste Charakterisierung einer lang anhaltenden Potenzierung im Kaninchen- Hippocampus. Bliss und Tony Gardner-Medwin veröffentlichten einen ähnlichen Bericht über lang anhaltende Potenzierung beim wachen Tier, der in derselben Ausgabe wie der Bericht von Bliss und Lømo erschien. 1975 schlugen Douglas und Goddard "Langzeitpotenzierung" als neuen Namen für das Phänomen der Langzeitpotenzierung vor. Andersen schlug vor, dass die Autoren "Langzeitpotenzierung" wählten, vielleicht wegen ihres leicht auszusprechenden Akronyms "LTP".
Modelle und Theorie
Der physikalische und biologische Mechanismus von LTP ist noch nicht verstanden, aber einige erfolgreiche Modelle wurden entwickelt. [1] Studien an dendritischen Dornen , hervorstehenden Strukturen auf Dendriten, die im Laufe von Minuten oder Stunden physisch wachsen und sich zurückziehen, haben aufgrund ihrer Beziehung zu intrazellulären Kalziumtransienten eine Beziehung zwischen dem elektrischen Widerstand der Wirbelsäule und der effektiven Synapsenstärke nahegelegt . Mathematische Modelle wie die BCM-Theorie , die auch von intrazellulärem Kalzium in Bezug auf NMDA-Rezeptor- Spannungsgatter abhängt , wurden seit den 1980er Jahren entwickelt und modifizieren das traditionelle a priori hebbianische Lernmodell mit biologischer und experimenteller Begründung. Wieder andere haben vorgeschlagen, die Beziehung zwischen Rezeptorregulation, LTP und synaptischer Stärke neu anzuordnen oder zu synchronisieren.
Typen
Seit seiner ursprünglichen Entdeckung im Hippocampus von Kaninchen wurde LTP in einer Vielzahl anderer neuraler Strukturen beobachtet, einschließlich der Großhirnrinde , des Kleinhirns , der Amygdala und vielen anderen. Robert Malenka, ein prominenter LTP-Forscher, hat vorgeschlagen, dass LTP sogar an allen erregenden Synapsen im Gehirn von Säugetieren auftreten kann.
Verschiedene Bereiche des Gehirns weisen unterschiedliche Formen von LTP auf. Der spezifische LTP-Typ zwischen Neuronen hängt von einer Reihe von Faktoren ab. Ein solcher Faktor ist das Alter des Organismus, wenn LTP beobachtet wird. Zum Beispiel unterscheiden sich die molekularen Mechanismen der LTP im unreifen Hippocampus von den Mechanismen, die der LTP des erwachsenen Hippocampus zugrunde liegen. Die Signalwege, die von einer bestimmten Zelle verwendet werden, tragen ebenfalls zum spezifischen vorhandenen LTP-Typ bei. Zum Beispiel hängen einige Arten von Hippocampus-LTP vom NMDA-Rezeptor ab , andere können vom metabotropen Glutamatrezeptor (mGluR) abhängen, während noch andere von einem anderen Molekül insgesamt abhängen. Die Vielfalt der Signalwege, die zu LTP beitragen, und die weite Verteilung dieser verschiedenen Wege im Gehirn sind Gründe dafür, dass die Art von LTP zwischen Neuronen nur teilweise von der anatomischen Stelle abhängt, an der LTP beobachtet wird. Zum Beispiel ist LTP im kollateralen Schaffer- Weg des Hippocampus NMDA-Rezeptor-abhängig – dies wurde durch die Anwendung von AP5 bewiesen , einem Antagonisten des NMDA-Rezeptors, der LTP in diesem Weg verhinderte. Umgekehrt ist LTP im Moosfaserweg vom NMDA-Rezeptor unabhängig, obwohl beide Wege im Hippocampus liegen.
Die zur Induktion von LTP erforderliche prä- und postsynaptische Aktivität sind weitere Kriterien, nach denen LTP klassifiziert wird. Im Großen und Ganzen ermöglicht dies die Klassifizierung von LTP in hebbische, nicht-hebbische und anti-hebbische Mechanismen. In Anlehnung an Hebbs Postulat , zusammengefasst in der Maxime, dass "Zellen, die zusammen feuern, miteinander verdrahten", erfordert Hebbian LTP eine gleichzeitige prä- und postsynaptische Depolarisation für seine Induktion. Nicht-Hebbian-LTP ist eine Art von LTP, die eine solche gleichzeitige Depolarisation von prä- und postsynaptischen Zellen nicht erfordert; ein Beispiel dafür tritt in der moosigen Faser des Hippocampus auf. Ein Sonderfall der nicht-hebbischen LTP, die anti-hebbische LTP, erfordert explizit gleichzeitige präsynaptische Depolarisation und relative postsynaptische Hyperpolarisation für ihre Induktion.
Aufgrund seiner vorhersagbaren Organisation und der leicht induzierbaren LTP wurde der CA1-Hippocampus zum prototypischen Ort für LTP-Studien bei Säugetieren. Insbesondere die NMDA-Rezeptor-abhängige LTP im erwachsenen CA1-Hippocampus ist die am häufigsten untersuchte Art von LTP und steht daher im Mittelpunkt dieses Artikels.
Eigenschaften
NMDA-Rezeptor-abhängige LTP weist mehrere Eigenschaften auf, einschließlich Input-Spezifität, Assoziativität, Kooperativität und Persistenz.
- Eingabespezifität
- Einmal induziert, breitet sich LTP an einer Synapse nicht auf andere Synapsen aus; vielmehr ist LTP eingabespezifisch . Die Langzeitpotenzierung wird nur auf diese Synapsen nach den Regeln der Assoziativität und Kooperativität übertragen. Die Eingangsspezifität von LTP kann jedoch bei kurzen Entfernungen unvollständig sein. Ein Modell zur Erklärung der Input-Spezifität von LTP wurde 1997 von Frey und Morris vorgestellt und wird als synaptische Tagging-and-Capture- Hypothese bezeichnet.
- Assoziativität
- Assoziativität bezieht sich auf die Beobachtung, dass, wenn eine schwache Stimulation eines einzelnen Signalwegs für die Induktion von LTP nicht ausreicht, eine gleichzeitige starke Stimulation eines anderen Signalwegs LTP auf beiden Signalwegen induziert.
- Kooperation
- LTP kann entweder durch eine starke tetanische Stimulation eines einzelnen Weges zu einer Synapse oder kooperativ durch die schwächere Stimulation vieler induziert werden . Wenn ein Weg in eine Synapse schwach stimuliert wird, erzeugt er eine unzureichende postsynaptische Depolarisation, um LTP zu induzieren. Im Gegensatz dazu können, wenn schwache Stimuli auf viele Bahnen angewendet werden, die auf einem einzelnen Fleck der postsynaptischen Membran konvergieren, die einzelnen erzeugten postsynaptischen Depolarisationen die postsynaptische Zelle kollektiv genug depolarisieren, um kooperativ LTP zu induzieren. Das später diskutierte synaptische Tagging kann ein gemeinsamer Mechanismus sein, der Assoziativität und Kooperativität zugrunde liegt. Bruce McNaughton argumentiert, dass jeder Unterschied zwischen Assoziativität und Kooperativität streng semantisch ist. Experimente, die durch Stimulieren einer Reihe einzelner dendritischer Dornen durchgeführt wurden, haben gezeigt, dass die synaptische Kooperativität von nur zwei benachbarten dendritischen Dornen eine Langzeitdepression (LTD) verhindert, die nur LTP erlaubt.
- Beharrlichkeit
- LTP ist persistent und dauert von einigen Minuten bis zu vielen Monaten, und es ist diese Persistenz, die LTP von anderen Formen synaptischer Plastizität unterscheidet .
Frühe Phase
Instandhaltung
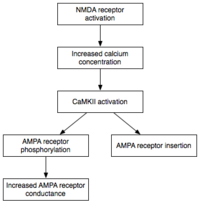
Während die Induktion die vorübergehende Aktivierung von CaMKII und PKC mit sich bringt , ist die Aufrechterhaltung von E-LTP (LTP der frühen Form) durch ihre anhaltende Aktivierung gekennzeichnet. Während dieses Stadiums wird PKMz ( Proteinkinase Mζ ), die nicht von Calcium abhängig ist, autonom aktiv. Folglich sind sie in der Lage, die Phosphorylierungsereignisse durchzuführen, die der E-LTP-Expression zugrunde liegen.
Ausdruck
Phosphorylierung ist eine chemische Reaktion, bei der eine kleine Phosphatgruppe an ein anderes Molekül angefügt wird, um die Aktivität dieses Moleküls zu verändern. Autonom aktive CaMKII und PKC verwenden Phosphorylierung, um die beiden Hauptmechanismen durchzuführen, die der Expression von E-LTP zugrunde liegen. Erstens und am wichtigsten phosphorylieren sie vorhandene AMPA-Rezeptoren , um deren Aktivität zu erhöhen. Zweitens vermitteln oder modulieren sie die Insertion zusätzlicher AMPA-Rezeptoren in die postsynaptische Membran. Wichtig ist, dass die Abgabe von AMPA-Rezeptoren an die Synapse während der E-LTP unabhängig von der Proteinsynthese ist . Dies wird durch einen nichtsynaptischen Pool von AMPA-Rezeptoren neben der postsynaptischen Membran erreicht. Wenn der geeignete LTP-induzierende Stimulus eintrifft, werden nichtsynaptische AMPA-Rezeptoren unter dem Einfluss von Proteinkinasen schnell in die postsynaptische Membran transportiert. Wie bereits erwähnt, sind AMPA-Rezeptoren die am häufigsten vorkommenden Glutamatrezeptoren des Gehirns und vermitteln den Großteil seiner erregenden Aktivität. Durch die Erhöhung der Effizienz und Anzahl der AMPA-Rezeptoren an der Synapse erzeugen zukünftige exzitatorische Reize größere postsynaptische Reaktionen.
Während das obige Modell von E-LTP vollständig postsynaptische Mechanismen zur Induktion, Aufrechterhaltung und Expression beschreibt, kann eine zusätzliche Komponente der Expression präsynaptisch auftreten. Eine Hypothese dieser präsynaptischen Fazilitation ist, dass eine anhaltende CaMKII-Aktivität in der postsynaptischen Zelle während der E-LTP zur Synthese eines "retrograden Botenstoffes" führen kann, der später diskutiert wird. Nach dieser Hypothese wandert der neu synthetisierte Botenstoff durch den synaptischen Spalt von der postsynaptischen zur präsynaptischen Zelle, was zu einer Kette von Ereignissen führt, die die präsynaptische Reaktion auf nachfolgende Reize erleichtert. Solche Ereignisse können eine Zunahme der Anzahl der Neurotransmitter-Vesikel, die Wahrscheinlichkeit der Vesikelfreisetzung oder beides umfassen. Zusätzlich zu dem retrograden Botenstoff, der der präsynaptischen Expression im frühen LTP zugrunde liegt , kann der retrograde Botenstoff auch eine Rolle bei der Expression des späten LTP spielen.
Spätphase
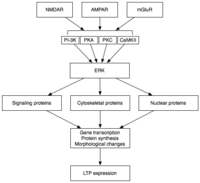
Late LTP (L-LTP) ist die natürliche Erweiterung von E-LTP. Im Gegensatz zu E-LTP, das unabhängig von der Proteinsynthese ist, erfordert L-LTP eine Gentranskription und Proteinsynthese in der postsynaptischen Zelle. Es gibt zwei Phasen von L-LTP: Die erste hängt von der Proteinsynthese ab, während die zweite sowohl von der Gentranskription als auch von der Proteinsynthese abhängt. Diese Phasen werden gelegentlich als LTP2 bzw. LTP3 bezeichnet, wobei E-LTP unter dieser Nomenklatur als LTP1 bezeichnet wird.
Induktion
Die späte LTP wird durch Veränderungen der Genexpression und Proteinsynthese induziert, die durch die anhaltende Aktivierung von Proteinkinasen, die während der E-LTP aktiviert werden, wie MAPK, hervorgerufen werden. Tatsächlich könnte MAPK – insbesondere die extrazelluläre signalregulierte Kinase (ERK)-Unterfamilie der MAPKs – die molekulare Verbindung zwischen E-LTP und L-LTP sein, da viele an E-LTP beteiligte Signalkaskaden, einschließlich CaMKII und PKC, konvergieren können auf ERK. Neuere Forschungen haben gezeigt, dass die Induktion von L-LTP von zusammenfallenden molekularen Ereignissen abhängen kann, nämlich PKA-Aktivierung und Kalziumeinstrom, die auf CRTC1 (TORC1) konvergieren, einem potenten Transkriptionskoaktivator für das cAMP-Response-Element-Bindungsprotein (CREB). Dieses Erfordernis einer molekularen Koinzidenz erklärt perfekt die assoziative Natur von LTP und vermutlich auch die des Lernens.
Instandhaltung
Bei Aktivierung kann ERK eine Reihe von zytoplasmatischen und nuklearen Molekülen phosphorylieren, was letztendlich zu der Proteinsynthese und morphologischen Veränderungen führt, die bei L-LTP beobachtet werden. Diese zytoplasmatischen und nukleären Moleküle können Transkriptionsfaktoren wie CREB umfassen. ERK-vermittelte Veränderungen der Transkriptionsfaktoraktivität können die Synthese von Proteinen auslösen, die der Aufrechterhaltung von L-LTP zugrunde liegen. Ein solches Molekül kann Proteinkinase Mζ (PKMζ) sein, eine anhaltend aktive Kinase, deren Synthese nach der LTP-Induktion zunimmt. PKMζ ist eine atypische Isoform von PKC, der eine regulatorische Untereinheit fehlt und die daher konstitutiv aktiv bleibt. Im Gegensatz zu anderen Kinasen, die LTP vermitteln, ist PKMζ nicht nur in den ersten 30 Minuten nach der LTP-Induktion aktiv; vielmehr wird PKMζ nur während der späten Phase des LTP zu einer Voraussetzung für die LTP-Aufrechterhaltung. PKMζ erscheint daher wichtig für die Persistenz des Gedächtnisses und wird als wichtig für die Aufrechterhaltung des Langzeitgedächtnisses erwartet . Tatsächlich führt die Verabreichung eines PKMζ-Inhibitors in den Hippocampus der Ratte zu einer retrograden Amnesie mit intaktem Kurzzeitgedächtnis ; PKMζ spielt beim Aufbau des Kurzzeitgedächtnisses keine Rolle. Es wurde kürzlich gezeigt, dass PKMζ der Aufrechterhaltung von L-LTP zugrunde liegt, indem es den Transport und die Reorganisation von Proteinen im synaptischen Gerüst steuert, die der Expression von LTP zugrunde liegen. Noch vor kurzem zeigen transgene Mäuse, denen PKMζ fehlt, normales LTP, was die Notwendigkeit von PKMζ in Frage stellt.
Die langfristige Stabilisierung synaptischer Veränderungen wird auch durch eine parallele Zunahme prä- und postsynaptischer Strukturen wie axonaler Bouton , dendritischer Spine und postsynaptischer Dichte bestimmt . Auf molekularer Ebene korreliert eine Zunahme der postsynaptischen Gerüstproteine PSD-95 und Homer1c mit der Stabilisierung der synaptischen Vergrößerung.
Ausdruck
Die Identitäten von nur wenigen Proteinen, die während der L-LTP synthetisiert werden, sind bekannt. Unabhängig von ihrer Identität wird angenommen, dass sie zur Erhöhung der dendritischen Dornzahl , der Oberfläche und der postsynaptischen Sensitivität gegenüber Neurotransmittern im Zusammenhang mit der L-LTP-Expression beitragen . Letzteres kann teilweise durch die verstärkte Synthese von AMPA-Rezeptoren während L-LTP bewirkt werden. Die späte LTP ist auch mit der präsynaptischen Synthese von Synaptotagmin und einer Erhöhung der synaptischen Vesikelzahl verbunden , was darauf hindeutet, dass L-LTP die Proteinsynthese nicht nur in postsynaptischen Zellen, sondern auch in präsynaptischen Zellen induziert. Wie zuvor erwähnt, muss eine Kommunikation von der postsynaptischen zu der präsynaptischen Zelle stattfinden, damit die postsynaptische LTP-Induktion zu einer präsynaptischenProteinsynthese führt. Dies kann über die Synthese eines retrograden Botenstoffs erfolgen, der später diskutiert wird.
Selbst in Studien, die auf postsynaptische Ereignisse beschränkt waren, haben die Forscher den Ort der Proteinsynthese, die L-LTP zugrunde liegt, nicht bestimmt. Konkret ist unklar, ob die Proteinsynthese im postsynaptischen Zellkörper oder in seinen Dendriten stattfindet . Obwohl bereits in den 1960er Jahren Ribosomen (die Hauptkomponenten der Proteinsynthesemaschinerie) in Dendriten beobachtet wurden, herrschte die vorherrschende Meinung vor, dass der Zellkörper der vorherrschende Ort der Proteinsynthese in Neuronen ist. Diese Argumentation wurde erst in den 1980er Jahren ernsthaft in Frage gestellt, als Forscher über die Beobachtung der Proteinsynthese in Dendriten berichteten, deren Verbindung zu ihrem Zellkörper getrennt wurde. In jüngerer Zeit haben Forscher gezeigt, dass diese Art der lokalen Proteinsynthese für einige Arten von LTP notwendig ist.
Ein Grund für die Popularität der Hypothese der lokalen Proteinsynthese ist, dass sie einen möglichen Mechanismus für die mit LTP verbundene Spezifität bereitstellt. Wenn tatsächlich die lokale Proteinsynthese L-LTP zugrunde liegt, werden nur dendritische Dornen, die LTP-induzierende Stimuli erhalten, LTP unterzogen; die Potenzierung wird nicht auf benachbarte Synapsen übertragen. Im Gegensatz dazu erfordert die globale Proteinsynthese, die im Zellkörper stattfindet, dass Proteine in jeden Bereich der Zelle transportiert werden, einschließlich Synapsen, die keine LTP-induzierenden Stimuli erhalten haben. Während die lokale Proteinsynthese einen Mechanismus für die Spezifität bereitstellt, scheint die globale Proteinsynthese sie direkt zu beeinträchtigen. Wie jedoch später diskutiert wird, bringt die synaptische Tagging-Hypothese erfolgreich globale Proteinsynthese, Synapsenspezifität und Assoziativität in Einklang.
Retrograde Signalisierung
Retrograde Signalübertragung ist eine Hypothese, die zu erklären versucht, dass LTP zwar postsynaptisch induziert und exprimiert wird, aber einige Hinweise darauf hindeuten, dass es auch präsynaptisch exprimiert wird. Die Hypothese hat ihren Namen, weil die normale synaptische Übertragung gerichtet ist und von der präsynaptischen zur postsynaptischen Zelle verläuft. Damit die Induktion postsynaptisch erfolgt und teilweise präsynaptisch exprimiert wird, muss eine Nachricht von der postsynaptischen Zelle zur präsynaptischen Zelle in retrograder (umgekehrter) Richtung wandern . Dort angekommen, löst die Nachricht vermutlich eine Kaskade von Ereignissen aus, die zu einer präsynaptischen Expressionskomponente führt, wie beispielsweise der erhöhten Wahrscheinlichkeit der Freisetzung von Neurotransmittervesikeln .
Retrograde Signalgebung ist derzeit ein umstrittenes Thema, da einige Forscher nicht glauben, dass die präsynaptische Zelle überhaupt zur Expression von LTP beiträgt. Selbst unter Befürwortern der Hypothese gibt es Kontroversen über die Identität des Boten. Frühe Gedanken konzentrierten sich auf Stickstoffmonoxid , während die neuesten Erkenntnisse auf Zelladhäsionsproteine hindeuten.
Synaptisches Tagging
Bevor die Hypothese der lokalen Proteinsynthese signifikante Unterstützung erhielt, war man sich einig, dass die L-LTP zugrunde liegende Proteinsynthese im Zellkörper stattfindet. Weiterhin wurde angenommen, dass die Produkte dieser Synthese auf unspezifische Weise zellweit transportiert wurden. Es wurde daher notwendig zu erklären, wie die Proteinsynthese im Zellkörper erfolgen kann, ohne die Input-Spezifität von LTP zu beeinträchtigen. Die Synaptic-Tagging-Hypothese versucht, das schwierige Problem der Zelle zu lösen, Proteine im Zellkörper zu synthetisieren, aber sicherzustellen, dass sie nur Synapsen erreichen, die LTP-induzierende Stimuli erhalten haben.
Die synaptische Tagging-Hypothese schlägt vor, dass ein "synaptischer Tag" an Synapsen synthetisiert wird, die LTP-induzierende Stimuli erhalten haben, und dass dieser synaptische Tag dazu dienen kann, plastizitätsbezogene Proteine einzufangen, die zellweit aus dem Zellkörper transportiert werden. Studien zu LTP in der Meeresschnecke Aplysia californica haben die synaptische Markierung als Mechanismus für die Input-Spezifität von LTP impliziert. Es gibt einige Hinweise darauf, dass bei zwei weit voneinander entfernten Synapsen ein LTP-induzierender Stimulus an einer Synapse mehrere Signalkaskaden (vorher beschrieben) antreibt, die die Genexpression im Zellkern einleiten. An derselben Synapse (aber nicht an der unstimulierten Synapse) erzeugt die lokale Proteinsynthese einen kurzlebigen (weniger als drei Stunden) synaptischen Tag. Die Produkte der Genexpression werden weltweit durch die Zelle transportiert, aber nur von Synapsen eingefangen, die das synaptische Tag exprimieren. Somit wird nur die Synapse, die LTP-induzierende Stimuli empfängt, potenziert, was die Eingangsspezifität von LTP demonstriert.
Die synaptische Tag-Hypothese kann auch für die Assoziativität und Kooperativität von LTP verantwortlich sein. Assoziativität ( siehe Eigenschaften ) wird beobachtet, wenn eine Synapse mit LTP-induzierender Stimulation angeregt wird, während eine separate Synapse nur schwach stimuliert wird. Während man erwarten könnte, dass nur die stark stimulierte Synapse LTP durchläuft (da schwache Stimulation allein nicht ausreicht, um LTP an beiden Synapsen zu induzieren), werden beide Synapsen tatsächlich LTP durchlaufen. Während schwache Reize die Proteinsynthese im Zellkörper nicht induzieren können, können sie die Synthese eines synaptischen Tags veranlassen. Die gleichzeitige starke Stimulation eines separaten Stoffwechselwegs, der in der Lage ist, die Proteinsynthese des Zellkörpers zu induzieren, kann dann die Produktion von plastizitätsbezogenen Proteinen anregen, die zellweit transportiert werden. Da beide Synapsen den synaptischen Tag exprimieren, würden beide die Proteinprodukte einfangen, was zur Expression von LTP sowohl im stark stimulierten als auch im schwach stimulierten Weg führt.
Kooperativität wird beobachtet, wenn zwei Synapsen durch schwache Reize aktiviert werden, die bei individueller Stimulation nicht in der Lage sind, LTP zu induzieren. Aber bei gleichzeitiger schwacher Stimulation durchlaufen beide Synapsen LTP in kooperativer Weise. Das synaptische Tagging erklärt nicht, wie mehrere schwache Stimuli zu einem kollektiven Stimulus führen können, der ausreicht, um LTP zu induzieren (dies wird durch die zuvor beschriebene postsynaptische Summation von EPSPs erklärt). Vielmehr erklärt die synaptische Markierung die Fähigkeit schwach stimulierter Synapsen, von denen keine in der Lage ist, unabhängig LTP zu erzeugen, die Produkte der kollektiv initiierten Proteinsynthese zu empfangen. Wie zuvor kann dies durch die Synthese eines lokalen synaptischen Tags nach schwacher synaptischer Stimulation erreicht werden.
Modulation
| Modulator | Ziel |
|---|---|
| β-adrenerger Rezeptor | cAMP, MAPK-Amplifikation |
| Stickoxid-Synthase | Guanylylcyclase, PKG, NMDAR |
| Dopamin-Rezeptor | cAMP, MAPK-Amplifikation |
| Metabotroper Glutamatrezeptor | PKC-, MAPK-Verstärkung |
Wie zuvor beschrieben, können die der LTP zugrunde liegenden Moleküle als Mediatoren oder Modulatoren klassifiziert werden. Ein Mediator von LTP ist ein Molekül, wie der NMDA-Rezeptor oder Calcium, dessen Anwesenheit und Aktivität für die Erzeugung von LTP unter fast allen Bedingungen notwendig ist. Im Gegensatz dazu ist ein Modulator ein Molekül, das LTP verändern kann, aber für seine Erzeugung oder Expression nicht essentiell ist.
Zusätzlich zu den oben beschriebenen Signalwegen kann die hippocampale LTP durch eine Vielzahl von Modulatoren verändert werden. Zum Beispiel kann das Steroidhormon Östradiol die LTP steigern, indem es die CREB-Phosphorylierung und das nachfolgende Wachstum der dendritischen Wirbelsäule vorantreibt. Darüber hinaus können β-adrenerge Rezeptoragonisten wie Noradrenalin die von der Proteinsynthese abhängige Spätphase von LTP verändern. Die Aktivität der Stickstoffmonoxid-Synthase kann auch zur nachfolgenden Aktivierung von Guanyylcyclase und PKG führen. In ähnlicher Weise kann die Aktivierung von Dopaminrezeptoren LTP über den cAMP/PKA-Signalweg verstärken.
Beziehung zum Verhaltensgedächtnis
Während die langfristige Potenzierung von Synapsen in Zellkulturen ein elegantes Substrat für Lernen und Gedächtnis zu sein scheint, lässt sich der Beitrag von LTP zum Verhaltenslernen – also zum Lernen auf der Ebene des gesamten Organismus – nicht einfach aus In-vitro- Studien extrapolieren . Aus diesem Grund wurden erhebliche Anstrengungen unternommen, um festzustellen, ob LTP eine Voraussetzung für das Lernen und das Gedächtnis bei lebenden Tieren ist. Aus diesem Grund spielt LTP auch eine entscheidende Rolle bei der Angstverarbeitung .
Räumliches Gedächtnis

1986 lieferte Richard Morris einige der ersten Beweise dafür, dass LTP tatsächlich für die Bildung von Erinnerungen in vivo erforderlich war . Er testete das räumliche Gedächtnis von Ratten, indem er ihren Hippocampus pharmakologisch veränderte, eine Gehirnstruktur, deren Rolle beim räumlichen Lernen gut bekannt ist. Ratten wurden im Morris-Wasserlabyrinth trainiert , einer räumlichen Gedächtnisaufgabe, bei der Ratten in einem Teich mit trübem Wasser schwimmen, bis sie die unter der Oberfläche verborgene Plattform finden. Während dieser Übung wird von normalen Ratten erwartet, dass sie die Position der versteckten Plattform mit markanten Hinweisen in Verbindung bringen, die an bestimmten Positionen um den Umfang des Labyrinths herum platziert sind. Nach dem Training wurden die Hippocampi einer Rattengruppe in dem NMDA-Rezeptorblocker APV gebadet , während die andere Gruppe als Kontrolle diente . Beide Gruppen wurden dann der Aufgabe des räumlichen Gedächtnisses im Wasserlabyrinth unterzogen. Ratten in der Kontrollgruppe waren in der Lage, die Plattform zu lokalisieren und aus dem Pool zu entkommen, während die Leistung von APV-behandelten Ratten signifikant beeinträchtigt war. Wenn außerdem Schnitte des Hippocampus aus beiden Gruppen entnommen wurden, wurde LTP in Kontrollen leicht induziert, konnte jedoch nicht in den Gehirnen von APV-behandelten Ratten induziert werden. Dies lieferte einen frühen Beweis dafür, dass der NMDA-Rezeptor – und damit auch LTP – für zumindest einige Arten von Lernen und Gedächtnis erforderlich war.
In ähnlicher Weise demonstrierte Susumu Tonegawa 1996, dass der CA1-Bereich des Hippocampus entscheidend für die Bildung räumlicher Erinnerungen bei lebenden Mäusen ist. In dieser Region befindliche sogenannte Ortszellen werden nur dann aktiv, wenn sich die Ratte an einem bestimmten Ort – einem sogenannten Ortsfeld – in der Umgebung befindet. Da diese Ortsfelder über die Umgebung verteilt sind, besteht eine Interpretation darin, dass Gruppen von Ortszellen Karten im Hippocampus bilden. Die Genauigkeit dieser Karten bestimmt, wie gut eine Ratte über ihre Umgebung lernt und damit wie gut sie darin navigieren kann. Tonegawa fand heraus, dass durch die Beeinträchtigung des NMDA-Rezeptors, insbesondere durch die genetische Entfernung der NR1-Untereinheit in der CA1-Region, die erzeugten Ortsfelder wesentlich weniger spezifisch waren als die der Kontrollen. Das heißt, Mäuse produzierten fehlerhafte räumliche Karten, wenn ihre NMDA-Rezeptoren beeinträchtigt waren. Wie erwartet schnitten diese Mäuse bei räumlichen Aufgaben im Vergleich zu Kontrollen sehr schlecht ab, was die Rolle von LTP beim räumlichen Lernen weiter unterstützt.
Es wurde auch gezeigt, dass eine erhöhte NMDA-Rezeptoraktivität im Hippocampus eine verbesserte LTP und eine allgemeine Verbesserung des räumlichen Lernens bewirkt. 1999 haben Tang et al . produzierten eine Linie von Mäusen mit verbesserter NMDA-Rezeptorfunktion durch Überexpression der NR2B- Untereinheit im Hippocampus. Die daraus resultierenden intelligenten Mäuse, die nach dem fiktiven erstaunlichen Arzt Doogie Howser den Spitznamen "Doogie-Mäuse" erhielten , hatten eine größere LTP und zeichneten sich bei räumlichen Lernaufgaben aus, was die Bedeutung von LTP bei der Bildung von Hippocampus-abhängigen Erinnerungen bekräftigte.
Hemmende Vermeidung
Im Jahr 2006 berichteten Jonathan Whitlock und Kollegen über eine Reihe von Experimenten, die den vielleicht stärksten Beweis für die Rolle von LTP im Verhaltensgedächtnis lieferten, und argumentierten, dass die beiden Prozesse sich gegenseitig nachahmen und verdecken müssen, um zu dem Schluss zu kommen, dass LTP dem Verhaltenslernen zugrunde liegt. Unter Verwendung eines hemmenden Vermeidungslernparadigmas trainierten die Forscher Ratten in einem Zweikammergerät mit hellen und dunklen Kammern, wobei letztere mit einer Vorrichtung ausgestattet waren, die der Ratte beim Eintritt einen Fußschock auslöste. Eine Analyse von CA1-Hippocampus-Synapsen zeigte, dass inhibitorisches Vermeidungstraining in vivo eine AMPA-Rezeptor-Phosphorylierung desselben Typs induzierte , die in vitro bei LTP beobachtet wurde ; das heißt, hemmendes Vermeidungstraining imitierte LTP. Außerdem könnten während des Trainings potenzierte Synapsen durch experimentelle Manipulationen, die andernfalls LTP induziert hätten, nicht weiter potenziert werden; das heißt, hemmendes Vermeidungstraining okkludierte LTP. In einer Antwort auf den Artikel bemerkten Timothy Bliss und Kollegen, dass diese und verwandte Experimente „die Argumente für LTP als neuronalen Mechanismus für das Gedächtnis wesentlich voranbringen“.
Klinische Bedeutung
Die Rolle der LTP bei Erkrankungen ist weniger klar als ihre Rolle bei den grundlegenden Mechanismen der synaptischen Plastizität . Veränderungen der LTP können jedoch zu einer Reihe von neurologischen Erkrankungen beitragen , darunter Depressionen , Parkinson , Epilepsie und neuropathische Schmerzen . Eine beeinträchtigte LTP kann auch eine Rolle bei der Alzheimer-Krankheit und der Drogensucht spielen .
Alzheimer-Krankheit

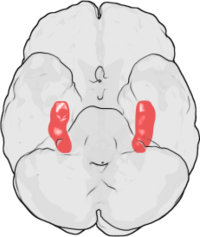
LTP hat bei denen, die die Alzheimer-Krankheit (AD) untersuchen, viel Aufmerksamkeit auf sich gezogen , eine neurodegenerative Erkrankung , die einen ausgeprägten kognitiven Rückgang und Demenz verursacht . Ein Großteil dieser Verschlechterung tritt in Verbindung mit degenerativen Veränderungen im Hippocampus und anderen medialen Temporallappenstrukturen auf. Aufgrund der gut etablierten Rolle des Hippocampus bei der LTP haben einige vorgeschlagen, dass der bei Personen mit AD beobachtete kognitive Rückgang auf eine beeinträchtigte LTP zurückzuführen sein könnte.
In einer Literaturrecherche aus dem Jahr 2003 haben Rowan et al. schlugen ein Modell vor, wie LTP bei AD beeinflusst werden könnte. AD scheint zumindest teilweise aus einer Fehlverarbeitung des Amyloid-Vorläuferproteins (APP) zu resultieren . Das Ergebnis dieser abnormalen Verarbeitung ist die Ansammlung von Fragmenten dieses Proteins, das als Amyloid β (Aβ) bezeichnet wird. Aβ existiert sowohl in löslicher als auch in fibrillärer Form. Die Fehlverarbeitung von APP führt zur Akkumulation von löslichem Aβ, das nach Rowans Hypothese die hippocampale LTP beeinträchtigt und zu einem kognitiven Verfall führen kann, der früh bei AD beobachtet wird.
AD kann auch LTP durch Mechanismen beeinträchtigen, die sich von Aβ unterscheiden. Eine Studie zeigte beispielsweise, dass sich das Enzym PKMζ in neurofibrillären Knäueln anhäuft , die ein pathologischer Marker für AD sind. PKMζ ist ein Enzym mit entscheidender Bedeutung für die Aufrechterhaltung der späten LTP .
Drogenabhängigkeit
Auch die Forschung im Bereich der Suchtmedizin hat sich in letzter Zeit auf LTP konzentriert, da die Hypothese, dass Drogensucht eine leistungsfähige Form des Lernens und Gedächtnisses darstellt, ist. Sucht ist ein komplexes neurologisches Verhaltensphänomen, an dem verschiedene Teile des Gehirns beteiligt sind, wie z. B. das ventrale Tegmentum (VTA) und der Nucleus accumbens (NAc). Studien haben gezeigt, dass VTA- und NAc-Synapsen in der Lage sind, eine LTP zu durchlaufen und dass diese LTP für die Verhaltensweisen verantwortlich sein kann, die die Sucht charakterisieren.
Siehe auch
- Neuroplastizität
- Aktinumbau von Neuronen
- Transkranielle Gleichstromstimulation
- Posttetanische Potenzierung
Verweise
Weiterlesen
- Bliss T, Collingridge G, Morris R (2004). Langfristige Potenzierung: Verbesserung der Neurowissenschaften für 30 Jahre . Oxford: Oxford University Press. ISBN 978-0-19-853030-5.
Externe Links
- Forscher liefern erste Beweise für Lernmechanismen , einen Bericht von PhysOrg.com über eine Studie von Bear und Kollegen aus dem Jahr 2006.
- Kurze Videodokumentation über die Doogie-Mäuse. ( RealPlayer- Format)
- "Smart Mouse", eine Quantum ABC-TV-Episode über die Doogie-Mäuse.
- Langzeit+Potenzierung an der US National Library of Medicine Medical Subject Headings (MeSH)