Niedrigvalente Magnesiumverbindungen - Low valent magnesium compounds
Eine Anzahl stabiler niedrigvalenter Magnesiumverbindungen, die eine Metall-Metall-Mg-Mg-Bindung enthalten, wobei Magnesium die formale Oxidationsstufe von +1 aufweist, sind bekannt. Diese Verbindungen haben im Allgemeinen die Formel L 2 Mg 2 , wobei L einen sperrigen Liganden darstellt. Die ersten Beispiele für diese stabilen Magnesium (I) -Verbindungen wurden 2007 beschrieben. Die Chemie von Mg wird von der Oxidationsstufe +2 dominiert und vor 2007 nur Beispiele für kristalline Verbindungen mit kurzen Mg-Mg-Abständen, die auf ein Mg-Mg hinweisen können Es waren Bindungen bekannt, wie die ternären Metallhydride Mg 2 RuH 4 , Mg 3 RuH 3 und Mg 4 IrH 5 und Magnesiumdiborid . Berechnungen hatten auch die Stabilität des Mg 2 2+ -Kations angezeigt .
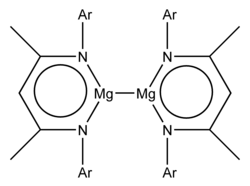
Die Herstellung der ersten hergestellten Verbindungen umfasste die Reduktion von Mg II- Iodkomplexen mit Kaliummetall und die sperrigen Liganden waren:
- ein Guanidinat, "Priso", [(Ar) NC (NPr i 2 ) N (Ar)] - wobei Ar = 2,6-Diisopropylphenyl und Pr i = Isopropyl
- ein Ketiminat, " nacnac ", {[(Ar) NC (Me)] 2 CH} - , - wobei Ar = 2,6-Diisopropylphenyl und Me = Methyl
Beide Beispiele haben die Formel L 2 Mg 2 , wobei L den sperrigen anionischen zweizähnigen Liganden darstellt. Röntgenkristallographische Untersuchungen zeigten eine Mg-Mg-Bindungslänge von 285,1 pm und 284,6 pm. Theoretische Studien weisen auf eine im Wesentlichen ionische Formulierung Mg 2 2+ (L - ) 2 hin . Das Mg 2 2+ -Ion ist das Gruppe 2- Analogon der Gruppe 12 Hg 2 2+ (vorhanden in z. B. Quecksilber (I) -chlorid ) und Cd 2 2+ -Ionen (vorhanden in Cadmium (I) -tetrachloraluminat ).
Seitdem wurde eine Vielzahl stabiler Mg (I) -Verbindungen hergestellt, von denen einige über 200 ° C schmelzen, einige farblos, andere gefärbt sind, aber alle sehr sperrige Liganden enthalten. Es wurden auch Komplexe des LMgMgL mit einzähnigen Liganden hergestellt, in denen die Koordination des Mg-Atoms von drei auf vier zunimmt. Die Magnesium (I) -Dimere haben sich als nützliche Reduktionsmittel erwiesen, beispielsweise bei der Herstellung von Zinn (I) -Verbindungen.