Lymphangioleiomyomatose - Lymphangioleiomyomatosis
| Lymphangioleiomyomatose (LAM) | |
|---|---|
| Andere Namen | Lymphangiomyomatose, LAM |
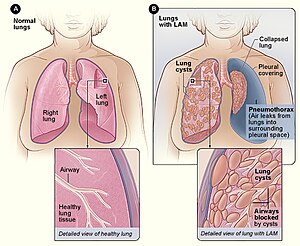 | |
| Abbildung A zeigt die Lage der Lunge und der Atemwege im Körper. Das Nebenbild zeigt einen Querschnitt einer gesunden Lunge. Abbildung B zeigt eine Ansicht der Lunge mit LAM und einer kollabierten Lunge ( Pneumothorax ). Das Nebenbild zeigt einen Querschnitt einer Lunge mit LAM. | |
| Spezialität |
Pneumologie |
Lymphangioleiomyomatose ( LAM ) ist eine seltene, fortschreitende und systemische Erkrankung, die typischerweise zu einer zystischen Lungenzerstörung führt . Betroffen sind überwiegend Frauen, insbesondere im gebärfähigen Alter. Der Begriff sporadisches LAM wird für Patienten mit LAM verwendet, die nicht mit dem Tuberösen Sklerose-Komplex (TSC) assoziiert sind , während sich TSC-LAM auf LAM bezieht, die mit TSC assoziiert ist.
Anzeichen und Symptome
Das durchschnittliche Erkrankungsalter liegt bei Anfang bis Mitte 30. Belastungsdyspnoe (Atemnot) und Spontanpneumothorax (Lungenkollaps) wurden bei 49 % bzw. 46 % der Patienten als erstes Krankheitsbild berichtet.
Die Diagnose wird in der Regel 5 bis 6 Jahre verzögert. Der Zustand wird oft als Asthma oder chronisch obstruktive Lungenerkrankung fehldiagnostiziert . Der erste Pneumothorax oder Lungenkollaps geht bei 82 % der Patienten der Diagnose einer LAM voraus. Die klinische Konsensusdefinition von LAM umfasst mehrere Symptome:
- Ermüdung
- Husten
- Bluthusten (selten massiv)
- Brustschmerzen
- Chylöse Komplikationen aufgrund einer Lymphobstruktion, einschließlich
- Chylothorax
- Chylöser Aszites
- Chyloperikard
- Chyloptyse
- Chylurie
- Chyle im Scheidenausfluss
- Chylus im Stuhl.
- Angiomyolipome ( Fettnierentumoren ) sind bei etwa 30 % der Patienten mit sporadischer LAM und bis zu 90 % der Patienten mit TSC-LAM vorhanden. Angiomyolipome können manchmal spontan bluten und Schmerzen oder niedrigen Blutdruck verursachen .
- Im Retroperitoneum, Becken oder Mediastinum können zystische Lymphangiome oder Lymphknoten mit hypodensen Zentren auftreten, die nekrotisierende Lymphome, Eierstock- oder Nierenkrebs oder andere Malignome nachahmen.
Die Lungenzerstörung bei LAM ist eine Folge einer diffusen Infiltration durch neoplastische glatte muskelähnliche Zellen, die alle Lungenstrukturen, einschließlich Lymphgefäße , Atemwegswände, Blutgefäße und interstitielle Räume, befallen . Die Folgen einer Gefäß- und Atemwegsobstruktion sind chylöse Flüssigkeitsansammlungen, Hämoptyse , Atemwegsobstruktion und Pneumothorax . Die typische Krankheitsverlauf zeigt progressive Dyspnoe bei Anstrengung, im Abstand von rezidivierenden Pneumothorax und bei einigen Patienten, chylous Pleuraleffusionen oder Aszites.
Die meisten Menschen haben 10 Jahre nach Einsetzen der Symptome eine Dyspnoe bei Belastung bei täglichen Aktivitäten. Viele Patienten benötigen während dieses Intervalls zusätzlichen Sauerstoff.
Genetik
LAM tritt in zwei Situationen auf: beim Tuberösen Sklerose-Komplex (TSC-LAM) und in sporadischer Form bei Frauen, die kein TSC haben (sporadische LAM). In beiden Fällen deuten genetische Beweise darauf hin, dass LAM durch inaktivierende oder „Funktionsverlust“-Mutationen in den TSC1- oder TSC2-Genen verursacht wird, die 1997 bzw. 1993 kloniert wurden. Das TSC1-Gen befindet sich auf dem langen Arm von Chromosom 9 (9q34) und das TSC2-Gen befindet sich auf dem kurzen Arm von Chromosom 16 (16p13). TSC-LAM tritt bei Frauen auf, die Keimbahnmutationen im TSC1- oder TSC2-Gen aufweisen.
Sporadisches LAM wird hauptsächlich mit somatischen TSC2-Genmutationen in Verbindung gebracht. Keimbahn- und somatische Mutationen bei LAM umfassen viele Arten von Mutationen, die über die Gene verteilt sind, ohne klare „Hot Spots“, einschließlich Missense-Veränderungen, Deletionen im Frame und Nonsense-Mutationen. Aufgrund der Größe der Gene (zusammen haben sie mehr als 60 Exons) und weil Mutationen praktisch überall innerhalb der Gene lokalisiert werden können, ist der Mutationsnachweis oft eine Herausforderung.
Auf zellulärer Basis tragen LAM-Zellen eine bi-allelische Inaktivierung der TSC2-Gene, im Einklang mit dem „Two-Hit“-Tumorsuppressorgen-Modell. Das zweite Trefferereignis in LAM-Zellen ist oft der Verlust der chromosomalen Region, die die Wildtyp-Kopie des TSC2-Gens enthält; dies wird als Verlust der Heterozygotie oder LOH bezeichnet. LOH kann in mikrodissezierten LAM-Zellen, in Angiomyolipomen und Lymphknoten von Frauen mit LAM sowie in zirkulierenden LAM-Zellen (Zellen in Blut und Urin) nachgewiesen werden.
Angiomyolipome und pulmonale LAM-Zellen von Frauen mit der sporadischen Form von LAM tragen identische Mutationen in TSC2. Dies, zusammen mit der Tatsache, dass rezidivierende LAM nach Lungentransplantation die gleichen TSC2-Mutationen trägt wie die ursprüngliche LAM, hat zu der Hypothese der "benignen Metastasierung" geführt, dass LAM-Zellen von einem Ort zum anderen wandern oder metastasieren können.
Pathophysiologie
Ein variabler Prozentsatz der Zellen innerhalb der LAM-Läsion enthält eine Mutationsinaktivierung der Tumorsuppressorgene des Tuberösen Sklerose-Komplexes (TSC1 oder TSC2). TSC1-Mutationen verursachen einen weniger schweren klinischen Phänotyp als TSC2-Mutationen. Die Entdeckung der TSC1/2-Genfunktion als negativer Regulator des Säugetier-Targets von Rapamycin- Komplex 1 (mTORC1) führte zum erfolgreichen Einsatz des Rapamycin-Analogons Sirolimus in klinischen Studien und der FDA-Zulassung von Sirolimus zur Behandlung von LAM.
TSC1 und TSC2 bilden einen Tumorsuppressorkomplex, der das Ziel des Rapamycin (mTOR)-Signalkomplexes bei Säugetieren reguliert, indem er die Aktivität der kleinen GTPase Rheb über die GTPase-aktivierende Proteindomäne (GAP) von TSC2 direkt steuert . Rheb bindet an Raptor und kontrolliert die Aktivität des mTOR-Komplexes 1 (mTORC1), der p70 S6- Kinase (S6K1) und 4E-BP1 direkt phosphoryliert . mTOR bildet zwei physikalisch und funktionell unterschiedliche Multiproteinkomplexe: das Rapamycin-sensitive mTORC1 und das Rapamycin-insensitive mTORC2. MTORC1 besteht aus fünf Proteinen, darunter Raptor, die die mTOR-Aktivität positiv regulieren. MTORC2 besteht aus sechs Proteinen, darunter mTOR und Rictor , die das Aktivierungsniveau von mTORC2 definieren und den Zusammenbau des Aktin- Zytoskeletts durch Rho-GTPasen modulieren , und Rac1 wird für die mTOR-Aktivierung benötigt. In TSC2-Null- und menschlichen LAM-Zellen ist die Rho-GTPase-Aktivität für die Zelladhäsion, Motilität, Proliferation und das Überleben erforderlich. Der Verlust von TSC1/TSC2 in LAM induziert ein unkontrolliertes LAM-Zellwachstum und erhöht die Lebensfähigkeit der LAM-Zellen. Hochregulation von STAT1 und STAT3 und Autophagie sind bekannte Mediatoren der Lebensfähigkeit und des Überlebens von LAM-Zellen.
LAM-Zellen verhalten sich in vielerlei Hinsicht wie metastatische Tumorzellen. LAM-Zellen scheinen aus einer extrapulmonalen Quelle zu stammen und wandern in die Lunge. Erhöhte Migration und Invasivität von LAM-Zellen wird durch TSC2-Reexpression gerettet. Die zellulären und molekularen Mechanismen der neoplastischen Transformation und der Zerstörung des Lungenparenchyms durch LAM-Zellen sind noch unbekannt. Der Lungenumbau kann durch ein Ungleichgewicht zwischen matrixabbauenden Metalloproteinasen (MMPs) und ihren endogenen Inhibitoren TIMPs vermittelt werden. Der invasive Zellphänotyp bei LAM ist mit der TIMP-3-Herunterregulation und der TSC2-abhängigen Hochregulation von MMPs verbunden.
Klinische und histopathologische Beweise belegen die lymphatische Beteiligung bei LAM. Die vorherrschende Hypothese ist, dass LAM-Läsionen den lymphangiogenen Faktor VEGF- D sezernieren , lymphatische Endothelzellen (LECs) rekrutieren, die Lymphgefäße bilden und Lungenzysten induzieren. Die VEGF-D-Serumspiegel sind bei LAM im Vergleich zu anderen zystischen Lungenerkrankungen erhöht, einschließlich pulmonaler Langerhans-Zell-Histiozytose , Emphysem, Sjögren-Syndrom oder Birt-Hogg-Dubé-Syndrom . Die VEGF-D-Spiegel korrelieren mit der Schwere der LAM, die als Maß für den CT-Grad (Häufigkeit von chylösen Ergüssen und lymphatischer Beteiligung) bewertet wird. VEGF-D ist ein sezerniertes homodimeres Glykoprotein und ein Mitglied der VEGF-Familie von Wachstumsfaktoren, das für seine Rolle bei der Lymphangiogenese und Metastasierung von Krebs bekannt ist . Die proteolytische Verarbeitung von VEGF-D beeinflusst die verwandte Bindung an VEGFR3. Histopathologisch sind LAM-Läsionen von Zellen umgeben, die auf VEGFR 3, den endothelialen Hyaluronanrezeptor 1 (LYVE-1) und Podoplanin der Lymphgefäße färben . VEGF-D bindet beim Menschen an die Rezeptorprotein-Tyrosinkinasen VEGFR-2 und VEGFR-349 und bei Mäusen an VEGFR3. Überraschenderweise hat der Knock-out von VEGF-D bei Mäusen nur geringe Auswirkungen auf die Entwicklung des Lymphsystems. Dennoch fördert VEGF-D während der Tumorentstehung die Bildung von Tumorlymphgefäßen und erleichtert die metastatische Ausbreitung von Krebszellen. Es ist jedoch wenig über die Rolle von abnormalen Lymphgefäßen und VEGF-D bei der LAM- Pathogenese bekannt .
Diagnose
LAM kann auf verschiedene Weise medizinisch versorgt werden, von denen die meisten eine Thorax-CT auslösen. Dünnwandige zystische Veränderungen in der Lunge können zufällig bei CT-Scans des Herzens, des Brustkorbs oder des Abdomens (an den Schnitten, die Lungenbasen enthalten) zu anderen Zwecken gefunden werden. HRCTs von TSC-Patienten zeigen, dass bei etwa 20 % der Frauen im Alter von 20 Jahren und bei etwa 80 % der Frauen nach dem 40 häufig wird eine CT-Untersuchung (in den Vereinigten Staaten) nicht angeordnet, bis Rezidive auftreten. Eine fortschreitende Belastungsdyspnoe ohne die für Asthma oder COPD charakteristischen Exazerbationen und Remissionen führt manchmal zu einer Thorax-CT. Eine Überprüfung des CT durch einen mit LAM vertrauten Experten kann die diagnostische Genauigkeit erhöhen. Chylothorax kann auch auf LAM aufmerksam machen.
In einigen Fällen kann eine LAM-Diagnose aus klinischen Gründen (ohne Biopsie ) bei Patienten mit typischen zystischen Veränderungen im hochauflösenden CT der Lunge und Befunden von tuberöser Sklerose, Angiomyoliomyom , Lymphangioleiomyom, Chylothorax oder Serum-VEGF-D sicher gestellt werden > 800 pg/ml.
Wenn keines dieser klinischen Merkmale vorhanden ist, kann eine Biopsie erforderlich sein, um die Diagnose zu stellen. Die videoassistierte thorakoskopische Lungenbiopsie ist die definitivste Technik, aber die transbronchiale Biopsie hat eine Ausbeute von über 50 % und kann ebenfalls effektiv sein. Die Sicherheit des letzteren Verfahrens bei Patienten mit diffuser zystischer Erkrankung und die Fülle von zystischen Veränderungen, die eine informative Biopsie vorhersagen, sind jedoch unvollständig verstanden. Die Zytologie von Chylusflüssigkeiten, aspirierten Bauchknoten oder lymphatischen Raumforderungen kann ebenfalls diagnostisch sein.
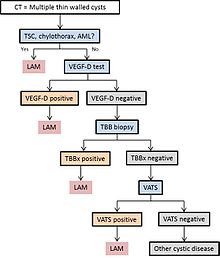
Diagramm 1 skizziert einen vorgeschlagenen Algorithmus für die Diagnose von LAM.
Röntgenaufnahme der Brust
Die Röntgenaufnahme des Thorax kann relativ normal erscheinen, selbst im späten Krankheitsverlauf, oder kann nur auf eine Hyperinflation hinweisen. Wenn die Krankheit fortschreitet, zeigt die Röntgenaufnahme des Thorax oft diffuse, bilaterale und symmetrische retikulonoduläre Trübungen, Zysten, Blasen oder ein "wabenförmiges" (dh pseudofibrotisches) Erscheinungsbild. Pleuraerguss und Pneumothorax können auftreten. Die Erhaltung des Lungenvolumens bei erhöhten interstitiellen Markierungen ist ein radiologisches Kennzeichen von LAM, das es von den meisten anderen interstitiellen Lungenerkrankungen unterscheidet, bei denen Alveolarseptum und interstitielle Expansion dazu neigen, die elastischen Rückstoßeigenschaften der Lunge zu erhöhen und das Lungenvolumen zu verringern.
Computertomographie
Die hochauflösende Computertomographie (HRCT) des Thorax ist besser als das Thoraxröntgen, um zystische Parenchymerkrankungen zu erkennen und ist zum Zeitpunkt der Diagnose fast immer auffällig, selbst wenn das Thoraxröntgenbild und die Beurteilung der Lungenfunktion normal sind. Das typische CT zeigt diffuse runde, beidseitige, dünnwandige Zysten unterschiedlicher Größe von 1 bis 45 mm Durchmesser. Die Anzahl der Zysten variiert bei LAM von wenigen bis zum fast vollständigen Ersatz von normalem Lungengewebe. Die Zystenhäufigkeit ist bei Patienten mit TSC-LAM tendenziell milder als bei S-LAM, was zum Teil möglicherweise dadurch erklärt wird, dass TSC-LAM-Patienten typischerweise früher gescreent werden. Pleuraergüsse werden im CT bei 12 % der Patienten mit S-LAM und 6 % der Patienten mit TSC-LAM beobachtet. Andere CT-Merkmale umfassen lineare Dichten (29 %), hiläre oder mediastinale Lymphadenopathie (9 %), Pneumothorax, Lymphangiomyom und Dilatation des Ductus thoracicus. Mattglastrübungen (12 %) weisen auf das Vorliegen eines interstitiellen Ödems aufgrund einer Lymphstauung hin. Bei Patienten mit TSC kann noduläre Dichten auf HRCT repräsentieren multifokale micronodular Pneumozyten - Hyperplasie (MMPH) von Clustern von hyperplastischen Typ II - Pneumozyten besteht. MMPH kann bei Männern oder Frauen mit TSC in Gegenwart oder Abwesenheit von LAM vorhanden sein, jedoch nicht bei Patienten mit S-LAM. MMPH ist normalerweise nicht mit physiologischen oder prognostischen Konsequenzen verbunden, aber es wurde ein Fall von respiratorischem Versagen aufgrund von MMPH berichtet.
Beatmungs-Perfusions-Scans
In einer Studie waren die Beatmungs-Perfusions-Scans bei 34 von 35 LAM-Patienten abnormal. Die häufigste Anomalie war eine unspezifische diffuse Heterogenität , die normalerweise stark übereinstimmt. Diese Autoren beschrieben auch ein „ungewöhnliches“, „Sprenkelmuster“ auf den Perfusionsbildern bei 74 % der Patienten, bestehend aus „kleinen, oft peripheren Ansammlungen von Radioisotopen“.
Positronen-Emissions-Tomographie
LAM- und AML-Läsionen zeigen bei der Positronen-Emissions-Tomographie (PET) typischerweise keine erhöhte Aufnahme von 18F-Fluordeoxyglucose . Andere Neoplasien (oder Entzündungsquellen) sollten daher bei bekannten oder vermuteten LAM-Fällen mit positiven FDG-PET-Ergebnissen in Betracht gezogen werden.
Bildgebung des Abdomens
Anomalien in der abdominalen Bildgebung, wie renale AML und vergrößerte lymphatische Strukturen, sind auch bei LAM häufig. Die Fettdichte innerhalb einer Nierenmasse ist pathognomonisch für AMLs. AMLs treten bei Patienten mit TSC-LAM häufiger und häufiger bilateral und groß auf als bei Patienten mit S-LAM. Die AML-Größe korreliert mit der Prävalenz von Lungenzysten bei Patienten mit TSC. In einer CT-Studie wurden 256 Patienten mit S-LAM und 67 mit TSC-LAM abgebildet. Eine renale AML lag bei 32 % der Patienten mit S-LAM und 93 % der Patienten mit TSC-LAM vor. Leber-AML waren bei 2 % der Patienten mit S-LAM und 33 % der Patienten mit TSC-LAM vorhanden. Aszites trat gelegentlich auf und wurde bei weniger als 10 % der Patienten mit LAM beobachtet. Bei 29 % der Patienten mit S-LAM und 9 % der Patienten mit TSC-LAM wurde eine abdominale Lymphangiomatose beobachtet, die häufig sowohl zystische als auch solide Komponenten enthielt.
Bildgebung des zentralen Nervensystems
Anomalien des Zentralnervensystems, wie kortikale oder subependymale Knollen und Astrozytome , sind bei Patienten mit TSC, einschließlich derer mit TSC-LAM, häufig, jedoch nicht bei Frauen mit S-LAM. Moss und Mitarbeiter berichteten, dass Frauen mit S-LAM und TSC-LAM möglicherweise eine erhöhte Inzidenz von Meningeomen haben , aber die Bedeutung dieses Ergebnisses wurde in Frage gestellt.
Lungenfunktionsstudien
Lungenfunktionstests bei Patienten mit LAM können unauffällig sein oder obstruktive, restriktive oder gemischte Muster aufweisen. Die obstruktive Physiologie ist die häufigste Anomalie. Qualitätskontrollierte Lungenfunktionsdaten wurden prospektiv vom NHLBI-Register gesammelt, einer 5-Jahres-Studie an Patienten mit LAM in Zentren in den USA. Die Spirometrie zeigte bei etwa 57 % der Patienten obstruktive Veränderungen und bei 34 % normale Ergebnisse. Eine Einschränkung, definiert als eine Gesamtlungenkapazität unterhalb der unteren Normgrenze, wurde bei 11 % beobachtet. Bei etwa 6% lag eine Hyperinflation vor. Das durchschnittliche Restvolumen betrug 125% des vorhergesagten, wenn es durch Plethysmographie gemessen wurde, aber nur 103% des vorhergesagten, bestimmt mit Gasverdünnungsmethoden, was auf einen signifikanten Lufteinschluss in nicht kommunizierenden Lufträumen hindeutet. Ungefähr 25 % der Patienten mit obstruktiver Physiologie können eine bronchodilatatorische Ansprechbarkeit zeigen, aber bei schwererer Obstruktion möglicherweise weniger. Der obstruktive physiologische Defekt bei LAM ist hauptsächlich auf eine Obstruktion des Luftstroms zurückzuführen. Die früheste Änderung bei der anfänglichen Lungenfunktionsprüfung in verschiedenen Fallserien war ein anormaler Gastransfer, bewertet anhand der Diffusionskapazität für Kohlenmonoxid (DLCO), die bei 82 % bis 97 % der Patienten beschrieben wurde. Es ist nicht ungewöhnlich, dass DLCO in 1 Sekunde überproportional zum forcierten Exspirationsvolumen (FEV1) reduziert wird. Die Verringerung des DLCO und die Zunahme des Residualvolumens werden allgemein als die frühesten physiologischen Manifestationen der LAM angesehen.
Herz-Lungen-Belastungstests in einer viel größeren Kohorte von Patienten mit LAM ergaben bei 217 Patienten einen verringerten maximalen Sauerstoffverbrauch ( VO 2 max ) und eine reduzierte anaerobe Schwelle . Eine belastungsinduzierte Hypoxämie wurde sogar bei Patienten festgestellt, die keine Anomalien in FEV1 und DLCO im Ruhezustand aufwiesen. Bei den meisten Patienten wurde angenommen, dass körperliche Bewegung aufgrund der Behinderung des Luftstroms und der erhöhten Totraumventilation die Ventilation eingeschränkt ist.
Das Fortschreiten der Krankheit wird in der Regel von einem progressiven obstruktiven Atemdefekt begleitet. Der Rückgang des FEV1 ist der am häufigsten verwendete Parameter zur Überwachung des Krankheitsverlaufs. Obwohl eine pulmonale Ruhehypertonie bei LAM ungewöhnlich zu sein scheint, steigt der pulmonalarterielle Druck häufig bei geringer Belastung an, was teilweise auf eine Hypoxämie zurückzuführen ist. Eine Studie berichtete über eine Zunahme intraparenchymaler Shunts bei Patienten mit Dyspnoe mit LAM, die zu Ruhe- und Belastungshypoxämie beitragen können.
Pathologie
Im Großen und Ganzen sind die LAM-Lungen vergrößert und diffus zystisch, mit erweiterten Lufträumen von mehreren Zentimetern Durchmesser. Die mikroskopische Untersuchung der Lunge zeigt Herde glatter muskelartiger Zellinfiltration des Lungenparenchyms, der Atemwege, der Lymphgefäße und der Blutgefäße, die mit Bereichen dünnwandiger zystischer Veränderungen verbunden sind. LAM-Läsionen enthalten oft eine Fülle von Lymphkanälen, die ein anastomosierendes Geflecht aus schlitzartigen Räumen bilden, die von Endothelzellen ausgekleidet sind. LAM-Zellen dehnen im Allgemeinen interstitielle Räume aus, ohne Gewebeebenen zu verletzen, es wurde jedoch beobachtet, dass sie in die Atemwege, die Lungenarterie, das Zwerchfell, die Aorta und das retroperitoneale Fett eindringen , Bronchialknorpel und Arteriolenwände zerstören und das Lumen der Lungenarteriolen verschließen .
Es gibt zwei Hauptzellmorphologien in der LAM-Läsion: kleine spindelförmige Zellen und quaderförmige Epitheloidzellen. LAM-Zellen färben sich positiv auf Aktin- , Vimentin- , Desmin- und häufig Östrogen- und Progesteronrezeptoren der glatten Muskulatur . Die quaderförmigen Zellen in LAM-Läsionen reagieren auch mit einem monoklonalen Antikörper namens HMB-45, der gegen das prämelanosomale Protein gp100, ein Enzym im Melanogenese-Weg, entwickelt wurde. Dieser immunhistochemische Marker ist diagnostisch sehr nützlich, da andere Läsionen mit überwiegender glatter Muskulatur in der Lunge nicht mit dem Antikörper reagieren. Die spindelförmigen Zellen der LAM-Läsion sind häufiger proliferierender Zellkernantigen-positiv als die quaderförmigen Zellen, was mit einem proliferativen Phänotyp übereinstimmt. Im Vergleich zu zigarrenförmigen normalen glatten Muskelzellen enthalten spindelförmige LAM-Zellen weniger reichlich Zytoplasma und sind weniger eosinophil. Östrogen- und Progesteronrezeptoren sind auch in LAM-Läsionen vorhanden, jedoch nicht im angrenzenden normalen Lungengewebe. LAM-Läsionen exprimieren die lymphatischen Marker LYVE-1, PROX1, Podoplanin und VEGFR-3. Die glatten Muskel-ähnlichen Zellen von AMLs sind LAM-Zellen morphologisch und immunhistochemisch ähnlich, einschließlich der Reaktivität mit Antikörpern gegen Aktin, Desmin, Vimentin und HMB-45 sowie Östrogen- und Progesteronrezeptoren. Im Gegensatz zu den erweiterten Lufträumen bei Emphysemen können die zystischen Räume bei LAM teilweise mit hyperplastischen Typ-II-Zellen ausgekleidet sein.
Behandlung
Zur Stabilisierung des Lungenfunktionsabfalls steht ein von der FDA zugelassenes Medikament zur Behandlung von LAM, der mTOR- Inhibitor Sirolimus , zur Verfügung. Eine Lungentransplantation bleibt der letzte Ausweg für Patienten mit fortgeschrittener Erkrankung.
Pneumothorax
Pneumothoraces bei LAM-Patienten neigen zu Rezidiven, insbesondere nach konservativer Behandlung wie Beobachtung, Aspiration oder einfacher Tubus-Thorakostomie. Über 65 % der LAM-Patienten entwickeln im Verlauf ihrer Erkrankung einen Pneumothorax, durchschnittlich 3,5 Pneumothorax bei Patienten mit mindestens einem Pneumothorax. Die Pleural Consensus Group der LAM Foundation befürwortete die Anwendung eines Pleurasymphysenverfahrens beim ersten Pneumothorax, da die Wahrscheinlichkeit eines Rezidivs mehr als 70 % beträgt. Chemische Sklerose, mechanische Abrasion, Talkumpuderung und Pleurektomie waren bei Patienten mit LAM wirksam, aber mechanische Abrasion wird für diejenigen bevorzugt, die in Zukunft möglicherweise eine Lungentransplantation benötigen. Etwa die Hälfte der LAM-Patienten, die sich einer Transplantation unterzogen haben, hatte eine vorherige Pleurodese- Operation und mehr als 75 % von ihnen hatten eine vorherige bilaterale Pleurodese . Obwohl eine Pleurodese keine Kontraindikation für eine Transplantation darstellt, kann sie zu einer erhöhten perioperativen Blutung führen.
Chylothorax
Chyle verursacht im Allgemeinen keine Pleuraentzündung oder Fibrose. Kleine stabile chylöse Ergüsse erfordern selten eine Intervention, sobald die LAM-Diagnose gestellt ist. Kurzatmigkeit kann eine möglicherweise wiederholte Drainage erforderlich machen. Sirolimus ist bei chylösen Ergüssen wirksam und die meisten Experten glauben, dass es als erste Therapielinie verwendet werden sollte. Bei refraktären Ergüssen wird empfohlen, die Quelle des Lecks mit einer starken T2-gewichteten MRT oder einer kontrastierenden Lymphangiographie darzustellen. Einige Lecks sind zugänglich Embolisation durch Katheter aus Leiste Gewinde Lymphknoten in den Ductus . Eine Ligatur des Ductus thoracicus kann in Betracht gezogen werden, aber da Thoraxergüsse manchmal von Aszites stammen, der durch die Blasebalgwirkung des Thorax in den Brustkorb geleitet wird, ist es wichtig, eine abdominale Quelle auszuschließen, bevor diese Option in Betracht gezogen wird. Eine Pleurasymphyse kann erforderlich sein, um Ernährungs- und Lymphozytenmangel zu verhindern, die durch wiederholtes Klopfen oder anhaltende Drainage entstehen können. Chemische Pleurodese ist im Allgemeinen eine wirksame Therapie des Chylothorax, ebenso wie mechanischer Abrieb und Talkumpuder.
Angiomyolipom
Renale Angiomyolipome (AMLs) können zur Blutstillung eine Embolisation oder Kauterisation erfordern, eine Komplikation, von der angenommen wird, dass sie häufiger auftritt, wenn der Tumordurchmesser 4 cm überschreitet. Das Ausmaß der aneurysmatischen Veränderung kann das Blutungsrisiko bestimmen. Zur Beurteilung der AML-Größe sollte in Abständen von 6 bis 12 Monaten eine serielle Bildgebung des Abdomens durchgeführt werden, zumindest bis die Wachstumstrends klar sind. Bei sehr großen Tumoren können nephronsparende Teilresektionen in Erwägung gezogen werden. Eine Nephrektomie ist manchmal bei Tumoren mit intravaskulärer Ausdehnung oder aus anderen Gründen erforderlich, ist jedoch selten der Ansatz der Wahl bei AMLs, die mit weniger invasiven Mitteln behandelt werden können. Everolimus ist von der US-amerikanischen Food and Drug Administration (FDA) für die AML-Behandlung zugelassen.
Lymphangioleiomyom
Lymphangioleiomyomatosen sind flüssigkeitsgefüllte hypodense Strukturen in den retroperitonealen Regionen des Abdomens und des Beckens bei etwa 30% der LAM-Patienten. Sie bedürfen in der Regel keiner Intervention. Eine Biopsie oder Resektion kann zu einer längeren Leckage führen. mTOR-Inhibitoren sind wirksam bei der Verkleinerung der Lymphangioleiomyomatose und können zu einer vollständigen Auflösung führen.
Management-andere
Östrogenhaltige Medikamente können LAM verschlimmern und sind kontraindiziert. Wirkstoffe, die die Wirkung von Östrogen antagonisieren, haben sich nicht als wirksam für die Behandlung erwiesen, aber es wurden keine geeigneten Studien durchgeführt. Eine Studie mit Bronchodilatatoren sollte bei LAM-Patienten in Betracht gezogen werden, da bis zu 17 % bis 25 % eine auf Bronchodilatatoren ansprechende Atemwegsobstruktion haben. Sauerstoff sollte verabreicht werden, um eine Oxyhämoglobin- Sättigung von mehr als 90 % in Ruhe, Bewegung und Schlaf aufrechtzuerhalten . Bei allen Patienten, die immobilisiert sind und/oder eine Antiöstrogentherapie erhalten, sollte eine Knochendichtemessung in Betracht gezogen und bei osteoporotischen Patienten eine geeignete Therapie eingeleitet werden . Nach einer natürlichen oder induzierten Menopause sollte der kardiovaskulären Gesundheit die richtige Aufmerksamkeit geschenkt werden . Impfungen gegen Pneumokokken und Influenza sollten auf dem neuesten Stand gehalten werden. Eine pulmonale Rehabilitation scheint bei jungen, motivierten Patienten mit obstruktiver Lungenerkrankung besonders lohnend zu sein, aber Studien zur Bewertung der Wirkung dieser Intervention auf die Belastungstoleranz, Kondition und Lebensqualität wurden nicht durchgeführt.
Medikation
Sirolimus ist ein mTOR-Hemmer, der die Lungenfunktion stabilisiert und einige Lebensmaßstäbe bei LAM-Patienten verbessert. Es ist von der FDA für den Einsatz bei LAM zugelassen, basierend auf den Ergebnissen der Multicenter International LAM Efficacy and Safety of Sirolimus (MILES) Trial. MILES-Daten unterstützen die Anwendung von Sirolimus bei Patienten mit abnormaler Lungenfunktion (dh FEV1 <70% vorhergesagt). Ob der Nutzen der Behandlung die Risiken für asymptomatische LAM-Patienten mit normaler Lungenfunktion überwiegt, ist nicht klar, aber einige Ärzte ziehen eine Behandlung für rückläufige Patienten in Betracht, die sich dem abnormalen Bereich für FEV1 nähern. Sirolimus scheint auch bei der Behandlung von Chylusergüssen und Lymphangioleiomyomatose wirksam zu sein. Die Vorteile von Sirolimus bleiben nur während der Behandlung bestehen. Die Sicherheit einer Langzeittherapie wurde nicht untersucht.
Mögliche Nebenwirkungen von mTOR-Hemmern sind Schwellungen in den Knöcheln, Akne, Mundgeschwüre, Dyspepsie , Durchfall, Erhöhung von Cholesterin und Triglyceriden , Bluthochdruck und Kopfschmerzen. Sirolimus-Pneumonitis und latente Malignität sind ernstere Bedenken, treten jedoch selten auf. Sirolimus hemmt die Wundheilung. Es ist wichtig, die Therapie mit dem Medikament vor und nach elektiven Eingriffen, die eine optimale Wundheilung erfordern, für 1–2 Wochen zu unterbrechen. Aufgrund des erhöhten Hautkrebsrisikos müssen Vorsichtsmaßnahmen getroffen werden, um eine längere Sonnenexposition zu vermeiden .
In einer kleinen, offenen Studie wurde berichtet, dass die Behandlung mit einem anderen mTOR-Inhibitor, Everolimus , mit einer Verbesserung des FEV1 und einer 6-Minuten-Gehstrecke einhergeht. Die Serumspiegel von VEGF-D und Kollagen IV wurden durch die Behandlung reduziert. Die unerwünschten Ereignisse stimmten im Allgemeinen mit denen überein, von denen bekannt ist, dass sie mit mTOR-Inhibitoren in Zusammenhang stehen, obwohl einige schwerwiegend waren und periphere Ödeme , Lungenentzündung, Herzinsuffizienz und Pneumocystis-jirovecii- Infektion umfassten. Es wurden steigende Dosen von Everolimus verwendet, bis zu 10 mg pro Tag; höher als das, was normalerweise klinisch für LAM verwendet wird.
Die Serum-VEGF-D-Konzentration ist ein nützlicher, prädiktiver und prognostischer Biomarker. Höhere Ausgangswerte von VEGF-D sagen ein schnelleres Fortschreiten der Krankheit und ein robusteres Ansprechen auf die Behandlung voraus.
Hormonelle Behandlungsansätze wurden nie in geeigneten Studien getestet. In Ermangelung eines nachgewiesenen Nutzens wird eine Therapie mit Progesteron , GnRh-Agonisten (z. B. Leuprorelin , Goserelin ) und Tamoxifen nicht routinemäßig empfohlen. Doxycyclin hatte in einer Doppelblindstudie keinen Einfluss auf die Rate der Abnahme der Lungenfunktion.
Sirolimus ist oft als First-Line-Management für Chylothorax wirksam. Wenn die Chylusleckage oder -akkumulation trotz Behandlung fortbesteht, kann eine Bildgebung mit einer schweren T2-gewichteten MRT, einer MRT-Lymphangiographie oder einer Lymphangiographie des Ductus thoracicus in Betracht gezogen werden. Pleurafusionsverfahren können in refraktären Fällen erwogen werden.
Prognose
Die Überlebensschätzungen variieren je nach Darstellungs- oder Ermittlungsart und sind im Allgemeinen nach oben tendiert, wahrscheinlich aufgrund früherer Erkennung durch den verbreiteteren Einsatz von CT-Scans. In einer aktuellen bevölkerungsbezogenen Kohortenumfrage wurde eine mediane Überlebenszeit von 29 Jahren festgestellt. Daten aus früheren, großen Fallserien zeigten, dass 38 % bis 78 % der Patienten 8,5 Jahre nach Krankheitsbeginn noch am Leben waren.
Patienten entwickeln typischerweise eine progressive Luftstromobstruktion. In einer Kohorte von Patienten im Vereinigten Königreich gingen 10 Jahre nach Symptombeginn 55% von 77 Patienten atemlos auf ebenem Boden und 10% waren ans Haus gefesselt. Die durchschnittliche jährliche Abnahmerate von FEV1 und DLCO bei 275 Patienten, die in einem einzigen Lungenfunktionslabor des NHLBI untersucht wurden, betrug 75 ± 9 ml bzw. 0,69 ± 0,07 ml/min/mm Hg. In anderen Studien aus Europa war die Abnahmerate des FEV1 erheblich höher und wurde auf etwa 100 bis 120 ml/Jahr geschätzt. In der MILES-Studie verloren Patienten in der Placebo-Gruppe 134 ml/Jahr. In diesen Studien gab es einige Hinweise darauf, dass die Abnahmerate der Lungenfunktion mit dem anfänglichen DLCO, mit dem Menopausenstatus und einem hohen Ausgangswert von VEGF-D korreliert.
Die Schätzungen des medianen Überlebens schwanken zwischen 10 und 30 Jahren, je nachdem, ob krankenhaus- oder bevölkerungsbezogene Kohorten untersucht werden.
Epidemiologie
LAM ist fast vollständig auf Frauen beschränkt. Während bei einigen Männern mit tuberkulöser Sklerose Lungenzysten im Zusammenhang mit LAM gemeldet werden, entwickeln nur sehr wenige dieser Männer Symptome. Die Prävalenz der LAM wird anhand von Daten aus Registern und Patientengruppen geschätzt und liegt zwischen 3,4 und 7,8/Million Frauen. Die Zahl der neuen Fälle pro Jahr liegt in den USA, Großbritannien und der Schweiz zwischen 0,23 und 0,31/Million Frauen/Jahr. Die Unterschiede zwischen den Ländern und zwischen benachbarten Bundesstaaten in den USA legen nahe, dass eine signifikante Anzahl von Frauen mit LAM entweder nicht diagnostiziert wird oder ihre Symptome auf andere Krankheiten zurückgeführt werden. Erwachsene Frauen mit tuberöser Sklerose entwickeln häufiger LAM als Frauen ohne tuberöse Sklerose. Kohorten von Patienten mit tuberöser Sklerose wurden mittels CT-Scan auf LAM untersucht. In einer retrospektiven Studie an Erwachsenen mit tuberöser Sklerose zeigte die CT bei 42 % von 95 Frauen und 13 % von 91 Männern Lungenzysten. Im Allgemeinen waren Lungenzysten bei Frauen größer und zahlreicher als bei Männern. In einer weiteren retrospektiven Studie an Frauen mit TSC, die sich einem CT-Scan unterzogen, um LAM zu erkennen, hatten 25 % der 20-Jährigen Lungenzysten, während 80 % der Frauen in den 40ern davon betroffen waren, was darauf hindeutet, dass die Entwicklung von LAM zumindest in altersabhängig ist tuberöse Sklerose-assoziierte LAM. Obwohl die Prävalenz der tuberösen Sklerose bei 1 von 6000 Geburten viel höher ist als die der LAM, sehen die meisten Lungenkliniken mehr Fälle von sporadischer als von tuberkulöser Sklerose-LAM: wahrscheinlich aufgrund einer Kombination aus niedrigen Screening-Maßnahmen auf LAM bei tuberöser Sklerose und in viele, das Fehlen von Symptomen.
Weibliches Geschlecht und tuberöse Sklerose sind die einzigen bekannten Risikofaktoren. Obwohl die Einnahme von zusätzlichem Östrogen nicht mit der Entwicklung von LAM in Verbindung gebracht wird, deutet eine Studie darauf hin, dass die Einnahme von östrogenhaltigen Antibabypillen mit einem früheren Beginn verbunden ist.
Sie tritt bei mehr als 30 % der Frauen mit Tuberöse-Sklerose-Komplex (TSC-LAM) auf, einem erblichen Syndrom, das mit Krampfanfällen , kognitiven Beeinträchtigungen und gutartigen Tumoren in mehreren Geweben einhergeht. Die meisten LAM-Patienten, die sich zur medizinischen Untersuchung vorstellen, haben jedoch die sporadische Form der Krankheit (S-LAM), die nicht mit anderen Manifestationen des tuberösen Sklerose-Komplexes verbunden ist.
Leichte zystische Veränderungen im Einklang mit LAM wurden bei 10–15% der Männer mit TSC beschrieben, aber symptomatische LAM bei Männern ist selten. Sporadisches LAM tritt mit einer bisher veröffentlichten Ausnahme ausschließlich bei Frauen auf. Sowohl TSC-LAM als auch S-LAM sind mit Mutationen in den Genen der tuberösen Sklerose verbunden.
Schwangerschaft
Es wurde berichtet, dass eine Schwangerschaft LAM in einigen Fällen verschlimmert. Das Risiko wurde jedoch nicht gründlich untersucht. In einer Befragung von 318 Patientinnen, die angaben, mindestens eine Schwangerschaft gehabt zu haben, antworteten 163 auf eine zweite Befragung mit dem Schwerpunkt Lungenkollaps. Insgesamt 38 Patientinnen berichteten über einen Pneumothorax während der Schwangerschaft, was einer Inzidenz eines Pneumothorax in der Schwangerschaft von mindestens 10 % entspricht (38 von 318). Bei einem Drittel der Patientinnen führte der Pneumothorax während der Schwangerschaft zur LAM-Diagnose. Pneumothoraxe traten rechts fast doppelt so häufig auf wie links, und vier Frauen stellten sich mit beidseitigem Spontanpneumothorax vor. Die meisten Pneumothoraces fanden im zweiten und dritten Trimester statt. Diese und andere Studien legen nahe, dass eine Schwangerschaft bei LAM-Patienten mit Pleurakomplikationen verbunden ist. Nur wenige Frauen mit bekannter LAM-Diagnose entscheiden sich für eine Schwangerschaft, und bei Patientinnen, bei denen LAM während der Schwangerschaft diagnostiziert wird, stehen selten Lungenfunktionstests zur Verfügung, was die Klärung dieser Frage erschwert.
Die Gesellschaft
Die LAM Foundation wurde 1995 als Basisorganisation gegründet, um Patientenvertretung und Forschungsförderung bereitzustellen. Heute bietet die LAM Foundation Unterstützung und Bildung für Frauen mit LAM und ihre Familien, engagiert Ärzte und Wissenschaftler, um mehr über die Krankheit zu erfahren, und sammelt Mittel für die weitere Erforschung von LAM. Es sucht sichere und wirksame Behandlungen und letztendlich eine Heilung für Lymphangioleiomyomatose. Es hat seinen Hauptsitz in Cincinnati, Ohio.
In der Populärkultur
In " Lucky Thirteen ", der fünften Episode der fünften Staffel von House , wurde bei Spencer (Angela Gots) LAM diagnostiziert, später stellte sich jedoch heraus, dass es sich um ein Sjögren-Syndrom handelte .
Siehe auch
Verweise
Externe Links
| Einstufung | |
|---|---|
| Externe Ressourcen |