MAPK/ERK-Pfad - MAPK/ERK pathway

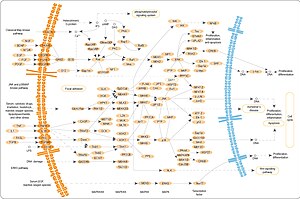
Der MAPK/ERK-Weg (auch bekannt als Ras-Raf-MEK-ERK-Weg ) ist eine Proteinkette in der Zelle , die ein Signal von einem Rezeptor auf der Zelloberfläche an die DNA im Zellkern übermittelt .
Das Signal beginnt, wenn ein Signalmolekül an den Rezeptor auf der Zelloberfläche bindet, und endet, wenn die DNA im Zellkern ein Protein exprimiert und eine gewisse Veränderung in der Zelle hervorruft, wie zum Beispiel die Zellteilung . Der Signalweg umfasst viele Proteine, darunter MAPK ( Mitogen-aktivierte Proteinkinasen , ursprünglich ERK genannt, extrazelluläre signalregulierte Kinasen ), die kommunizieren, indem sie Phosphatgruppen an ein benachbartes Protein anhängen (es phosphorylieren ), das als "An" oder " Ausschalter.
Wenn eines der Proteine im Signalweg mutiert ist, kann es in der "An"- oder "Aus"-Position stecken bleiben, was ein notwendiger Schritt bei der Entwicklung vieler Krebsarten ist. Komponenten des MAPK/ERK-Signalwegs wurden entdeckt, als sie in Krebszellen gefunden wurden. Medikamente, die den „Ein“- oder „Aus“-Schalter umkehren, werden als Krebsbehandlungen untersucht.
Hintergrund
Insgesamt bindet das extrazelluläre Mitogen an den Membranrezeptor. Dies ermöglicht es Ras (einer kleinen GTPase ), sein BIP gegen ein GTP einzutauschen . Es kann jetzt aktivieren MAP3K (zB Raf ), die aktiviert MAP2K , die aktiviert MAPK . MAPK kann nun einen Transkriptionsfaktor wie Myc aktivieren . Ausführlicher:
Ras-Aktivierung
Rezeptor-gebundene Tyrosinkinasen wie der epidermale Wachstumsfaktorrezeptor (EGFR) werden durch extrazelluläre Liganden wie den epidermalen Wachstumsfaktor (EGF) aktiviert . Die Bindung von EGF an den EGFR aktiviert die Tyrosinkinase-Aktivität der zytoplasmatischen Domäne des Rezeptors. Der EGFR wird phosphoryliert an Tyrosinresten. Andockproteine wie GRB2 enthalten eine SH2-Domäne , die an die Phosphotyrosinreste des aktivierten Rezeptors bindet. GRB2 bindet über die beiden SH3-Domänen von GRB2 an den Guanin-Nukleotid-Austauschfaktor SOS . Wenn der GRB2-SOS-Komplex an phosphorylierten EGFR andockt, wird SOS aktiviert. Aktiviertes SOS fördert dann die Entfernung von GDP aus einem Mitglied der Ras-Unterfamilie (vor allem H-Ras oder K-Ras ). Ras kann dann GTP binden und aktiv werden.
Abgesehen von EGFR umfassen andere Zelloberflächenrezeptoren, die diesen Stoffwechselweg über GRB2 aktivieren können, Trk A/B , Fibroblasten-Wachstumsfaktor-Rezeptor (FGFR) und PDGFR .
Kinase-Kaskade
Aktiviertes Ras aktiviert die Proteinkinaseaktivität der RAF- Kinase. RAF-Kinase phosphoryliert und aktiviert MEK (MEK1 und MEK2). MEK phosphoryliert und aktiviert eine Mitogen-aktivierte Proteinkinase (MAPK).
RAF und ERK (auch als MAPK bekannt) sind beide Serin/Threonin-selektive Proteinkinasen . MEK ist eine Serin/Tyrosin/Threonin-Kinase.
Im technischen Sinne sind RAF, MEK und MAPK alle mitogenaktivierte Kinasen, ebenso wie MNK (siehe unten). MAPK wurde ursprünglich als „ extrazelluläre signalregulierte Kinasen “ ( ERKs ) und „Mikrotubulus-assoziierte Proteinkinase“ (MAPK) bezeichnet. Eines der ersten Proteine, von denen bekannt ist, dass es von ERK phosphoryliert wird, war ein Mikrotubuli-assoziiertes Protein (MAP). Wie unten diskutiert, wurden später viele zusätzliche Ziele für die Phosphorylierung durch MAPK gefunden, und das Protein wurde in "Mitogen-aktivierte Proteinkinase" (MAPK) umbenannt. Die Kinasenreihe von RAF über MEK bis MAPK ist ein Beispiel für eine Proteinkinasekaskade. Solche Kinasenserien bieten Möglichkeiten zur Rückkopplungsregulierung und Signalverstärkung.
Regulierung der Übersetzung und Transkription
Drei der vielen Proteine, die durch MAPK phosphoryliert werden, sind in der Abbildung gezeigt. Ein Effekt der MAPK-Aktivierung besteht darin, die Translation von mRNA in Proteine zu verändern . MAPK phosphoryliert 40S ribosomale Protein S6 Kinase ( RSK ). Dadurch wird RSK aktiviert, das wiederum das ribosomale Protein S6 phosphoryliert. Mitogen-aktivierte Proteinkinasen, die das ribosomale Protein S6 phosphorylieren, wurden als erste isoliert.
MAPK reguliert die Aktivitäten mehrerer Transkriptionsfaktoren . MAPK kann C-myc phosphorylieren . MAPK phosphoryliert und aktiviert MNK, das wiederum CREB phosphoryliert . MAPK reguliert auch die Transkription des C-Fos- Gens. Durch die Veränderung der Spiegel und Aktivitäten von Transkriptionsfaktoren führt MAPK zu einer veränderten Transkription von Genen, die für den Zellzyklus wichtig sind .
Die Gene 22q11, 1q42 und 19p13 sind mit Schizophrenie , schizoaffektiver , bipolarer und Migräne assoziiert , indem sie den ERK-Signalweg beeinflussen.
Regulierung des Eintritts und der Proliferation des Zellzyklus
Rolle der Mitogen-Signalgebung bei der Zellzyklusprogression Der ERK-Signalweg spielt eine wichtige Rolle bei der Integration externer Signale aus der Anwesenheit von Mitogenen wie dem epidermalen Wachstumsfaktor (EGF) in Signalgebungsereignisse, die das Zellwachstum und die Zellproliferation in vielen Säugetierzelltypen fördern. In einem vereinfachten Modell löst die Anwesenheit von Mitogenen und Wachstumsfaktoren die Aktivierung von kanonischen Rezeptor-Tyrosinkinasen wie EGFR aus, was zu ihrer Dimerisierung und anschließenden Aktivierung der kleinen GTPase Ras führt. Dies führt dann zu einer Reihe von Phosphorylierungsereignissen stromabwärts in der MAPK-Kaskade (Raf-MEK-ERK), die letztendlich zur Phosphorylierung und Aktivierung von ERK führt. Die Phosphorylierung von ERK führt zu einer Aktivierung seiner Kinaseaktivität und führt zur Phosphorylierung seiner vielen nachgeschalteten Ziele, die an der Regulierung der Zellproliferation beteiligt sind. In den meisten Zellen ist eine Form von anhaltender ERK-Aktivität erforderlich, damit Zellen Gene aktivieren, die den Eintritt in den Zellzyklus induzieren und negative Regulatoren des Zellzyklus unterdrücken. Zwei solch wichtige Ziele umfassen Cyclin D-Komplexe mit Cdk4 und Cdk6 (Cdk4/6), die beide von ERK phosphoryliert werden. Der Übergang von der G1- zur S-Phase wird durch die Aktivität von Cyclin D-Cdk4/6 koordiniert, die während der späten G1-Phase zunimmt, wenn sich die Zellen darauf vorbereiten, als Reaktion auf Mitogene in die S-Phase einzutreten. Die Aktivierung von Cdk4/6 trägt zur Hyperphosphorylierung und der nachfolgenden Destabilisierung des Retinoblastomproteins (Rb) bei. Hypophosphoryliertes Rb wird normalerweise im frühen G1 an den Transkriptionsfaktor E2F gebunden und hemmt dessen Transkriptionsaktivität, wodurch die Expression von S-Phase-Eintrittsgenen einschließlich Cyclin E, Cyclin A2 und Emi1 verhindert wird. Die ERK1/2-Aktivierung stromabwärts der mitogeninduzierten Ras-Signalgebung ist notwendig und ausreichend, um diese Zellzyklusblockierung zu beseitigen und den Zellen in den meisten Säugerzellen das Fortschreiten in die S-Phase zu ermöglichen.
Nachgeschaltete Feedback-Steuerung und Generierung eines bistabilen G1/S-Schalters
Der Restriktionspunkt (R-Punkt) markiert das kritische Ereignis, wenn eine Säugerzelle sich zur Proliferation verpflichtet und von der Wachstumsstimulation unabhängig wird. Es ist von grundlegender Bedeutung für die normale Differenzierung und Gewebehomöostase und scheint bei praktisch allen Krebsarten fehlreguliert zu sein. Obwohl der R-Punkt mit verschiedenen Aktivitäten in Verbindung gebracht wurde, die an der Regulierung des G1–S-Übergangs des Säugetierzellzyklus beteiligt sind, bleibt der zugrunde liegende Mechanismus unklar. Anhand von Einzelzellmessungen zeigen Yao et al., dass der Rb-E2F-Weg als bistabiler Schalter fungiert, um abgestufte Serumeinträge in Alles-oder-Nichts-E2F-Reaktionen umzuwandeln.
Wachstums- und Mitogensignale werden stromabwärts des ERK-Pfads übertragen und in mehrere positive Rückkopplungsschleifen eingebunden, um einen bistabilen Schalter auf der Ebene der E2F-Aktivierung zu erzeugen. Dies geschieht aufgrund von drei Hauptinteraktionen während der späten G1-Phase. Die erste ist das Ergebnis einer Mitogenstimulation durch das ERK, die zur Expression des Transkriptionsfaktors Myc führt, der ein direkter Aktivator von E2F ist. Der zweite Weg ist ein Ergebnis der ERK-Aktivierung, die zur Akkumulation aktiver Komplexe von Cyclin D und Cdk4/6 führt, die Rb über Phosphorylierung destabilisieren und weiter dazu dienen, E2F zu aktivieren und die Expression seiner Ziele zu fördern. Schließlich werden diese Interaktionen alle durch eine zusätzliche positive Rückkopplungsschleife von E2F auf sich selbst verstärkt, da seine eigene Expression zur Produktion des aktiven Komplexes von Cyclin E und CDK2 führt, der weiter dazu dient, die Entscheidung einer Zelle, in die S-Phase einzutreten, zu fixieren. Als Ergebnis reagieren die meisten Säugerzellen beim Eintritt in die S-Phase schalterartig, wenn die Serumkonzentration allmählich erhöht wird. Dieser mitogenstimulierte, bistabile E2F-Schalter weist eine Hysterese auf, da die Zellen daran gehindert werden, zu G1 zurückzukehren, selbst nach dem Mitogenentzug nach der E2F-Aktivierung.
Dynamische Signalverarbeitung durch den ERK-Weg
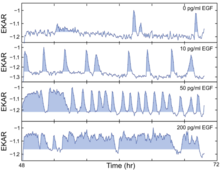
Der durch EGF stimulierte EGFR-ERK/MARK- Weg (epidermal growth factor receptor extracellular-regulated kinase/mitogen-activated protein kinase) ist entscheidend für die Zellproliferation, aber die zeitliche Trennung zwischen Signal und Reaktion verdeckt das Signal -Antwortbeziehung in früheren Forschungen. Im Jahr 2013 haben Albeck et al. lieferten wichtige experimentelle Beweise, um diese Wissenslücke zu schließen. Sie maßen Signalstärke und -dynamik mit stationärer EGF-Stimulation, bei der die Signalisierung und die Ausgabe leicht in Beziehung gesetzt werden können. Darüber hinaus kartierten sie die Signal-Antwort-Beziehung über den gesamten Dynamikbereich des Signalwegs. Mithilfe des hochkonzentrierten Immunfluoreszenz-(HCIF-)Nachweises von phosphoryliertem ERK (pERK) und lebenden Zellen-FRET-Biosensoren überwachten sie den Downstream-Output des ERK-Signalwegs sowohl in lebenden Zellen als auch in fixierten Zellen. Um die quantitativen Eigenschaften der ERK-Signalgebung weiter mit den Proliferationsraten zu verknüpfen, erstellten sie eine Reihe von Steady-State-Bedingungen unter Verwendung einer Reihe von EGF-Konzentrationen durch Anwendung von EGF mit unterschiedlichen Konzentrationen.
Einzelzell-Imaging-Experimente haben gezeigt, dass ERK in stochastischen Bursts in Gegenwart von EGF aktiviert wird. Darüber hinaus wurde gezeigt, dass der Pfad die Stärke von Signalisierungseingaben durch frequenzmodulierte Pulse seiner Aktivität kodiert. Unter Verwendung von FRET-Biosensoren aus lebenden Zellen induzierten Zellen mit unterschiedlichen Konzentrationen von EGF-Bursts von illegaler Aktivität unterschiedlicher Häufigkeit, wobei höhere EGF-Spiegel zu häufigeren Ausbrüchen von ERK-Aktivität führten. Um herauszufinden, wie der Eintritt in die S-Phase durch sporadische Impulse der ERK-Aktivität bei niedrigen EGF-Konzentrationen beeinflusst werden kann, verwendeten sie MCF-10A-Zellen, die EKAR-EV und RFP-Geminin koexprimierten, und identifizierten die Impulse der ERK-Aktivität mit der Bewertung und richteten sie dann aus diese ERK-Aktivitätsprofile mit der Zeit der GFP-Geminin-Induktion. Sie fanden heraus, dass längere Perioden der ERK-Aktivität den Eintritt in die S-Phase stimulieren, was durch eine erhöhte Pulslänge nahegelegt wird. Um die Dynamik des EGFR-ERK-Signalwegs zu verstehen, insbesondere wie Frequenz und Amplitude moduliert werden, verwendeten sie den EGFR-Inhibitor Gefitinib oder den hochselektiven MAPK/ERK-Kinase (MEK)-Inhibitor PD0325901 (PD). Zwei Inhibitoren führen tatsächlich zu einem etwas unterschiedlichen Ergebnis: Gefitinib würde bei mittlerer Konzentration ein pulsierendes Verhalten und auch eine bimodale Verschiebung induzieren, die bei PD nicht beobachtet wird. Sie kombinieren ferner EGF und PD miteinander und ziehen den Schluss, dass die Frequenz der ERK-Aktivitäten durch quantitative Variation moduliert wird, während die Amplitude durch die Änderung der MEK-Aktivität moduliert wird. Schließlich wandten sie sich Fra-1 zu, einem der nachgeschalteten Effektoren des ERK-Signalwegs, da es technisch schwierig ist, die ERK-Aktivitäten direkt abzuschätzen. Um zu verstehen, wie sich der integrierte ERK-Pfad-Output (der unabhängig von Frequenz oder Amplitude sein sollte) auf die Proliferationsrate auswirkt, verwendeten sie die Kombination einer breiten Palette von EGF- und PD-Konzentrationen und stellten fest, dass es tatsächlich eine invertierte „L“-Form gibt, die einfach krummlinig ist Beziehung, die darauf hindeutet, dass bei niedrigen Niveaus der ERK-Pfad-Ausgabe kleine Änderungen der Signalintensität großen Änderungen der Proliferationsrate entsprechen, während große Änderungen der Signalintensität nahe dem oberen Ende des Dynamikbereichs wenig Einfluss auf die Proliferation haben. Die Fluktuation der ERK-Signalgebung hebt potenzielle Probleme mit aktuellen therapeutischen Ansätzen hervor und bietet neue Perspektiven im Hinblick auf das Nachdenken über das Wirkstoff-Targeting im ERK-Signalweg bei Krebs.
Integration von Mitogen- und Stresssignalen in die Proliferation
Kürzlich durchgeführte Experimente zur Bildgebung von lebenden Zellen in MCF10A- und MCF7-Zellen haben gezeigt, dass eine Kombination von Mitogensignalen durch ERK und Stresssignalen durch Aktivierung von p53 in Mutterzellen zur Wahrscheinlichkeit beiträgt, ob neu gebildete Tochterzellen sofort wieder in den Zellzyklus eintreten oder Ruhe (G0) vor der Mitose. Anstatt Tochterzellen, die nach der Teilung ohne wichtige Signalproteine beginnen, können durch Mitogen/ERK induzierte Cyclin D1-mRNA und DNA-Schäden induziertes p53-Protein, beides langlebige Faktoren in Zellen, nach der Zellteilung stabil von Mutterzellen vererbt werden. Die Konzentrationen dieser Regulatoren variieren von Zelle zu Zelle nach der Mitose und die Stöchiometrie zwischen ihnen beeinflusst stark die Bindung des Zellzyklus durch die Aktivierung von Cdk2. Chemische Störungen, die Inhibitoren der ERK-Signalgebung oder Induktoren der p53-Signalgebung in Mutterzellen verwenden, deuten darauf hin, dass Tochterzellen mit hohen Konzentrationen an p53-Protein und niedrigen Konzentrationen an Cyclin D1-Transkripten hauptsächlich in G0 eindringen, während Zellen mit hohem Cyclin D1- und niedrigen Konzentrationen an p53 am wahrscheinlichsten sind um wieder in den Zellzyklus einzutreten. Diese Ergebnisse veranschaulichen eine Form von kodiertem molekularem Gedächtnis durch die Geschichte der Mitogen-Signalgebung durch ERK und Stressreaktion durch p53.
Klinische Bedeutung
Unkontrolliertes Wachstum ist ein notwendiger Schritt für die Entwicklung aller Krebsarten. Bei vielen Krebsarten (zB Melanomen ) führt ein Defekt im MAP/ERK-Signalweg zu diesem unkontrollierten Wachstum. Viele Verbindungen können Schritte im MAP/ERK-Weg hemmen und sind daher potentielle Medikamente zur Behandlung von Krebs, zB der Hodgkin-Krankheit .
Das erste Medikament, das für diesen Stoffwechselweg zugelassen ist, ist Sorafenib – ein Raf- Kinase-Hemmer.
Andere Raf-Inhibitoren: SB590885, PLX4720, XL281, RAF265, Encorafenib , Dabrafenib , Vemurafenib .
Einige MEK-Inhibitoren : Cobimetinib , CI-1040, PD0325901, Binimetinib ( MEK162 ), Selumetinib , Trametinib (GSK1120212). eng mit seinen Wirkungen bei der Hochregulierung der Aktivitäten des epidermalen Wachstumsfaktors/ERK-Signaltransduktionsweges verbunden.
Der RAF-ERK-Signalweg ist auch an der Pathophysiologie des Noonan-Syndroms beteiligt , einer polymalformativen Erkrankung, bei der Simvastatin als eine Möglichkeit zur Verbesserung der kognitiven ZNS-Symptome der Erkrankung vorgeschlagen wurde.
Die Protein- Microarray-Analyse kann verwendet werden, um subtile Veränderungen der Proteinaktivität in Signalwegen zu erkennen. Die Entwicklungssyndrome, die durch Keimbahnmutationen in Genen verursacht werden, die die RAS-Komponenten des MAP/ERK-Signaltransduktionsweges verändern, werden als RASopathien bezeichnet .
Siehe auch
Verweise
Externe Links
- MAP-Kinase-Ressource .
- Kyoto-Enzyklopädie der Gene und Genome — MAPK-Pfad
- MAP+Kinase+Signaling+System der US National Library of Medicine Medical Subject Headings (MeSH)