Magnesiumhydrid - Magnesium hydride
|
|
|
|
| Namen | |
|---|---|
|
IUPAC-Name
Magnesiumhydrid
|
|
| Kennungen | |
|
3D-Modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard |
100.028.824 |
| EG-Nummer | |
|
PubChem CID
|
|
| UNII | |
|
|
|
|
| Eigenschaften | |
| MgH 2 | |
| Molmasse | 26,3209 g / mol |
| Aussehen | weiße Kristalle |
| Dichte | 1,45 g / cm 3 |
| Schmelzpunkt | 327 ° C (621 ° F; 600 K) zersetzt sich |
| zersetzt sich | |
| Löslichkeit | in Äther unlöslich |
| Struktur | |
| tetragonal | |
| Thermochemie | |
|
Wärmekapazität ( C )
|
35,4 J / mol K. |
|
Std molare
Entropie ( S |
31,1 J / mol K. |
|
Std Enthalpie der
Bildung (Δ f H ⦵ 298 ) |
-75,2 kJ / mol |
|
Gibbs freie Energie (Δ f G ˚)
|
-35,9 kJ / mol |
| Gefahren | |
| Hauptgefahren | pyrophor |
| Verwandte Verbindungen | |
|
Andere Kationen
|
Berylliumhydrid Calciumhydrid Strontiumhydrid Bariumhydrid |
| Magnesiummonohydrid Mg 4 H 6 | |
|
Sofern nicht anders angegeben, werden Daten für Materialien in ihrem Standardzustand (bei 25 ° C, 100 kPa) angegeben. |
|
|
|
|
| Infobox-Referenzen | |
Magnesiumhydrid ist die chemische Verbindung mit der Summenformel MgH 2 . Es enthält 7,66 Gew .-% Wasserstoff und wurde als potentielles Wasserstoffspeichermedium untersucht.
Vorbereitung
1951 wurde erstmals über die Herstellung aus den Elementen berichtet, bei der Mg-Metall bei hohem Druck und hoher Temperatur (200 Atmosphären, 500 ° C) mit MgI 2 -Katalysator direkt hydriert wurde:
- Mg + H 2 → MgH 2
Die Produktion bei niedrigerer Temperatur aus Mg und H 2 unter Verwendung von nanokristallinem Mg, das in Kugelmühlen hergestellt wurde, wurde untersucht. Andere Vorbereitungen umfassen:
- die Hydrierung von Magnesiumanthracen unter milden Bedingungen:
- Mg (Anthracen) + H 2 → MgH 2
- die Reaktion von Diethylmagnesium mit Lithiumaluminiumhydrid
- Produkt von komplexiertem MgH 2, z. B. MgH 2 .THF, durch Reaktion von Phenylsilan und Dibutylmagnesium in Ether- oder Kohlenwasserstofflösungsmitteln in Gegenwart von THF oder TMEDA als Ligand.
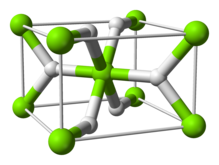
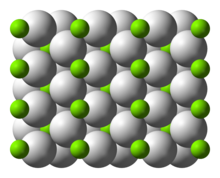
Struktur und Bindung
Die Raumtemperaturform α-MgH 2 hat eine Rutilstruktur . Es gibt mindestens vier Hochdruckformen: γ-MgH 2 mit α-PbO 2 -Struktur, kubisches β-MgH 2 mit Pa-3-Raumgruppe, orthorhombisches HP1 mit Pbc2 1 -Raumgruppe und orthorhombisches HP2 mit Pnma-Raumgruppe. Zusätzlich wurde ein nicht stöchiometrisches MgH (2-δ) charakterisiert, das jedoch nur für sehr kleine Partikel zu existieren scheint
(Bulk-MgH 2 ist im Wesentlichen stöchiometrisch, da es nur sehr geringe Konzentrationen an H-Leerstellen aufnehmen kann).
Die Bindung in der Rutilform wird manchmal als teilweise kovalent und nicht als rein ionisch beschrieben. Die Bestimmung der Ladungsdichte durch Synchrotron-Röntgenbeugung zeigt an, dass das Magnesiumatom vollständig ionisiert und kugelförmig ist und das Hydridion verlängert ist. Molekulare Formen von Magnesiumhydrid-, MgH-, MgH 2 - , Mg 2 H-, Mg 2 H 2 - , Mg 2 H 3 - und Mg 2 H 4 -Molekülen, die durch ihre Schwingungsspektren identifiziert wurden, wurden in matrixisolierten Proben bei unter 10 K gefunden, die nachfolgend gebildet wurden Laserablation von Magnesium in Gegenwart von Wasserstoff. Das Mg 2 H 4 -Molekül hat eine Brückenstruktur analog zu dem dimeren Aluminiumhydrid Al 2 H 6 .
Reaktionen
MgH 2 reagiert leicht mit Wasser unter Bildung von Wasserstoffgas:
- MgH 2 + 2 H 2 O → 2 H 2 + Mg (OH) 2
Bei 287 ° C zersetzt es sich unter Bildung von H 2 bei 1 bar Druck. Die erforderliche hohe Temperatur wird als Einschränkung bei der Verwendung von MgH 2 als reversibles Wasserstoffspeichermedium angesehen:
- MgH 2 → Mg + H 2
Mögliche Verwendung für die Wasserstoffspeicherung
Sein Potenzial als reversibles "Speicher" -Medium für Wasserstoff hat zu Interesse an der Verbesserung der Kinetik der Hydrierungs- und Dehydrierungsreaktion geführt. Dies kann teilweise durch Dotieren oder durch Reduzieren der Partikelgröße durch Kugelmahlen erreicht werden . Ein alternativer Ansatz, der untersucht wird, ist die Herstellung einer pumpbaren Aufschlämmung von MgH 2, die sicher zu handhaben ist und H 2 durch Reaktion mit Wasser unter Wiederaufbereitung des Mg (OH) 2 zu MgH 2 freisetzt . [1] Eine Reihe von US-Patenten (US9123925B2, US8651268B2, US8651270B2, US9732906B2) und internationalen Patenten wurde für ein wiederaufladbares Niederdruck-Niedertemperatur-Wasserstoffspeichersystem erteilt, das nanostrukturiertes Magnesiumhydrid für die Wasserstoffabsorption hoher Dichte und die laseraktivierte Desorption verwendet . Ein praktisches System verwendet behandelte Polymersubstrate in Form einer Scheibe oder eines Bandes zur Verwendung bei Langzeitlagerung, Transport und Gitterstabilisierung. Das System hat einen einzigartigen Vorteil in der Fähigkeit, Wasserstoff aus industriellen Abgasen und Abfallbehandlungsanlagen passiv einzufangen, bevor er sich unter Bildung von Treibhausgasen verbinden kann.
