Oogenese - Oogenesis
| Oogenese | |
|---|---|
| Identifikatoren | |
| Gittergewebe | D009866 |
| TE | E1.0.2.2.0.0.2 |
| Anatomische Terminologie | |
Oogenesis , ovogenesis oder Oogenese / ˌ oʊ . ə dʒ ɛ n ɪ s ɪ s / wird , um die Differenzierung der Eizelle (Eizelle) in eine Zelle kompetent weiter , wenn befruchteten zu entwickeln. Es wird aus der primären Eizelle durch Reifung entwickelt. Die Oogenese wird im embryonalen Stadium eingeleitet.
Oogenese bei nicht-menschlichen Säugetieren
Bei Säugetieren beginnt der erste Teil der Oogenese im Keimepithel , was zur Entwicklung von Eierstockfollikeln , der funktionellen Einheit des Eierstocks, führt .
Die Oogenese besteht aus mehreren Teilprozessen: Oozytogenese, Ootidogenese und schließlich die Reifung zur Eizelle (eigentliche Oogenese). Die Follikulogenese ist ein separater Teilprozess, der alle drei oogenetischen Teilprozesse begleitet und unterstützt.
| Zelltyp | Ploidie / Chromosomen | Chromatiden | Verfahren | Zeitpunkt der Fertigstellung |
| Oogonium | diploid/46(2N) | 2C | Oocytogenese ( Mitose ) | Drittes Trimester |
| primäre Eizelle | diploid/46(2N) | 4C | Ootidogenese ( Meiose I) ( Follikulogenese ) | Dictyate in Prophase I für bis zu 50 Jahre |
| sekundäre Eizelle | haploid/23(1N) | 2C | Ootidogenese ( Meiose II) | Angehalten in Metaphase II bis zur Befruchtung |
| Ootid | haploid/23(1N) | 1C | Ootidogenese ( Meiose II) | Minuten nach der Befruchtung |
| Ovum | haploid/23(1N) | 1C |
Oogonium —(Oocytogenese)—> Primäre Eizelle —(Meiose I)—> Erster Polkörper (wird danach verworfen) + Sekundäre Eizelle —(Meiose II)—> Zweiter Polkörper (wird danach verworfen) + Eizelle
Oozyten Meiose, wichtig für alle Tierlebenszyklen noch im Gegensatz zu allen anderen Fällen von Tier Zellteilung erfolgt komplett ohne die Hilfe von Spindel -coordinating Zentrosomen .
Die Entstehung von Oogonia
Die Bildung von Oogonien gehört traditionell nicht zur eigentlichen Oogenese, sondern zum gemeinsamen Prozess der Gametogenese , der beim weiblichen Menschen mit den Prozessen Follikulogenese , Oocytogenese und Ootidogenese beginnt . Oogonien treten während der Embryonalentwicklung in die Meiose ein und werden zu Eizellen. Die Meiose beginnt mit der DNA-Replikation und dem meiotischen Crossing-over. Es stoppt dann in der frühen Prophase.
Aufrechterhaltung des meiotischen Stillstands
Säugetier-Oozyten werden sehr lange im meiotischen Prophase-Arrest gehalten – Monate bei Mäusen, Jahre beim Menschen. Anfänglich ist der Arrest auf einen Mangel an ausreichenden Zellzyklusproteinen zurückzuführen, um eine meiotische Progression zu ermöglichen. Wenn die Eizelle wächst, werden diese Proteine jedoch synthetisiert und der Meiosestillstand wird von zyklischem AMP abhängig . Das zyklische AMP wird von der Eizelle durch Adenylylzyklase in der Eizellmembran erzeugt. Die Adenylylcyclase wird durch einen konstitutiv aktiven G-Protein-gekoppelten Rezeptor, der als GPR3 bekannt ist, und ein G-Protein, Gs, das ebenfalls in der Eizellmembran vorhanden ist, aktiv gehalten.
Die Aufrechterhaltung des Meiosestillstands hängt auch von der Anwesenheit eines mehrschichtigen Zellkomplexes ab, der als Follikel bekannt ist und die Eizelle umgibt. Die Entfernung der Eizelle aus dem Follikel führt dazu, dass die Meiose in der Eizelle fortschreitet. Die Zellen, aus denen der Follikel besteht, die als Granulosazellen bekannt sind, sind durch Proteine, die als Gap Junctions bekannt sind, miteinander verbunden, die es kleinen Molekülen ermöglichen, zwischen den Zellen zu gelangen. Die Granulosazellen produzieren ein kleines Molekül, zyklisches GMP , das durch die Gap Junctions in die Eizelle diffundiert. In der Eizelle verhindert zyklisches GMP den Abbau von zyklischem AMP durch die Phosphodiesterase PDE3 und hält so den Meiosestillstand aufrecht. Das zyklische GMP wird von der Guanylylzyklase NPR2 produziert.
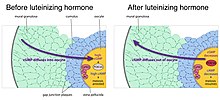
Wiederinitiierung der Meiose und Stimulation des Eisprungs durch luteinisierendes Hormon
Wenn Follikel wachsen, erwerben sie Rezeptoren für das luteinisierende Hormon, ein Hypophysenhormon, das die Meiose in der Eizelle wieder einleitet und den Eisprung einer befruchtbaren Eizelle verursacht. Das luteinisierende Hormon wirkt auf Rezeptoren in den äußeren Schichten der Granulosazellen des Follikels und verursacht eine Abnahme des zyklischen GMP in den Granulosazellen. Da die Granulosazellen und die Eizelle durch Gap Junctions verbunden sind, nimmt auch das zyklische GMP in der Eizelle ab, wodurch die Meiose wieder aufgenommen wird. Die Meiose geht dann in die zweite Metaphase über, wo sie wieder bis zur Befruchtung pausiert. Das luteinisierende Hormon stimuliert auch die Genexpression, die zum Eisprung führt.

Menschliche Oogenese
Oogenese
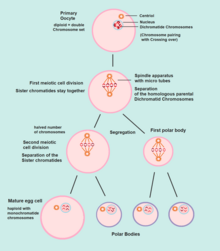
Die Oogenese beginnt mit dem Prozess der Entwicklung primärer Eizellen, der durch die Umwandlung von Oogonien in primäre Eizellen erfolgt , ein Prozess, der als Oocytogenese bezeichnet wird. Die Oocytogenese ist entweder vor oder kurz nach der Geburt abgeschlossen.
Anzahl der primären Eizellen
Es wird allgemein angenommen, dass, wenn die Oocytogenese abgeschlossen ist, keine zusätzlichen primären Oocyten erzeugt werden, im Gegensatz zum männlichen Prozess der Spermatogenese, bei dem kontinuierlich Gametocyten gebildet werden. Mit anderen Worten, primäre Eizellen erreichen ihre maximale Entwicklung bei ~20 Schwangerschaftswochen, wenn ungefähr sieben Millionen primäre Eizellen erzeugt wurden; bei der Geburt ist diese Zahl jedoch bereits auf etwa 1-2 Millionen reduziert.
Zwei Veröffentlichungen haben die Annahme in Frage gestellt, dass um den Zeitpunkt der Geburt eine endliche Anzahl von Eizellen gebildet wird. Die Erneuerung von Ovarialfollikeln aus Keimbahn-Stammzellen (die aus Knochenmark und peripherem Blut stammen) wurde im postnatalen Maus-Ovar berichtet. Im Gegensatz dazu deuten DNA-Uhrenmessungen nicht auf eine laufende Oogenese während der Lebenszeit von Menschenfrauen hin. Daher sind weitere Experimente erforderlich, um die wahre Dynamik der Bildung kleiner Follikel zu bestimmen.
Ootidogenese
Die nachfolgende Phase der Ootidogenese tritt auf, wenn sich die primäre Eizelle zu einem Ootiden entwickelt. Dies wird durch den Prozess der Meiose erreicht. Tatsächlich ist eine primäre Eizelle nach ihrer biologischen Definition eine Zelle, deren Hauptfunktion darin besteht, sich durch den Prozess der Meiose zu teilen.
Dieser Prozess beginnt zwar im pränatalen Alter, endet jedoch in der Prophase I . Im späten fetalen Leben sind alle Eizellen, immer noch primäre Eizellen, in diesem Entwicklungsstadium, dem sogenannten Diktyat , zum Stillstand gekommen . Nach der Menarche entwickeln sich diese Zellen dann weiter, allerdings nur wenige in jedem Menstruationszyklus .
Meiose I
Die Meiose I der Ootidogenese beginnt während der Embryonalentwicklung, endet aber im diplotären Stadium der Prophase I bis zur Pubertät. Die Maus - Oocyten in der Diktyotän (verlängerte Diplotän) Stufe aktiv Reparaturen DNA - Schäden, während der DNA - Reparatur ist in dem Pre-Diktyotän (nicht nachweisbares Leptotän , Zygotän und Pachytän ) Stadien der Meiose. Bei den primären Eizellen, die sich in jedem Menstruationszyklus weiterentwickeln, treten jedoch Synapsen auf und es bilden sich Tetraden , wodurch ein chromosomaler Crossover möglich wird . Als Folge der Meiose I hat sich nun die primäre Eizelle zur sekundären Eizelle entwickelt .
Meiose II
Unmittelbar nach Meiose I leitet die haploide sekundäre Eizelle die Meiose II ein . Dieser Prozess wird jedoch auch im Stadium der Metaphase II bis zur Befruchtung gestoppt , falls eine solche jemals eintreten sollte. Wenn die Eizelle nicht befruchtet wird, wird sie zersetzt und freigesetzt ( Menstruation ) und die sekundäre Eizelle schließt die Meiose II nicht ab (und wird nicht zu einer Eizelle ). Nach Abschluss der Meiose II sind nun ein Ootid und ein weiterer Polkörper entstanden. Der Polkörper ist klein.
Follikulogenese
Synchron mit der Ootidogenese hat sich der Ovarialfollikel , der das Ootid umgibt, von einem primordialen Follikel zu einem präovulatorischen Follikel entwickelt.
Reifung zur Eizelle
Am Ende der Meiose II zerfallen beide Polkörperchen und es bleibt nur das Ootid übrig, das schließlich zu einer reifen Eizelle reift.
Die Funktion der Polkörperbildung besteht darin, die als Folge der Meiose entstandenen extra haploiden Chromosomensätze zu verwerfen.
In-vitro-Reifung
In-vitro-Reifung ( IVM ) ist die Technik, bei der Eierstockfollikel in vitro reifen lassen . Es kann möglicherweise vor einer IVF durchgeführt werden . In solchen Fällen ist eine Überstimulation der Eierstöcke nicht unbedingt erforderlich . Vielmehr können Eizellen vor der IVF außerhalb des Körpers reifen. Daher müssen dem Körper keine (oder zumindest eine geringere Dosis) von Gonadotropinen injiziert werden. Unreife Eier wurden bis zur Reifung in vitro mit einer Überlebensrate von 10 % gezüchtet , aber die Technik ist noch nicht klinisch verfügbar. Mit dieser Technik könnte kryokonserviertes Ovarialgewebe möglicherweise verwendet werden, um Eizellen herzustellen, die direkt einer In-vitro-Fertilisation unterzogen werden können .
In-vitro-Oogenese
Per Definition bedeutet dies, die Oogenese von Säugetieren zu rekapitulieren und befruchtungsfähige Eizellen in vitro zu produzieren je nach Entwicklungsstadium. Im Jahr 2016 wurden zwei von Morohaku et al. und Hikabeet al. berichteten über In-vitro-Verfahren, die diese Bedingungen anscheinend effizient reproduzieren, was die Produktion einer relativ großen Anzahl von befruchtungsfähigen Eizellen vollständig in einer Schale ermöglicht, die in der Lage sind, lebensfähige Nachkommen in der Maus hervorzubringen. Diese Technik kann vor allem bei Krebspatienten von Nutzen sein, bei denen ihr Ovarialgewebe im heutigen Zustand zur Erhaltung der Fruchtbarkeit kryokonserviert wird. Alternativ zur autologen Transplantation stellt die Entwicklung von Kultursystemen, die die Eizellentwicklung ab dem primordialen Follikelstadium unterstützen, eine valide Strategie zur Wiederherstellung der Fertilität dar. Im Laufe der Zeit wurden viele Studien mit dem Ziel durchgeführt, die Eigenschaften von Ovarialgewebekultursystemen zu optimieren und die drei Hauptphasen besser zu unterstützen: 1) Aktivierung der Primordialfollikel; 2) Isolierung und Kultur wachsender präantraler Follikel; 3) Entfernung aus der Follikelumgebung und Reifung von Oozyten-Cumulus-Komplexen. Während bei Mäusen eine vollständige In-vitro-Entwicklung von Eizellen mit der Produktion lebender Nachkommen erreicht wurde, wurde das Ziel, Eizellen von ausreichender Qualität zu erhalten, um die Embryonalentwicklung zu unterstützen, trotz jahrzehntelanger Bemühungen bei höheren Säugetieren nicht vollständig erreicht.
Alterung der Eierstöcke
BRCA1- und ATM- Proteine werden bei der Reparatur von DNA -Doppelstrangbrüchen während der Meiose eingesetzt . Diese Proteine scheinen eine entscheidende Rolle dabei zu spielen, der Alterung der Eierstöcke zu widerstehen . Die homologe rekombinatorische Reparatur von DNA-Doppelstrangbrüchen, die durch BRCA1 und ATM vermittelt wird, schwächt sich jedoch mit dem Alter in Oozyten von Menschen und anderen Spezies ab. Frauen mit BRCA1- Mutationen haben geringere ovarielle Reserven und erleben eine frühere Menopause als Frauen ohne diese Mutationen. Auch bei Frauen ohne spezifische BRCA1-Mutationen ist die Alterung der Eierstöcke mit einer Erschöpfung der Eierstockreserven verbunden, die zur Menopause führt, jedoch langsamer als bei Frauen mit solchen Mutationen. Da ältere prämenopausale Frauen normalerweise normale Nachkommen haben, scheint ihre Fähigkeit zur meiotischen rekombinatorischen Reparatur ausreichend zu sein, um eine Verschlechterung ihrer Keimbahn trotz der Verringerung der ovariellen Reserve zu verhindern. DNA-Schäden können in der Keimbahn während des jahrzehntelangen Zeitraums beim Menschen zwischen der frühen Oocytogenese und dem Stadium der Meiose entstehen, in dem homologe Chromosomen effektiv gepaart werden ( Dictyate- Stadium). Es wurde vorgeschlagen, dass solche DNA-Schäden zum großen Teil durch Mechanismen beseitigt werden können, die von der Chromosomenpaarung abhängig sind, wie etwa durch homologe Rekombination.
Oogenese bei Nicht-Säugetieren
Einige Algen und die Oomyceten produzieren Eier in Oogonien . Bei der Braunalge Fucus überleben alle vier Eizellen die Oogenese, was eine Ausnahme von der Regel darstellt, dass im Allgemeinen nur ein Produkt der weiblichen Meiose bis zur Reife überlebt.
Bei Pflanzen erfolgt die Oogenese innerhalb des weiblichen Gametophyten durch Mitose . Bei vielen Pflanzen wie Moosen , Farnen und Gymnospermen werden Eizellen in Archegonien gebildet . Bei blühenden Pflanzen ist der weibliche Gametophyt auf einen achtzelligen Embryosack innerhalb der Samenanlage im Eierstock der Blüte reduziert . Die Oogenese findet innerhalb des Embryosacks statt und führt zur Bildung einer einzelnen Eizelle pro Eizelle.
In Ascaris , wird die Eizelle nicht einmal ansatz Meiose , bis das Sperma berührt, im Gegensatz zu Säugetieren, wo die Meiose in dem abgeschlossen ist Brunst Zyklus.
Bei weiblichen Drosophila- Fliegen kommt es während der Meiose zur genetischen Rekombination . Diese Rekombination ist mit der Bildung von DNA-Doppelstrangbrüchen und deren Reparatur verbunden . Der Reparaturprozess führt zu Crossover-Rekombinanten sowie zu mindestens dreimal so vielen Nicht-Crossover-Rekombinanten (zB entstehen durch Genkonversion ohne Crossover).
Siehe auch
- Anisogamie
- Archegonium
- Evolution der sexuellen Fortpflanzung
- Weibliche Unfruchtbarkeit
- Weiblicher Fortpflanzungsapparat
- Meiose
- Onkofertilität
- Oogonium
- Eizelle
- Ursprung und Funktion der Meiose
- Sexuelle Fortpflanzung
- Spermatogenese
Verweise
Cho WK, Stern S, Biggers JD. 1974. Hemmende Wirkung von Dibutyryl-cAMP auf die Reifung von Maus-Oozyten in vitro. J Exp Zool.187:383-386
- Literaturverzeichnis
- Manandhar G, Schatten H und Sutovsky P (2005). Zentrosomenreduktion während der Gametogenese und ihre Bedeutung. Biol Reprod, 72(1)2-13.