Sacubitril/Valsartan - Sacubitril/valsartan
 | |
| Kombination von | |
|---|---|
| Sacubitril | Neprilysin-Inhibitor |
| Valsartan | Angiotensin-II-Rezeptor-Antagonist |
| Klinische Daten | |
| Namen austauschen | Entresto, Azmarda, Neparvis, andere |
| Andere Namen | LCZ696 |
| AHFS / Drugs.com | Monographie |
| MedlinePlus | a615039 |
| Lizenzdaten | |
| Schwangerschaft Kategorie |
|
| Wege Verwaltung |
Mit dem Mund |
| ATC-Code | |
| Rechtsstellung | |
| Rechtsstellung | |
| Bezeichner | |
| CAS-Nummer | |
| PubChem- CID | |
| UNII | |
| KEGG | |
| CompTox-Dashboard ( EPA ) | |
| Chemische und physikalische Daten | |
| Formel | C 96 H 120 N 12 Na 6 O 21 |
| Molmasse | 1 916 , 018 g·mol -1 |
| 3D-Modell ( JSmol ) | |
| |
| |
Sacubitril/Valsartan , das unter dem Markennamen Entresto vertrieben wird , ist ein Kombinationspräparat mit fester Dosis zur Anwendung bei Herzinsuffizienz . Es besteht aus dem Neprilysin-Inhibitor Sacubitril und dem Angiotensin-Rezeptor-Blocker Valsartan . Es wird als Ersatz für einen ACE-Hemmer oder einen Angiotensin-Rezeptor-Blocker bei Patienten mit Herzinsuffizienz mit reduzierter Auswurffraktion empfohlen .
Mögliche Nebenwirkungen sind Angioödeme , Nierenprobleme und niedriger Blutdruck . Die Kombination wird manchmal als "Angiotensin-Rezeptor-Neprilysin-Inhibitor" (ARNi) bezeichnet.
Es wurde 2015 in den USA und in der Europäischen Union für die medizinische Verwendung zugelassen. Es wurde 2016 in Australien für die medizinische Verwendung zugelassen.
Medizinische Anwendungen
Sacubitril / Valsartan kann anstelle eines verwendet werden , ACE - Hemmer oder einen Angiotensin - Rezeptorblocker bei Menschen mit Herzversagen und eine reduzierte linksventrikuläre Ejektionsfraktion (LVEF), neben anderen Standardtherapien (zB Beta-Blocker ) für Herzversagen. Um seine Anwendung bei Herzinsuffizienz bei Patienten mit einer erhaltenen LVEF (HFpEF) zu untersuchen, finanzierte Novartis die PARAGON-HF-Studie, die die Anwendung von Sacubatril/Valsartan bei der Behandlung von HFpEF-Patienten mit einer LVEF von 45% oder mehr untersuchen sollte. Im Jahr 2019 wurde festgestellt, dass es keine Bedeutung für die Reduzierung von Krankenhausaufenthalten im Zusammenhang mit Herzinsuffizienz oder die Reduzierung von Todesfällen aufgrund kardiovaskulärer Ursachen zeigte und daher anscheinend nur einen begrenzten Nutzen für Personen mit HFpEF zeigt. Ein systematischer Cochrane-Review der Daten aus 37 Studien, in denen Behandlungen von HFpEF untersucht wurden, deutete darauf hin, dass derzeit auch keine Evidenz für die Anwendung von ACE-Hemmern, ARBs oder ARNIs bei Patienten mit HFpEF vorliegt und dass die pharmakologische Haupttherapie von HFpEF immer noch die Behandlung bleibt von Begleiterkrankungen wie Bluthochdruck oder anderen Auslösern für eine Dekompensation. Bei Patienten, die Symptome einer Herzinsuffizienz der NYHA-Klasse II oder III aufweisen und trotz der maximal verträglichen Dosis eines ACE-Hemmers oder alleiniger ARB immer noch symptomatisch sind, kann eine Sacubitril/Valsartan-Doppeltherapie in Betracht gezogen werden, um das Risiko einer kardiovaskulären und Gesamtmortalität zu verringern . Sterblichkeitsvorteile wurden bisher nur bei Personen mit einer LVEF von weniger als 35 % beobachtet.
Die Umstellung von 100 Personen von einem ACE-Hemmer oder Angiotensin-II-Rezeptor-Antagonisten auf Sacubitril/Valsartan für 2,3 Jahre würde drei Todesfälle, fünf Krankenhauseinweisungen wegen Herzinsuffizienz und insgesamt elf Krankenhauseinweisungen verhindern.
Nebenwirkungen
Häufige Nebenwirkungen [> 1 %] sind Hyperkaliämie [hohe Kaliumspiegel im Blut, eine bekannte Nebenwirkung von Valsartan], Hypotonie [niedriger Blutdruck, häufig bei Vasodilatatoren und Volumenreduzierern extrazellulärer Flüssigkeit], anhaltender trockener Husten und Nierenfunktionsstörung [ eingeschränkte Nierenfunktion].
Angioödeme, eine seltene, aber schwerwiegendere Reaktion, können bei einigen Patienten [<1 %] auftreten und beinhalten ein Anschwellen von Gesicht und Lippen. Angioödeme treten häufiger bei schwarzen Patienten auf. Sacubitril/Valsartan sollte nicht innerhalb von 36 Stunden nach einem Angiotensin-Converting-Enzym-Hemmer eingenommen werden, um das Risiko der Entwicklung eines Angioödems zu verringern.
Das Nebenwirkungsprofil in Studien mit Sacubitril/Valsartan im Vergleich zu Valsartan allein oder Enalapril [einem Angiotensin-Converting-Enzym-Hemmer] ist sehr ähnlich, wobei die Inzidenz von Hypotonie bei Sacubitril/Valsartan etwas höher, das Risiko für Angioödeme vergleichbar und die Wahrscheinlichkeit einer Hyperkaliämie ist , Nierenfunktionsstörung und Husten etwas niedriger.
Sacubitril/Valsartan ist während der Schwangerschaft kontraindiziert, da es Valsartan enthält, ein bekanntes Risiko für Geburtsfehler.
Pharmakologie
Valsartan blockiert den Angiotensin-II-Rezeptor Typ 1 (AT 1 ). Dieser Rezeptor findet sich sowohl auf vaskulären glatten Muskelzellen als auch auf den Zona glomerulosa- Zellen der Nebenniere, die für die Aldosteronsekretion verantwortlich sind. In Abwesenheit von AT 1 - Blockade bewirkt Angiotensin sowohl direkte Vasokonstriktion und adrenalen Aldosteronsekretion, dann ist die Aldosteron an den distalen Tubuluszellen der Niere wirken , Natrium - Reabsorption zu fördern , die erweitert extrazellulärem Fluid (ECF) Volumen. Die Blockade von (AT 1 ) verursacht somit eine Erweiterung der Blutgefäße und eine Verringerung des ECF-Volumens.
Sacubitril ist ein Prodrug , das aktiviert wird , um sacubitrilat (LBQ657) von de- Ethylierung über Esterasen . Sacubitrilat hemmt das Enzym Neprilysin , eine neutrale Endopeptidase , die vasoaktive Peptide abbaut , einschließlich natriuretischer Peptide , Bradykinin und Adrenomedullin . Somit erhöht Sacubitril die Spiegel dieser Peptide, was zu einer Erweiterung der Blutgefäße und einer Verringerung des ECF-Volumens über die Natriumausscheidung führt.
Trotz dieser Wirkungen wurde festgestellt, dass Neprilysin-Inhibitoren bei alleiniger Einnahme eine begrenzte Wirksamkeit bei der Behandlung von Bluthochdruck und Herzinsuffizienz aufweisen. Dies wird auf eine Verringerung des enzymatischen Abbaus von Angiotensin II durch die Verringerung der Neprilysin-Aktivität zurückgeführt, was zu einem Anstieg der systemischen Angiotensin-II-Spiegel und der Aufhebung der positiven Wirkungen dieser Wirkstofffamilie bei der Behandlung von Herz-Kreislauf-Erkrankungen führt. Die kombinierte Behandlung mit einem Neprilysin-Hemmer und einem Angiotensin-Converting-Enzym-(ACE)-Hemmer hat sich bei der Senkung des Angiotensin-II-Spiegels als wirksam erwiesen und zeigte eine Überlegenheit bei der Senkung des Blutdrucks im Vergleich zur alleinigen ACE-Hemmung. Aufgrund eines Anstiegs der Bradykinine durch die Hemmung sowohl von ACE als auch von Neprilysin war das relative Risiko für Angioödeme jedoch im Vergleich zu einer alleinigen ACE-Hemmung nach dieser Kombinationsbehandlung um das Dreifache angestiegen. Die Kombination eines Neprilysin-Hemmers mit einem Angiotensin-Rezeptor-Blocker anstelle des ACE-Hemmers hat ein vergleichbares Angioödem-Risiko, zeigt aber auch eine Überlegenheit bei der Behandlung einer mittelschweren bis schweren Herzinsuffizienz gegenüber einer ACE-Hemmer-Behandlung.
Neprilysin spielt auch eine Rolle bei der Ausscheidung des Proteins Amyloid beta aus der Zerebrospinalflüssigkeit , und seine Hemmung durch Sacubitril hat bei gesunden Probanden erhöhte AB 1-38- Spiegel gezeigt (Entresto 194/206 für zwei Wochen). Es wird angenommen, dass Amyloid beta zur Entwicklung der Alzheimer-Krankheit beiträgt, und es bestehen Bedenken, dass Sacubitril die Entwicklung der Alzheimer-Krankheit fördern könnte.
Chemie
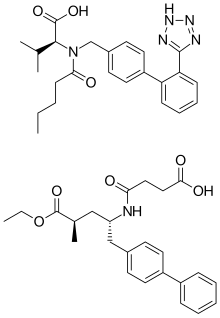
Sacubitril/Valsartan ist co-kristallisiertes Sacubitril und Valsartan in einem molaren Verhältnis von eins zu eins . Ein Sacubitril/Valsartan- Komplex besteht aus sechs Sacubitril- Anionen , sechs Valsartan-Dianionen, 18 Natrium-Kationen und 15 Wassermolekülen, was die Summenformel C 288 H 330 N 36 Na 18 O 48 ·15H 2 O und eine Molekülmasse von 5748.03 . ergibt g/mol.
Die Substanz ist ein weißes Pulver, das aus dünnen sechseckigen Plättchen besteht. Es ist sowohl in fester Form als auch in wässriger (Wasser-) Lösung mit einem pH-Wert von 5 bis 7 stabil und hat einen Schmelzpunkt von ca. 138 °C (280 °F).
Geschichte
Während seiner Entwicklung durch Novartis war Entresto als LCZ696 bekannt. Es wurde am 7. Juli 2015 im Rahmen des Prioritätsprüfungsverfahrens der FDA zugelassen. 2015 wurde es auch in Europa zugelassen.
Gesellschaft und Kultur
Testdesign
Kontroversen gab es über die PARADIGM-HF-Studie – die Phase-III-Studie, auf deren Grundlage das Medikament von der FDA zugelassen wurde. So stellten beispielsweise sowohl Richard Lehman, ein Arzt, der eine wöchentliche Übersicht wichtiger medizinischer Artikel für den BMJ-Blog verfasst, als auch ein Bericht des Institute for Clinical and Economic Review (ICER) vom Dezember 2015 fest, dass das Nutzen-Risiko-Verhältnis nicht angemessen bestimmt wurde weil das Design der klinischen Studie zu künstlich war und Menschen mit Herzinsuffizienz, denen Ärzte normalerweise begegnen, nicht widerspiegelte. Im Jahr 2019 untersuchten die Studien PIONEER-HF und PARAGON-HF die Wirkung von Sacubitril/Valsartan bei 800 Patienten, die kürzlich mit schwerer Herzinsuffizienz ins Krankenhaus eingeliefert wurden, bzw. 4800 Patienten mit weniger schweren Symptomen der Herzinsuffizienz. Das Medikament zeigte durchweg ein ähnliches Sicherheitsniveau mit höheren Raten von sehr niedrigem Blutdruck im Vergleich zu aktuellen Behandlungen in allen drei Studien bei einer Vielzahl von Patienten, zeigte jedoch nur bei Patienten mit fortgeschrittener Herzinsuffizienz Wirksamkeit. Im Dezember 2015 sagten Steven Nissen und andere Vordenker in der Kardiologie, dass die Zulassung von Sacubitril/Valsartan 2015 den größten Einfluss auf die klinische Praxis in der Kardiologie hatte, und Nissen nannte das Medikament „einen wirklich bahnbrechenden Ansatz“.
In einer Überprüfung aus dem Jahr 2015 wurde festgestellt, dass Sacubitril/Valsartan „einen Fortschritt in der chronischen Behandlung der Herzinsuffizienz mit reduzierter Auswurffraktion“ darstellt, dass jedoch ein weit verbreiteter klinischer Erfolg mit dem Medikament eine sorgfältige Anwendung bei geeigneten Patienten erfordert, insbesondere bei solchen mit ähnlichen Eigenschaften in der klinischen Studienpopulation. Eine weitere Überprüfung aus dem Jahr 2015 bezeichnete die durch Sacubitril/Valsartan bewirkte Verringerung der Sterblichkeit und Krankenhausaufenthalte als „auffällig“, stellte jedoch fest, dass die Auswirkungen auf Menschen mit Herzinsuffizienz mit Bluthochdruck, Diabetes, chronischer Nierenerkrankung und älteren Menschen weiter evaluiert werden müssten.
Wirtschaft
Die Großhandelskosten für den National Health Service (NHS) im Vereinigten Königreich betragen ab 2017 ca. 1.200 GB pro Person und Jahr. Die Großhandelskosten in den Vereinigten Staaten betragen ab 2015 4.560 USD pro Jahr. Generika ähnlicher Klasse ohne Sacubitril, wie Valsartan allein kostet ungefähr 48 US-Dollar pro Jahr. Eine von der Industrie finanzierte Analyse ergab Kosten von 45.017 US-Dollar pro qualitätsbereinigtem Lebensjahr (QALY).
Forschung
Die PARADIGM-HF-Studie (in der Milton Packer einer der Hauptprüfer war) verglich die Behandlung mit Sacubitril/Valsartan mit der Behandlung mit Enalapril . Patienten mit Herzinsuffizienz und reduzierter LVEF (10.513) wurden kurzzeitig nacheinander mit Enalapril und dann mit Sacubitril/Valsartan behandelt. Diejenigen, die beide Behandlungsregime vertragen (8442, 80 %) wurden randomisiert einer Langzeitbehandlung mit Enalapril oder Sacubitril/Valsartan zugeteilt. Die Teilnehmer waren hauptsächlich weiß (66%), männlich (78%), mittleren Alters (Median 63,8 ± 11 Jahre) mit NYHA-Stadium II (71,6%) oder Stadium III (23,1%) Herzinsuffizienz.
Die Studie wurde vorzeitig abgebrochen, nachdem eine vorab festgelegte Zwischenanalyse eine Verringerung des primären Endpunkts kardiovaskulärer Tod oder Herzinsuffizienz in der Sacubitril/Valsartan-Gruppe im Vergleich zu den mit Enalapril behandelten Patienten ergab. Einzeln betrachtet behielten die Verringerungen der kardiovaskulären Todesfälle und der Krankenhauseinweisungen aufgrund von Herzinsuffizienz statistische Signifikanz. Im Vergleich zu Enalapril führte Sacubitril/Valsartan zu einer Verringerung der
- der kombinierte Endpunkt kardiovaskulärer Tod oder Krankenhausaufenthalt wegen Herzinsuffizienz (Inzidenz 21,8% vs. 26,5%)
- kardiovaskulärer Tod (Inzidenz 13,3% vs. 16,5%)
- erster Krankenhausaufenthalt wegen Verschlechterung der Herzinsuffizienz (Inzidenz 12,8% vs. 15,6%) und
- Gesamtmortalität (Inzidenz 17,0 % vs. 19,8 %)
Zu den Einschränkungen der Studie zählen kaum Erfahrungen mit Therapiebeginn bei hospitalisierten Patienten und bei Patienten mit NYHA-Herzinsuffizienz-Klasse-IV-Symptomen. Darüber hinaus verglich die Studie eine maximale Dosis von Valsartan (plus Sacubitril) mit einer submaximalen Dosis von Enalapril und war daher nicht direkt mit der aktuellen Goldstandard-Anwendung von ACE-Hemmern bei Herzinsuffizienz vergleichbar, was die Validität der Studienergebnisse verringert.
Verweise
Weiterlesen
- AusPAR für Sacubitril/Valsartan-Salzkomplex (PDF) (Bericht). Heilmittelverwaltung (TGA). September 2016.
Externe Links
- "Sacubitril-Mischung mit Valsartan" . Informationsportal für Arzneimittel . US-amerikanische Nationalbibliothek für Medizin.
