Spinale Muskelatrophie - Spinal muscular atrophy
| Spinale Muskelatrophie | |
|---|---|
| Andere Namen | Autosomal-rezessive proximale spinale Muskelatrophie, 5q spinale Muskelatrophie |
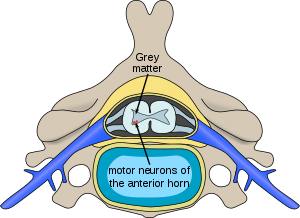 | |
| Lage von Neuronen, die von spinaler Muskelatrophie im Rückenmark betroffen sind | |
| Spezialität | Neurologie |
| Symptome | Progressive Muskelschwäche |
| Komplikationen | Skoliose , Gelenkkontrakturen , Lungenentzündung |
| Typen | Typ 0 bis Typ 4 |
| Ursachen | Mutation in SMN1 |
| Diagnosemethode | Gentest |
| Differenzialdiagnose | Angeborene Muskeldystrophie , Duchenne-Muskeldystrophie , Prader-Willi-Syndrom |
| Behandlung | Unterstützende Pflege , Medikamente |
| Medikation | Nusinersen , onasemnogene abeparvovec , Risdiplam |
| Prognose | Variiert je nach Typ |
| Frequenz | 1 von 10.000 Menschen |
Spinale Muskelatrophie ( SMA ) ist eine seltene neuromuskuläre Erkrankung , die zum Verlust von Motoneuronen und fortschreitendem Muskelschwund führt . Es wird normalerweise im Säuglings- oder Kleinkindalter diagnostiziert und ist unbehandelt die häufigste genetische Ursache für den Säuglingstod. Es kann auch später im Leben auftreten und dann einen milderen Krankheitsverlauf haben. Gemeinsames Merkmal ist eine fortschreitende Schwäche der willkürlichen Muskulatur, wobei zuerst die Arm-, Bein- und Atemmuskulatur betroffen ist. Damit verbundene Probleme können eine schlechte Kopfkontrolle, Schluckbeschwerden, Skoliose und Gelenkkontrakturen sein .
Das Alter des Auftretens und die Schwere der Symptome bilden die Grundlage für die traditionelle Einteilung der spinalen Muskelatrophie in eine Reihe von Typen.
Spinale Muskelatrophie ist aufgrund einer Anomalie ( Mutation ) im SMN1 - Gen kodiert , das SMN , ein Protein , notwendig für das Überleben von motorischen Neuronen . Der Verlust dieser Neuronen im Rückenmark verhindert die Signalübertragung zwischen Gehirn und Skelettmuskulatur . Ein anderes Gen, SMN2 , wird als krankheitsmodifizierendes Gen angesehen, da normalerweise der Krankheitsverlauf umso milder ist, je mehr SMN2 kopiert wird. Die Diagnose von SMA basiert auf Symptomen und wird durch Gentests bestätigt .
Üblicherweise wird die Mutation im SMN1 wird Gen geerbt von beiden Eltern in einer autosomal rezessiven Art und Weise, obwohl in etwa 2% der Fälle während tritt frühe Entwicklung ( de novo ). Die Inzidenz von spinaler Muskelatrophie variiert weltweit von etwa 1 von 4.000 Geburten bis zu etwa 1 von 16.000 Geburten, wobei 1 von 7.000 bzw. 1 von 10.000 für Europa bzw. die USA häufig genannt wird.
Die Ergebnisse im natürlichen Krankheitsverlauf variieren vom Tod innerhalb weniger Wochen nach der Geburt in den akutesten Fällen bis zur normalen Lebenserwartung bei den protrahierten SMA-Formen. Die Einführung ursächlicher Behandlungen im Jahr 2016 hat die Ergebnisse deutlich verbessert. Medikamente, die auf die genetische Ursache der Krankheit abzielen , sind Nusinersen , Risdiplam und das Gentherapie- Medikament Onasemnogen abeparvovec . Die unterstützende Versorgung umfasst Physiotherapie , Ergotherapie, Atemunterstützung, Ernährungsunterstützung, orthopädische Eingriffe und Mobilitätsunterstützung .
Einstufung
5q SMA ist eine einzelne Krankheit, die sich über einen weiten Schweregrad hinweg manifestiert und sowohl Säuglinge als auch Erwachsene betrifft. Bevor seine Genetik verstanden wurde, wurden seine unterschiedlichen Manifestationen als verschiedene Krankheiten angesehen – Werdnig-Hoffmann-Krankheit, wenn kleine Kinder betroffen waren, und Kugelberg-Welander-Krankheit für spät auftretende Fälle.
1990 wurde erkannt, dass diese getrennten Krankheiten ein Spektrum derselben Störung bilden. Die spinale Muskelatrophie wurde dann in 3–5 klinische Typen eingeteilt, entweder basierend auf dem Alter des Symptombeginns oder der maximal erreichten motorischen Funktion. Derzeit besteht Konsens, dass der Phänotyp der spinalen Muskelatrophie ein Kontinuum von Symptomen ohne klare Abgrenzung der Subtypen umfasst. Die traditionelle Klassifikation, die in der folgenden Tabelle skizziert wird, wird jedoch auch heute noch sowohl in der klinischen Forschung als auch manchmal kontrovers als Kriterium für den Zugang zu Therapien verwendet.
| Typ | Namensgeber | Übliches Erkrankungsalter | Naturgeschichte (ohne pharmakologische Behandlung) | OMIM |
|---|---|---|---|---|
| SMA 0 | Pränatal | Die Symptome werden bei der Geburt beobachtet und zeigen sich oft in der pränatalen Phase als verminderte fetale Bewegung. Betroffene Kinder haben typischerweise nur eine einzige Kopie des SMN2- Gens und überleben in der Regel auch mit 24/7-Atemunterstützung nur wenige Wochen. Diese Form ist sehr selten – macht ca. 2% der Fälle. | ||
|
SMA 1 (Infantil) |
Werdnig-Hoffmann-Krankheit | 0–6 Monate | Diese Form wird bei etwa 50 % der Patienten diagnostiziert, bei denen sich die Erkrankung in den ersten Lebenswochen oder -monaten manifestiert. SMA setzt dann schnell und unerwartet ein, wobei verschiedene Muskelgruppen nach und nach versagen. Säuglinge lernen nie, ohne Unterstützung zu sitzen und verlieren nach und nach den größten Teil ihrer Muskelfunktion. Der Tod wird in der Regel durch das Versagen der Atemmuskulatur durch eine Lungenentzündung (häufig Aspirationspneumonie ) verursacht. Wenn nicht frühzeitig eine Atemunterstützung und/oder eine pharmakologische Behandlung angeboten wird, überleben Babys, bei denen SMA Typ 1 diagnostiziert wurde, im Allgemeinen nicht mehr als zwei Jahre. Bei entsprechender Atemunterstützung überleben diejenigen mit milderen SMA-Typ-1-Phänotypen, die etwa 10 % der SMA-1-Fälle ausmachen, auch ohne pharmakologische Behandlung bis ins Jugend- und Erwachsenenalter, obwohl sie immer rund um die Uhr betreut werden müssen. | 253300 |
|
SMA 2 (Mittelstufe) |
Dubowitz-Krankheit | 6–18 Monate | Die bei etwa 20 % der Patienten diagnostizierte Zwischenform bezeichnet Menschen, die zumindest einige Zeit ihres Lebens eine sitzende Position beibehalten konnten, aber nie das selbstständige Gehen gelernt haben. Der Beginn der Schwäche wird normalerweise zwischen dem 6. und 18. Lebensmonat bemerkt. Die Fortschritte sind bekanntlich sehr unterschiedlich, manche Menschen werden im Laufe der Zeit allmählich schwächer, während andere durch sorgfältige Pflege relativ stabil bleiben. Die Körpermuskulatur ist geschwächt und das Atmungssystem ist ein großes Problem, ebenso wie Muskelkontrakturen und Wirbelsäulenverkrümmungen. Die Lebenserwartung ist reduziert, auch wenn die meisten Menschen mit SMA 2 auch ohne Behandlung bis ins Erwachsenenalter leben. | 253550 |
|
SMA 3 (Jugend) |
Kugelberg-Welander-Krankheit | >12 Monate | Die juvenile Form, die bei etwa 30% der Patienten diagnostiziert wird, manifestiert sich nach dem 12. Lebensmonat oder nachdem die Kinder bereits gelernt haben, zumindest einige selbstständige Schritte zu machen. Die Krankheit schreitet langsam voran und die meisten Menschen mit SMA 3 verlieren irgendwann in ihrem Leben die Gehfähigkeit und benötigen Mobilitätsunterstützung. Eine Beteiligung der Atemwege ist selten und die Lebenserwartung ist normal oder nahezu normal. | 253400 |
|
SMA 4 (Erwachsener Beginn) |
Erwachsensein | Dies bezeichnet die adult-onset Form, manchmal auch als spät-onset SMA Typ 3 klassifiziert. 5% der Patienten und manifestiert sich in der Regel in der dritten oder vierten Lebensdekade. Die Symptome bestehen in einer schleichenden Schwächung der Beinmuskulatur, die häufig den Einsatz von Gehhilfen erforderlich macht. Andere Komplikationen sind selten und die Lebenserwartung bleibt unberührt. | 271150 |
Der Einfachheit halber klassifizieren pflegefokussierte Publikationen Patienten basierend auf ihrem tatsächlichen Funktionsstatus in "Nicht-Sitter", "Sitter" und "Walker".
Die motorische Entwicklung und das Fortschreiten der Krankheit bei Menschen mit SMA werden normalerweise anhand validierter Funktionsskalen beurteilt – CHOP-INTEND (The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders) oder HINE (Hammersmith Infant Neurological Examination) bei Säuglingen; und entweder das MFM (Motor Function Measure) oder eine von mehreren Varianten des HFMS (Hammersmith Functional Motor Scale) bei älteren Patienten.
Die namensgebende Bezeichnung Werdnig-Hoffmann-Krankheit (manchmal mit einem einzelnen n falsch geschrieben ) bezieht sich auf die frühesten klinischen Beschreibungen der SMA bei Kindern durch Johann Hoffmann und Guido Werdnig . Der namensgebende Begriff Kugelberg-Welander-Krankheit geht auf Erik Klas Hendrik Kugelberg (1913–1983) und Lisa Welander (1909–2001) zurück, die die spät einsetzende Form erstmals dokumentiert und von der Muskeldystrophie unterschieden haben. Die sehr selten verwendete Dubowitz-Krankheit (nicht zu verwechseln mit dem Dubowitz-Syndrom ) ist nach Victor Dubowitz benannt , einem englischen Neurologen, der mehrere Studien zum intermediären SMA-Phänotyp verfasst hat.
Anzeichen und Symptome
Die Symptome variieren je nach SMA-Typ, Krankheitsstadium sowie individuellen Faktoren. Die folgenden Anzeichen und Symptome treten am häufigsten bei der schweren SMA Typ 0/I auf:
- Areflexie , insbesondere in den Extremitäten
- Insgesamt Muskelschwäche , schlechte Muskeltonus zu, Schlaffheit oder eine Tendenz zu Flop
- Schwierigkeiten beim Erreichen von Entwicklungsmeilensteinen, Schwierigkeiten beim Sitzen/Steh/Gehen
- Bei Kleinkindern: Einnehmen einer Froschschenkelposition im Sitzen (Hüfte abduziert und Knie gebeugt)
- Der Verlust der Stärke der Atemmuskulatur: schwach Husten , schwacher Schrei (Kleinkinder), Anhäufung von Sekret in der Lunge oder des Rachens, Atemnot
- Glockenförmiger Torso (verursacht durch die ausschließliche Verwendung der Bauchmuskeln zur Atmung) bei schwerem SMA-Typ
- Faszikulationen (Zucken) der Zunge
- Schwierigkeiten beim Saugen oder Schlucken, schlechte Nahrungsaufnahme
Ursachen
Die spinale Muskelatrophie wird durch eine genetische Mutation im SMN1- Gen verursacht .
Menschliche Chromosom 5 enthält zwei nahezu identische Gene an Ort 5q13: eine Telomer Kopie SMN1 und eine Zentromer Kopie SMN2 . Bei gesunden Menschen kodiert das SMN1- Gen das Überleben des Motoneuron- Proteins (SMN), das, wie der Name schon sagt, eine entscheidende Rolle für das Überleben von Motoneuronen spielt . Das SMN2- Gen hingegen unterliegt – aufgrund einer Variation in einem einzelnen Nukleotid (840.C→T) – einem alternativen Spleißen an der Verbindungsstelle von Intron 6 zu Exon 8, wobei nur 10–20% der SMN2- Transkripte ein vollständig funktionelles Überleben des Motoneuron- Proteins (SMN-fl) und 80–90% der Transkripte, was zu einer verkürzten Proteinverbindung (SMNΔ7) führt, die in der Zelle schnell abgebaut wird.
Bei SMA-Betroffenen ist das SMN1- Gen so mutiert , dass es das SMN-Protein nicht richtig codieren kann – entweder aufgrund einer Deletion am Exon 7 oder anderer Punktmutationen (häufig zur funktionellen Umwandlung des SMN1 Sequenz in SMN2 ). Fast alle Menschen haben jedoch mindestens eine funktionelle Kopie des SMN2- Gens (die meisten haben 2–4 davon), die immer noch 10–20% der üblichen Menge des SMN-Proteins kodiert, wodurch einige Neuronen überleben können. Langfristig führt die reduzierte Verfügbarkeit des SMN-Proteins jedoch zum allmählichen Absterben von Motoneuron-Zellen im Vorderhorn des Rückenmarks und des Gehirns. Skelettmuskeln , die alle von diesen Motoneuronen für neuralen Input abhängig sind, haben jetzt eine verminderte Innervation (auch Denervation genannt ) und haben daher eine verminderte Eingabe vom Zentralnervensystem (ZNS). Eine verminderte Impulsübertragung durch die Motoneuronen führt zu einer verminderten kontraktilen Aktivität des denervierten Muskels. Folglich erleiden denervierte Muskeln eine fortschreitende Atrophie (waste away).
Meist sind zuerst die Muskeln der unteren Extremitäten betroffen, gefolgt von den Muskeln der oberen Extremitäten, der Wirbelsäule und des Nackens und in schwereren Fällen die Lungen- und Kaumuskulatur. Die proximale Muskulatur ist immer früher und stärker betroffen als die distale Muskulatur.
Die Schwere der SMA-Symptome hängt weitgehend damit zusammen, wie gut die verbleibenden SMN2- Gene den Funktionsverlust von SMN1 ausgleichen können . Dies hängt teilweise von der Anzahl der Kopien des SMN2- Gens ab, die auf dem Chromosom vorhanden sind. Während gesunde Personen normalerweise zwei SMN2- Genkopien tragen , können Menschen mit SMA zwischen 1 und 5 (oder mehr) davon haben; je höher die Zahl der SMN2- Kopien, desto milder der Schweregrad der Erkrankung. Somit haben die meisten SMA-Typ-I-Babys eine oder zwei SMN2- Kopien; Menschen mit SMA II und III haben normalerweise mindestens drei SMN2- Kopien; und Menschen mit SMA IV haben normalerweise mindestens vier davon. Die Korrelation zwischen Symptomschwere und SMN2- Kopienzahl ist jedoch nicht absolut und es scheinen andere Faktoren zu existieren, die den Krankheitsphänotyp beeinflussen.
Die spinale Muskelatrophie wird autosomal-rezessiv vererbt, das heißt, das defekte Gen befindet sich auf einem Autosom . Zwei Kopien des defekten Gens – eine von jedem Elternteil – sind erforderlich, um die Störung zu erben: Die Eltern können Träger sein und nicht persönlich betroffen sein. SMA scheint in etwa 2–4% der Fälle de novo (dh ohne erbliche Ursachen) aufzutreten .
Spinale Muskelatrophie betrifft Individuen aller ethnischen Gruppen, im Gegensatz zu anderen bekannten autosomal-rezessiven Erkrankungen wie Sichelzellenanämie und Mukoviszidose , die signifikante Unterschiede in der Häufigkeit zwischen den ethnischen Gruppen aufweisen. Die Gesamtprävalenz von SMA, alle Arten und in allen ethnischen Gruppen, im Bereich von 1 pro 10.000 Personen; die Genhäufigkeit liegt bei 1:100, damit ist etwa jeder 50. Mensch Träger. Als Träger sind keine gesundheitlichen Folgen bekannt. Eine Person kann nur dann den Trägerstatus erfahren, wenn das eigene Kind von SMA betroffen ist oder das SMN1- Gen sequenziert wurde.
Betroffene Geschwister haben meist eine sehr ähnliche Form von SMA. Es gibt jedoch Vorkommen unterschiedlicher SMA-Typen bei Geschwistern – obwohl diese Fälle selten sind, können diese Fälle auf zusätzliche De-novo- Deletionen des SMN- Gens ohne Beteiligung des NAIP- Gens oder die Unterschiede in den SMN2- Kopienzahlen zurückzuführen sein.
Diagnose
SMA wird durch Gentests diagnostiziert, die in über 95 % der Fälle eine homozygote Deletion des SMN1- Gens und bei den übrigen Patienten eine zusammengesetzte SMN1- Mutation nachweisen. Gentests werden in der Regel mit einer Blutprobe durchgeführt, und MLPA ist eine der am häufigsten verwendeten genetischen Testverfahren, da sie auch die Anzahl der SMN2- Genkopien bestimmen kann , die von klinischer Bedeutung sind.
Symptomatisch kann eine SMA mit einer gewissen Sicherheit nur bei Kindern mit akuter Form diagnostiziert werden, die eine fortschreitende Erkrankung mit paradoxer Atmung , beidseitig niedrigem Muskeltonus und fehlenden Sehnenreflexen zeigen.
Früherkennung
Die frühzeitige Diagnose von SMA im asymptomatischen Stadium der Krankheit ermöglicht
Präimplantationstests
Die genetische Präimplantationsdiagnostik kann verwendet werden, um während der In-vitro-Fertilisation nach SMA-befallenen Embryonen zu suchen .
Pränataldiagnostik
Pränatale Tests auf SMA sind durch Chorionzottenbiopsie , zellfreie fetale DNA- Analyse und andere Methoden möglich.
Neugeborenenscreening
Routinemäßiges Neugeborenen-Screening auf SMA wird in Industrieländern immer häufiger, da ursächliche Behandlungen verfügbar sind, die im asymptomatischen Stadium der Krankheit am wirksamsten sind. 2018 wurde das Neugeborenen-Screening auf SMA in die US-Liste der empfohlenen Neugeborenen-Screening-Tests aufgenommen und seit April 2020 in 39 US-Bundesstaaten eingeführt. Seit Mai 2021 ist das SMA-Neugeborenenscreening in Taiwan implementiert und befindet sich in Australien, Belgien, Kanada, Frankreich, Deutschland, Niederlande, Polen, Serbien und Slowenien in der Umsetzung. Darüber hinaus werden Pilotprojekte in Australien, China, Italien und Japan durchgeführt.
Carrier-Tests
Diejenigen, bei denen das Risiko besteht, Träger einer SMN1- Deletion zu sein und somit das Risiko haben, dass Nachkommen von SMA betroffen sind, können sich einer Trägeranalyse mit einer Blut- oder Speichelprobe unterziehen. Das American College of Obstetricians and Gynecologists empfiehlt allen Menschen, die an eine Schwangerschaft denken, sich auf ihre Trägerschaft testen zu lassen. Die Trägerfrequenz von SMA ist vergleichbar mit anderen Erkrankungen wie Thalassämie und wurde in einer nordindischen Kohorte mit 1 zu 38 festgestellt. Gentests werden jedoch nicht in der Lage sein, alle gefährdeten Personen zu identifizieren, da etwa 2% der Fälle verursacht werden durch de novo-Mutationen und 5% der normalen Bevölkerung haben zwei Kopien von SMN1 auf demselben Chromosom, was es ermöglicht, Träger zu sein, indem ein Chromosom mit zwei Kopien und ein zweites Chromosom mit null Kopien vorhanden ist. Diese Situation führt zu einem falsch negativen Ergebnis, da der Trägerstatus durch einen herkömmlichen Gentest nicht korrekt erkannt wird.
Verwaltung
Die Behandlung von SMA variiert je nach Schweregrad und Art. Bei den schwersten Formen (Typen 0/1) haben die Individuen die größte Muskelschwäche, die ein sofortiges Eingreifen erfordert. Während die leichteste Form (Typ 4/Erwachsener Beginn) die einzelnen Aspekte der Pflege möglicherweise erst später (Jahrzehnte) im Leben in Anspruch nimmt. Während sich die Arten von SMA und die einzelnen Personen bei jedem Typ unterscheiden können, können sich daher spezifische Aspekte der Pflege einer Person unterscheiden.
Medikation
Nusinersen (vermarktet als Spinraza) wird zur Behandlung von spinaler Muskelatrophie angewendet. Es ist ein Antisense-Nukleotid, das das alternative Spleißen des SMN2- Gens modifiziert . Es wird dem Zentralnervensystem durch eine intrathekale Injektion direkt verabreicht . Nusinersen verlängert das Überleben und verbessert die motorische Funktion bei Säuglingen mit SMA. Es wurde 2016 in den USA und 2017 in der EU zugelassen.
Onasemnogene abeparvovec (vermarktet als Zolgensma) ist eine gentherapeutische Behandlung, die das selbstkomplementäre adeno-assoziierte Virus Typ 9 (scAAV-9) als Vektor verwendet, um das SMN1- Transgen zu transportieren. Die Therapie wurde erstmals im Mai 2019 in den USA als intravenöse Formulierung für Kinder unter 24 Monaten zugelassen. Es folgten Zulassungen in der Europäischen Union, Japan und anderen Ländern, wenn auch oft mit unterschiedlichen Zulassungsbereichen.
Risdiplam (vermarktet als Evrysdi) ist ein Medikament, das in flüssiger Form oral eingenommen wird . Es ist ein Pyridazin - Derivat , das funktioniert , indem die Menge an funktionellem Erhöhung Überlebende Motoneuron - Protein durch das erzeugte SMN2 Gen durch seine Spleißmusters modifizierende . Risdiplam wurde erstmals im August 2020 in den USA für die medizinische Anwendung zugelassen und ist seitdem in über 30 Ländern zugelassen.
Atmung
Das Atmungssystem ist das am häufigsten betroffene System und die Komplikationen sind die häufigste Todesursache bei SMA Typ 0/1 und 2. SMA Typ 3 kann ähnliche Atemprobleme haben, ist aber seltener. Die Komplikationen, die aufgrund einer geschwächten Interkostalmuskulatur aufgrund der fehlenden Stimulation durch den Nerv entstehen. Das Zwerchfell ist weniger betroffen als die Interkostalmuskulatur. Wenn die Muskeln einmal geschwächt sind, erlangen sie nie mehr die gleiche funktionelle Kapazität zurück, um beim Atmen und Husten sowie bei anderen Funktionen zu helfen. Daher ist das Atmen schwieriger und birgt das Risiko einer unzureichenden Sauerstoffaufnahme/flachen Atmung und einer unzureichenden Beseitigung von Atemwegssekreten. Diese Probleme treten häufiger im Schlaf auf, wenn die Muskeln entspannter sind. Schluckmuskulatur im Rachenraum kann betroffen sein, was zu Aspiration führt, verbunden mit einem schlechten Hustenmechanismus, erhöht die Wahrscheinlichkeit einer Infektion/ Pneumonie . Die Mobilisierung und Klärung von Sekreten umfasst eine manuelle oder mechanische Thorax-Physiotherapie mit Haltungsdrainage und ein manuelles oder mechanisches Gerät zur Hustenunterstützung. Um die Atmung zu unterstützen, wird häufig nicht-invasive Beatmung ( BiPAP ) verwendet, und in schwereren Fällen kann manchmal eine Tracheostomie durchgeführt werden; beide Beatmungsmethoden verlängern das Überleben in vergleichbarem Maße, obwohl die Tracheostomie die Sprachentwicklung verhindert.
Ernährung
Je schwerer die Art der SMA ist, desto wahrscheinlicher sind ernährungsbedingte Gesundheitsprobleme. Gesundheitsprobleme können Schwierigkeiten beim Füttern, Öffnen des Kiefers, Kauen und Schlucken umfassen. Personen mit solchen Schwierigkeiten können einem erhöhten Risiko für Über- oder Unterernährung, Gedeihstörung und Aspiration ausgesetzt sein. Andere Ernährungsprobleme, insbesondere bei Personen, die nicht gehfähig sind (schwerere Arten von SMA), umfassen Nahrung, die den Magen nicht schnell genug passiert, Magenreflux, Verstopfung, Erbrechen und Blähungen. Dabei könnte es bei SMA Typ I und Menschen mit schwererem Typ II notwendig sein, eine Ernährungssonde oder Gastrostomie zu haben . Darüber hinaus beeinträchtigen metabolische Anomalien, die aus SMA resultieren, die β-Oxidation von Fettsäuren in den Muskeln und können zu organischer Azidämie und daraus resultierenden Muskelschäden führen, insbesondere beim Fasten. Es wird vorgeschlagen , dass Menschen mit SMA, insbesondere solche mit schwereren Formen der Erkrankung, die Aufnahme von reduzieren Fett und vermeiden Sie längeres Fasten (dh essen häufiger als gesunde Menschen) sowie weichere Lebensmittel zu vermeiden Streben wählen. Während einer akuten Erkrankung, insbesondere bei Kindern, können Ernährungsprobleme zunächst ein bestehendes Problem darstellen oder verstärken (Beispiel: Aspiration) sowie andere gesundheitliche Probleme wie Elektrolyt- und Blutzuckerstörungen verursachen.
Orthopädie
Skelettprobleme im Zusammenhang mit schwachen Muskeln bei SMA umfassen verspannte Gelenke mit eingeschränktem Bewegungsumfang, Hüftluxationen, Wirbelsäulendeformitäten, Osteopenie, ein erhöhtes Risiko für Frakturen und Schmerzen. Schwache Muskeln, die normalerweise Gelenke wie die Wirbelsäule stabilisieren, führen zur Entwicklung von Kyphose und/oder Skoliose und Gelenkkontrakturen. Bei Patienten mit SMA I/II im Alter von 8–10 Jahren wird manchmal eine Wirbelsäulenfusion durchgeführt, um den Druck einer deformierten Wirbelsäule auf die Lunge zu entlasten. Darüber hinaus können immobile Personen, Haltung und Position auf Mobilitätsgeräten sowie Bewegungsübungen und die Stärkung der Knochen wichtig sein, um Komplikationen zu vermeiden. Menschen mit SMA können auch von verschiedenen Formen der Physiotherapie , Ergotherapie und Physiotherapie stark profitieren .
Orthesen können verwendet werden, um den Körper zu stützen und das Gehen zu unterstützen. Orthesen wie AFOs (Knöchel-Fuß-Orthesen) werden beispielsweise zur Stabilisierung des Fußes und zur Unterstützung des Ganges verwendet, TLSOs (Thoracic-Lumbal-Sacral-Orthesen) zur Stabilisierung des Rumpfes. Assistive Technologien können bei der Steuerung von Bewegung und täglichen Aktivitäten helfen und die Lebensqualität erheblich steigern.
Sonstiges
Obwohl das Herz kein routinemäßiges Problem darstellt, wurde ein Zusammenhang zwischen SMA und bestimmten Herzerkrankungen vorgeschlagen.
Kinder mit SMA unterscheiden sich in ihrem Verhalten nicht von der Allgemeinbevölkerung; ihre kognitive Entwicklung kann etwas schneller sein und bestimmte Aspekte ihrer Intelligenz liegen über dem Durchschnitt. Trotz ihrer Behinderung berichten SMA-Betroffene von einer hohen Lebenszufriedenheit.
Die Palliativversorgung bei SMA wurde im Consensus Statement for Standard of Care in Spinal Muscular Atrophy standardisiert, das weltweit zur Standardanwendung empfohlen wurde.
Prognose
Ohne pharmakologische Behandlung neigen Menschen mit SMA dazu, sich im Laufe der Zeit zu verschlechtern. In letzter Zeit hat sich die Überlebensrate bei Patienten mit schwerer SMA mit aggressiver und proaktiver unterstützender Atem- und Ernährungsunterstützung erhöht.
Unbehandelt erreichen die meisten Kinder, bei denen SMA Typ 0 und 1 diagnostiziert wurde, nicht das Alter von 4 Jahren, wobei wiederkehrende Atemwegsprobleme die Haupttodesursache sind. Bei entsprechender Pflege leben leichtere SMA-Typ-I-Fälle (die ca. 10 % aller SMA1-Fälle ausmachen) bis ins Erwachsenenalter. Das Langzeitüberleben bei SMA Typ I ist nicht ausreichend belegt; ab 2007 scheinen jedoch Fortschritte bei der Atemunterstützung die Sterblichkeitsrate gesenkt zu haben.
Bei unbehandelter SMA Typ II verläuft der Krankheitsverlauf langsamer und die Lebenserwartung ist geringer als bei der gesunden Bevölkerung. Todesfälle vor dem 20. Lebensjahr sind häufig, obwohl viele Menschen mit SMA leben, um Eltern und Großeltern zu werden. SMA Typ III hat eine normale oder nahezu normale Lebenserwartung, wenn die Pflegestandards eingehalten werden. Typ IV, SMA im Erwachsenenalter bedeutet in der Regel nur eine Mobilitätseinschränkung und hat keinen Einfluss auf die Lebenserwartung.
Forschungsrichtungen
Seit der Identifizierung der zugrunde liegenden genetischen Ursache von SMA im Jahr 1995 wurden mehrere therapeutische Ansätze vorgeschlagen und untersucht, die sich hauptsächlich auf die Erhöhung der Verfügbarkeit von SMN-Protein in Motoneuronen konzentrieren. Die Hauptforschungsrichtungen waren wie folgt:
SMN1 gene replacement
Die Gentherapie bei SMA zielt auf die Wiederherstellung der SMN1- Genfunktion durch das Einfügen einer speziell hergestellten Nukleotidsequenz (ein SMN1- Transgen ) in den Zellkern unter Verwendung eines viralen Vektors . Dieser Ansatz wurde von der ersten zugelassenen Gentherapie für SMA, der scAAV- 9-basierten Behandlung auf dem Asemnogen Abeparvovec, genutzt.
SMN2 alternative Spleißmodulation
Dieser Ansatz zielt darauf ab, das alternative Spleißen des SMN2- Gens zu modifizieren , um es zu zwingen, für einen höheren Prozentsatz des SMN-Proteins voller Länge zu kodieren. Manchmal wird es auch Genkonversion genannt, weil es versucht, das SMN2- Gen funktionell in das SMN1- Gen umzuwandeln . Es ist der therapeutische Mechanismus der zugelassenen Medikamente Nusinersen und Risdiplam.
Branaplam ist ein weiterer SMN2-Spleißmodulator , der das klinische Entwicklungsstadium erreicht hat.
Historisch betrachtet hat diese Forschungsrichtung auch andere Moleküle untersucht. RG3039, auch bekannt als Chinazolin495, war ein proprietäres Chinazolin- Derivat, das von Repligen entwickelt und im März 2014 an Pfizer lizenziert wurde, das kurz darauf eingestellt wurde und nur Phase-I-Studien abgeschlossen hatte. PTK-SMA1 war ein proprietärer niedermolekularer Splicing-Modulator der Tetracycline- Gruppe, der von Paratek Pharmaceuticals entwickelt wurde und 2010 in die klinische Entwicklung eintreten sollte, was jedoch nie geschah. RG7800, entwickelt von Hoffmann-La Roche, war ein Risdiplam-ähnliches Molekül, das Phase-I-Tests unterzogen wurde, aber aufgrund von Tiertoxizität eingestellt wurde. Frühe Hinweise umfassten auch Natriumorthovanadat und Aclarubicin .
Antisense-Oligonukleotide vom Morpholino- Typ mit dem gleichen zellulären Ziel wie Nusinersen bleiben Gegenstand der Forschung bei der Behandlung von SMA und anderen Einzelgen-Erkrankungen, unter anderem am University College London und an der University of Oxford .
SMN2- Genaktivierung
Dieser Ansatz zielt darauf ab, die Expression (Aktivität) des SMN2- Gens zu erhöhen , wodurch die Menge an verfügbarem SMN-Protein in voller Länge erhöht wird.
- Oral Salbutamol (Albuterol), eine beliebtes Asthma Medizin, zeigte therapeutisches Potenzial bei SMA sowohl in vitro und in drei kleinen klinischen Studien Patienten mit SMA Typ 2 und 3, bietet neben Atem Vorteile beteiligt ist .
Einige wenige Verbindungen waren anfangs vielversprechend, zeigten jedoch in klinischen Studien keine Wirksamkeit. Butyrate ( Natriumbutyrat und Natriumphenylbutyrat ) gehalten einige Versprechen in In - vitro - Studien , aber eine klinische Studie bei symptomatischen Menschen ihre Wirksamkeit nicht bestätigen. Eine weitere klinische Studie mit präsymptomatischen Säuglingen vom Typ 1–2 wurde 2015 abgeschlossen, es wurden jedoch keine Ergebnisse veröffentlicht.
- Valproinsäure (VPA) wurde in den 1990er und 2000er Jahren experimentell bei SMA eingesetzt, da in-vitro- Forschungen auf ihre mäßige Wirksamkeit hinwiesen. Es zeigte jedoch keine Wirksamkeit in erreichbaren Konzentrationen, wenn es einer großen klinischen Studie unterzogen wurde. Es wurde auch vorgeschlagen, dass es bei einer Untergruppe von Menschen mit SMA wirksam sein kann, aber seine Wirkung kann bei anderen durch die Fettsäure-Translokase unterdrückt werden . Andere argumentieren, dass es die SMA-Symptome tatsächlich verschlimmern kann. Es wird derzeit aufgrund des Risikos schwerer Nebenwirkungen im Zusammenhang mit der Langzeitanwendung nicht verwendet. Eine Metaanalyse aus dem Jahr 2019 deutete darauf hin, dass VPA auch ohne Verbesserung des funktionellen Scores Vorteile bieten kann.
- Hydroxycarbamid (Hydroxyharnstoff) erwies sich in Mausmodellen als wirksam und wurde anschließend von Novo Nordisk , Dänemark, kommerziell erforscht , zeigte jedoch in nachfolgenden klinischen Studien keine Wirkung auf Menschen mit SMA.
Zu den Verbindungen, die die SMN2- Aktivität in vitro steigerten , aber nicht in das klinische Stadium gelangten, gehören Wachstumshormon , verschiedene Histon-Deacetylase-Hemmer , Benzamid M344, Hydroxamsäuren (CBHA, SBHA, Entinostat , Panobinostat , Trichostatin A , Vorinostat ), Prolaktin sowie natürliche Polyphenolverbindungen wie Resveratrol und Curcumin . Celecoxib , ein Aktivator des p38-Signalwegs , wird manchmal von Menschen mit SMA off-label verwendet, basierend auf einer einzigen Tierstudie, aber eine solche Verwendung wird nicht durch klinische Forschung unterstützt.
SMN-Stabilisierung
Die SMN-Stabilisierung zielt darauf ab, das SMNΔ7-Protein, das kurzlebige defekte Protein, das vom SMN2- Gen kodiert wird, so zu stabilisieren , dass es in der Lage ist, neuronale Zellen zu erhalten.
Es wurden keine Verbindungen in die klinische Phase überführt. Aminoglykoside zeigten in zwei Studien die Fähigkeit, die Verfügbarkeit von SMN-Protein zu erhöhen. Indoprofen bot einige Versprechen in vitro .
Neuroprotektion
Neuroprotektive Medikamente zielen darauf ab, das Überleben von Motoneuronen auch bei geringen Mengen an SMN-Protein zu ermöglichen.
- Olesoxim war ein proprietärer neuroprotektiver Wirkstoff, der von der französischen Firma Trophos entwickelt wurde , die später von Hoffmann-La Roche übernommen wurde und die in einer klinischen Phase-II-Studie mit Patienten mit SMA Typ 2 und 3 eine stabilisierende Wirkung zeigte Konkurrenz mit Nusinersen und schlechter als erwartete Daten aus einer offenen Verlängerungsstudie.
Von den klinisch untersuchten Verbindungen, die keine Wirksamkeit zeigten, war das Thyrotropin-Releasing-Hormon (TRH) in einer offenen, unkontrollierten klinischen Studie vielversprechend , erwies sich jedoch in einer nachfolgenden doppelblinden, placebokontrollierten Studie nicht als wirksam . Riluzol , ein Medikament, das einen leichten klinischen Nutzen bei amyotropher Lateralsklerose hat , wurde vorgeschlagen, in ähnlicher Weise bei SMA getestet zu werden; eine Studie von 2008–2010 bei den SMA-Typen 2 und 3 wurde jedoch aufgrund fehlender zufriedenstellender Ergebnisse vorzeitig abgebrochen. Andere Verbindungen, die in der In-vitro- Forschung eine gewisse neuroprotektive Wirkung hatten, aber nie in In-vivo- Studien aufgenommen wurden, sind β-Lactam-Antibiotika (z. B. Ceftriaxon ) und Follistatin .
Muskelaufbau
Dieser Ansatz zielt darauf ab, der Wirkung von SMA entgegenzuwirken, indem er auf das Muskelgewebe anstelle von Neuronen abzielt.
- Reldesemtiv (CK-2127107, CK-107) ist ein skelettaler Troponin- Aktivator, der von Cytokinetics in Zusammenarbeit mit Astellas entwickelt wurde . Das Medikament zielt darauf ab, die Muskelreaktivität trotz verringerter neuronaler Signale zu erhöhen. Das Molekül zeigte in klinischen Phase-II-Studien bei Jugendlichen und Erwachsenen mit SMA-Typen 2, 3 und 4 einen gewissen Erfolg.
- Apitegromab (SRK-015) ist ein monoklonaler Antikörper , der die Aktivierung eines Skelettmuskelproteins Myostatin blockiert und dadurch das Wachstum von Muskelgewebe fördert. Ab 2021 zeigte das Molekül Erfolg als experimentelle Zusatzbehandlung bei pädiatrischen und erwachsenen Patienten, die mit Nusinersen behandelt wurden.
Stammzellen
Während Stammzellen nie Teil einer anerkannten Therapie für SMA sind, nutzen eine Reihe von Privatunternehmen, die normalerweise in Ländern mit laxer regulatorischer Aufsicht ansässig sind, den Medienrummel und vermarkten Stammzellinjektionen als "Heilmittel" für eine Vielzahl von Erkrankungen , einschließlich SMA. Der medizinische Konsens ist, dass solche Verfahren keinen klinischen Nutzen bieten, aber ein erhebliches Risiko bergen, daher wird Menschen mit SMA davon abgeraten. In den Jahren 2013–2014 erhielt eine kleine Anzahl von SMA1-Kindern in Italien nach dem Stamina-Betrug vom Gericht angeordnete Stammzellinjektionen , aber die Behandlung hatte keine Wirkung
Register
Personen mit SMA in der Europäischen Union können an klinischer Forschung teilnehmen, indem sie ihre Daten in Register eingeben, die von TREAT-NMD verwaltet werden .
Siehe auch
Verweise
Weiterlesen
- Parano E, Pavone L, Falsaperla R, Trifiletti R, Wang C (August 1996). „Molekulare Grundlage der phänotypischen Heterogenität bei Geschwistern mit spinaler Muskelatrophie“. Annalen der Neurologie . 40 (2): 247–51. doi : 10.1002/ana.410400219 . PMID 8773609 . S2CID 42514712 .
- Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (August 2007). „Konsenserklärung zum Standard der Behandlung bei spinaler Muskelatrophie“. Zeitschrift für Kinderneurologie . 22 (8): 1027–49. doi : 10.1177/0883073807305788 . PMID 17761659 . S2CID 6478040 .
Externe Links
| Einstufung | |
|---|---|
| Externe Ressourcen |
- Spinale Muskelatrophie bei Curlie
- SMA bei NINDS


