Thermometrische Titration - Thermometric titration
Eine thermometrische Titration ist eine von mehreren instrumentellen Titrationstechniken , bei denen Endpunkte genau und präzise lokalisiert werden können, ohne dass der Analytiker ihre Position subjektiv interpretieren muss. Die Enthalpieänderung ist wohl die grundlegendste und universellste Eigenschaft chemischer Reaktionen, daher ist die Beobachtung der Temperaturänderung eine natürliche Wahl bei der Überwachung ihres Verlaufs. Es ist keine neue Technik, möglicherweise mit der ersten erkennbaren thermometrischen Titrationsmethode, über die Anfang des 20. Jahrhunderts berichtet wurde (Bell und Cowell, 1913). Trotz seiner attraktiven Eigenschaften und trotz der beträchtlichen Forschung, die auf diesem Gebiet durchgeführt wurde und einer Vielzahl von Anwendungen, die entwickelt wurden; es war bisher eine zu wenig genutzte Technik im kritischen Bereich der industriellen Prozess- und Qualitätskontrolle. In diesem Bereich dominieren seit den 1970er Jahren automatisierte potentiometrische Titrationssysteme. Mit dem Aufkommen billiger Computer, die mit der leistungsstarken thermometrischen Titrationssoftware umgehen können, ist die Entwicklung inzwischen so weit gekommen, dass einfach zu bedienende automatisierte thermometrische Titrationssysteme in vielen Fällen eine überlegene Alternative zur potentiometrischen Titrimetrie darstellen können.
Vergleich zwischen potentiometrischen und thermometrischen Titrationen
Die potentiometrische Titrimetrie ist seit den 1970er Jahren das vorherrschende automatisierte titrimetrische Verfahren, daher lohnt es sich, die grundlegenden Unterschiede zwischen ihr und der thermometrischen Titrimetrie zu berücksichtigen.
Potentiometrisch gemessene Titrationen beruhen auf einer freien Energieänderung im Reaktionssystem. Die Messung eines von der freien Energie abhängigen Termes ist erforderlich.
- Δ G 0 = - RT ln K (1)
Woher:
- ΔG 0 = Änderung der freien Energie
- R = universelle Gaskonstante
- T = Temperatur in Kelvin (K) oder Grad Rankine (°R)
- K = Gleichgewichtskonstante bei Temperatur T
- ln ist die natürliche Logarithmusfunktion
Damit eine Reaktion der potentiometrischen Titrimetrie zugänglich ist, muss die Änderung der freien Energie ausreichen, damit ein geeigneter Sensor mit einer signifikanten Knickung (oder "Knick") in der Titrationskurve reagiert, wobei die Sensorreaktion gegen die zugeführte Titriermittelmenge aufgetragen wird .
Die freie Energie ist jedoch nur einer von drei verwandten Parametern zur Beschreibung jeder chemischen Reaktion:
- Δ H 0 = Δ G 0 + T Δ S 0 (2)
wo:
- Δ H 0 = Enthalpieänderung
- Δ G 0 = Änderung der freien Energie
- Δ S 0 = Entropieänderung
- T = Temperatur in K
Bei jeder Reaktion, bei der der freien Energie keine Entropieänderung entgegensteht, ist die Enthalpieänderung deutlich größer als die freie Energie. Somit zeigt eine auf einer Temperaturänderung basierende Titration (die die Beobachtung der Enthalpieänderung ermöglicht) eine größere Krümmung als Kurven, die von Sensoren erhalten werden, die allein auf Änderungen der freien Energie reagieren.
Thermometrische Titrationen
Bei der thermometrischen Titration wird Titriermittel mit einer bekannten konstanten Rate zu einem Titrand zugegeben, bis die Beendigung der Reaktion durch eine Temperaturänderung angezeigt wird. Der Endpunkt wird durch eine Krümmung in der Kurve bestimmt, die vom Ausgang eines Temperaturmessgeräts erzeugt wird.
Betrachten Sie die Titrationsreaktion:
- a A + b B = p P (3)
Woher:
- A = das Titriermittel und a = die entsprechende Anzahl der reagierenden Mole
- B = der Analyt und b = die entsprechende Anzahl der reagierenden Mole
- P = das Produkt und p = die entsprechende Anzahl an produzierten Molen
Bei Beendigung erzeugt die Reaktion eine molare Reaktionswärme Δ H r , die als messbare Temperaturänderung Δ T dargestellt wird . In einem idealen System, in dem keine Wärmeverluste oder Wärmegewinne durch Umwelteinflüsse auftreten, wird der Reaktionsverlauf als konstanter Anstieg oder Abfall der Temperatur beobachtet, je nachdem, ob Δ H r negativ ist (was auf eine exotherme Reaktion hinweist) oder positiv (was auf eine endotherme Reaktion hinweist). Umwelteinflüsse können in diesem Zusammenhang sein (nach Wichtigkeit geordnet):
- Wärmeverluste oder -gewinne von außerhalb des Systems über die Behälterwände und den Deckel;
- Temperaturunterschiede zwischen Titriermittel und Titrand;
- Verdunstungsverluste von der Oberfläche des schnell vermischten Fluids;
- Lösungswärme beim Mischen des Titrierlösungsmittels mit dem Analytlösungsmittel;
- Wärmeeintrag durch mechanische Rührwirkung (geringfügiger Einfluss); und
- Vom Thermistor selbst erzeugte Wärme (sehr geringer Einfluss).
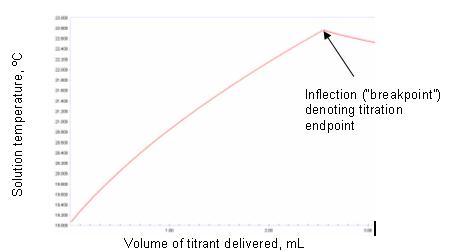
Liegt das Gleichgewicht für die Reaktion weit rechts (dh es ist ein stöchiometrisches Gleichgewicht erreicht), dann wird, wenn der gesamte Analyt durch das Titriermittel umgesetzt wurde, die weitere Zugabe von Titriermittel durch einen scharfen Bruch in der Temperatur/Volumen-Kurve sichtbar. Die Abbildungen 1a und 1b veranschaulichen idealisierte Beispiele.
Die Form experimentell erhaltener thermometrischer Titrationskurven wird von solchen idealisierten Beispielen abweichen, und einige der oben aufgeführten Umwelteinflüsse können Auswirkungen haben. Eine Krümmung am Endpunkt kann beobachtet werden. Dies kann an der Unempfindlichkeit des Sensors liegen oder daran, dass das thermische Gleichgewicht am Endpunkt nur langsam auftritt. Es kann auch auftreten, wenn die Reaktion zwischen Titriermittel und Titrand nicht bis zur stöchiometrischen Vervollständigung abläuft. Die Bestimmung des Grades, bis zu dem eine Reaktion vollständig abläuft, ist die Änderung der freien Energie. Wenn dies günstig ist, läuft die Reaktion vollständig ab und ist im Wesentlichen stöchiometrisch. In diesem Fall ist die Schärfe des Endpunkts abhängig von der Größe der Enthalpieänderung. Ist er ungünstig, wird der Endpunkt ungeachtet der Größe der Enthalpieänderung gerundet. Reaktionen, bei denen nichtstöchiometrische Gleichgewichte offensichtlich sind, können verwendet werden, um mit einem thermometrischen Titrationsansatz zufriedenstellende Ergebnisse zu erhalten. Wenn die Abschnitte der Titrationskurve sowohl vor als auch nach dem Endpunkt einigermaßen linear sind, wird der Endpunkt durch den Schnittpunkt der Tangenten an diese Linien genau lokalisiert. Dies ist in Abbildung 2 dargestellt.
Betrachten Sie die Reaktion für die Gleichung a A + b B = p P, die im Gleichgewicht nicht stöchiometrisch ist. Sei A das Titriermittel und B der Titrand. Zu Beginn der Titration ist der Titrand B stark im Überschuss und die Reaktion wird zum Abschluss getrieben. Unter diesen Bedingungen ist bei konstanter Titriermittelzugabe der Temperaturanstieg konstant und die Kurve ist im Wesentlichen linear, bis der Endpunkt erreicht wird. In ähnlicher Weise kann auch eine lineare Temperaturreaktion erwartet werden, wenn das Titriermittel über den Endpunkt hinausgeht. Somit wird der Schnittpunkt der Tangenten den wahren Endpunkt offenbaren.
Ein tatsächlicher thermometrischer Titrationsplot zur Bestimmung einer starken Base mit einer starken Säure ist in Abbildung 3 dargestellt.
Als praktischster Sensor zur Messung von Temperaturänderungen in Titrierlösungen hat sich der Thermistor erwiesen. Thermistoren sind kleine Festkörperbauelemente, die bei kleinen Temperaturänderungen relativ große Änderungen des elektrischen Widerstands aufweisen. Sie werden aus gesinterten Mischmetalloxiden hergestellt, wobei Anschlussdrähte den Anschluss an elektrische Schaltungen ermöglichen. Der Thermistor ist in ein geeignetes elektrisch isolierendes Medium mit zufriedenstellenden Wärmeübertragungseigenschaften und akzeptabler chemischer Beständigkeit eingekapselt. Typischerweise ist das Einkapselungsmedium für Thermistoren, die zur chemischen Analyse verwendet werden, Glas, obwohl in Epoxidharz eingekapselte Thermistoren unter Umständen verwendet werden können, in denen entweder ein chemischer Angriff (z. B. durch saure fluoridhaltige Lösungen) oder eine starke mechanische Belastung erwartet wird. Der Thermistor wird durch eine geeignete elektronische Schaltung unterstützt, um die Empfindlichkeit gegenüber winzigen Änderungen der Lösungstemperatur zu maximieren. Die Schaltung des thermometrischen Titrations-Interface-Moduls Metrohm 859 Titrotherm ist in der Lage, Temperaturänderungen von nur 10 −5 K aufzulösen .
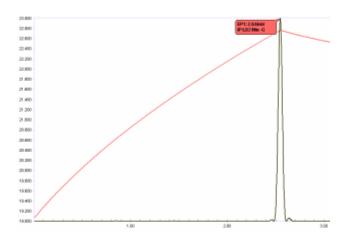
Ein entscheidendes Element der modernen automatisierten thermometrischen Titrimetrie ist die Fähigkeit, den Endpunkt mit hoher Reproduzierbarkeit zu lokalisieren. Es ist eindeutig unpraktisch und für moderne Genauigkeits- und Präzisionsanforderungen unzureichend, die Krümmung durch Tangentenschnitt zu schätzen . Dies geschieht zweckmäßigerweise durch Derivatisierung der Temperaturkurve. Die zweite Ableitung lokalisiert im Wesentlichen den Schnittpunkt der Tangenten an die Temperaturkurve unmittelbar vor und nach dem Knickpunkt.
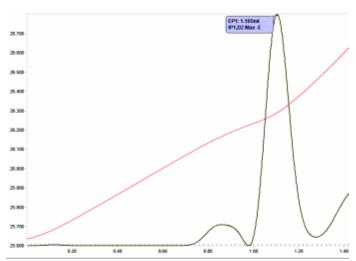
Thermistoren reagieren schnell auf kleine Temperaturänderungen wie Temperaturgradienten in der gemischten Titrationslösung, und daher kann das Signal ein geringes Rauschen aufweisen. Vor der Derivatisierung ist es daher erforderlich, die Temperaturkurve digital zu glätten (oder zu "filtern"), um scharfe, symmetrische "Spitzen" der zweiten Ableitung zu erhalten, die den richtigen Wendepunkt genau lokalisieren. Dies ist in Abbildung 5 dargestellt. Der Grad der digitalen Glättung wird für jede Bestimmung optimiert und als Methodenparameter für die Anwendung jedes Mal gespeichert, wenn eine Titration für diese bestimmte Analyse durchgeführt wird.
Da die Enthalpieänderung ein universelles Merkmal chemischer Reaktionen ist, kann die thermometrische Endpunktmessung auf eine Vielzahl von Titrationsarten angewendet werden, z
Da der Sensor nicht mit der Titrationslösung elektrochemisch wechselwirken muss , können außerdem Titrationen in nichtleitenden Medien durchgeführt werden, ebenso wie Titrationen unter Verwendung von Reaktionen, für die kein praktischer oder kostengünstiger potentiometrischer Sensor verfügbar ist.
Thermometrische Titrationen erfordern im Allgemeinen eine schnelle Reaktionskinetik , um scharfe reproduzierbare Endpunkte zu erhalten. Wenn die Reaktionskinetik langsam ist und direkte Titrationen zwischen Titriermittel und Titrand nicht möglich sind, können oft indirekte oder Rücktitrationen zur Lösung des Problems entwickelt werden.
Katalytisch verstärkte Endpunkte können in einigen Fällen verwendet werden, in denen die Temperaturänderung am Endpunkt sehr gering ist und Endpunkte von der Titrationssoftware nicht zufriedenstellend erkannt würden.
Die Eignung einer bestimmten chemischen Reaktion als Kandidat für ein thermometrisches Titrationsverfahren kann im Allgemeinen anhand der geschätzten Menge des in der Probe vorhandenen Analyten und der Reaktionsenthalpie vorhergesagt werden. Aber auch andere Parameter wie die Kinetik der Reaktion, die Probenmatrix selbst, Verdünnungswärme und Wärmeverluste an die Umgebung können das Ergebnis beeinflussen. Ein richtig konzipiertes experimentelles Programm ist der zuverlässigste Weg, um die Durchführbarkeit eines thermometrischen Titrationsansatzes zu bestimmen. Erfolgreiche Anwendungen für thermometrische Titrationen liegen im Allgemeinen dort, wo die Kinetik der Titriermittel-Titrand-Reaktion schnell ist und die chemischen Gleichgewichte stöchiometrisch oder nahezu stöchiometrisch sind.
Wo thermometrische Titrationsbestimmungen empfehlenswert sind
- Der Analytiker möchte die Durchführung verschiedener Titrationen vereinfachen, indem er einen Sensor für alle verwendet. Beispielsweise kann ein Labor routinemäßig Säure/Base-, Redox-, komplexometrische, Sulfat- und Chlorid-Titrationen durchführen. Ein einzelner thermometrischer Sensor in Verbindung mit einem Autosampler ermöglicht die Durchführung aller Titrationen in derselben Karussellladung, ohne dass die Titrationssensoren ausgetauscht werden müssen. Nach Vorbereitung der Proben und Einbringen in das Karussell ordnet der Analytiker der Becherposition im Karussell die passende thermometrische Methode zu.
- Die Titrationsumgebung gilt für konventionelle Titrationssensoren als ungeeignet. Zum Beispiel müssen pH-Elektroden mit Glasmembran für einen ordnungsgemäßen Betrieb ausreichend hydratisiert gehalten werden. Die Verwendung solcher Elektroden in im Wesentlichen nichtwässrigen Medien wie bei der Bestimmung von Spurensäuren in Lipiden und Schmierölen kann zu Leistungsverlusten führen, da die Membran verschmutzt und austrocknet und/oder wenn die Vergleichsstelle teilweise oder vollständig blockiert ist. Um mit der analytischen Arbeitsbelastung Schritt zu halten, ist es oft notwendig, eine Reihe von Elektroden durch ein Verjüngungsprogramm laufen zu lassen. Thermometrische Sensoren haben keine elektrochemische Wechselwirkung mit der Titrierlösung und können daher im Wesentlichen ohne Wartung kontinuierlich verwendet werden. Ebenso kann die potentiometrische Titration von Sulfat mit Bariumchlorid in verschiedenen Industrieproben zu einem schnellen Abbau der anzeigenden Bariumionen-selektiven Elektrode führen.
- Eine thermometrische Titrationsmethodik, die mit anderen Typen von Titrationssensoren nicht emuliert werden kann, liefert überlegene oder sonst mit anderen Techniken nicht erreichbare Ergebnisse. Beispiele sind die Fluoridbestimmung durch Titration mit Borsäure, die Analyse von Orthophosphat durch Titration mit Magnesiumionen und die direkte Titration von Aluminium mit Fluoridionen.
Gerät und Aufbau für die automatisierte thermometrische Titrimetrie
Ein geeigneter Aufbau für die automatisierte thermometrische Titrimetrie umfasst Folgendes:
- Präzisions-Fluiddosiergeräte – „Büretten“ – zur Zugabe von Titriermitteln und Dosierung anderer Reagenzien
- Thermistorbasierter thermometrischer Sensor
- Titriergefäß
- Rührwerk zum hocheffizienten Rühren des Gefäßinhalts ohne Spritzer
- Computer mit Betriebssystem für thermometrische Titration
- Schnittstellenmodul Thermometrische Titration – regelt den Datenfluss zwischen Büretten, Sensoren und Computer
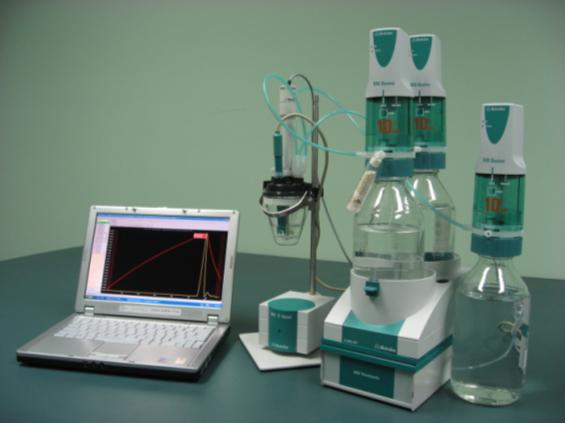
Abbildung 6 zeigt ein modernes automatisiertes thermometrisches Titrationssystem basierend auf dem Metrohm 859 Titrotherm Interface-Modul mit Thermoprobe-Sensor, Metrohm 800 Dosino Dosiergeräten und einem Computer, auf dem die Betriebssoftware läuft.
7 ist ein Schema der Beziehung zwischen Komponenten in einem automatisierten thermometrischen Titrationssystem.
A = Dosiergerät
B = Thermometrischer Sensor
C = Rührgerät
D = Thermometrische Titrationsschnittstellenmodul
E = Computer
Arten der thermometrischen Titration
Anwendungen für die thermometrische Titrimetrie stammen aus den Hauptgruppen, nämlich:
- Säure-Base-Titration
- Redox-Titration
- Niederschlagstitration
- Komplexometrische Titration
Da der Sensor weder elektrisch noch elektrochemisch mit der Lösung wechselwirkt, ist die elektrische Leitfähigkeit des Titriermediums keine Voraussetzung für eine Bestimmung. Titrationen können bei Bedarf in vollständig nichtleitenden, unpolaren Medien durchgeführt werden. Weiterhin können Titrationen in trüben Lösungen oder sogar Suspensionen von Feststoffen durchgeführt werden, und Titrationen, bei denen Niederschläge Reaktionsprodukte sind, können in Betracht gezogen werden. Der Umfang möglicher thermometrischer Titrationsanwendungen geht weit über die tatsächliche Erfahrung dieses Autors hinaus, und der Leser wird in einigen Fällen auf die entsprechende Literatur verwiesen.
Säure-Base-Titrationen
Bestimmung von vollständig dissoziierten Säuren und Basen.
Die Neutralisationswärme einer vollständig dissoziierten Säure mit einer vollständig dissoziierten Base beträgt ungefähr –56 kJ/mol. Die Reaktion ist daher stark exotherm und bietet eine hervorragende Grundlage für vielfältige Analytik in der Industrie. Ein Vorteil für den Industrieanalytiker ist, dass durch die Verwendung stärkerer Titriermittel (1 bis 2 mol/L) die Probenvorbereitung reduziert werden kann und die Proben vor der Titration oft direkt und genau in das Titriergefäss dosiert werden können.
Titration schwacher Säuren
Schwach dissoziierte Säuren ergeben scharfe thermometrische Endpunkte, wenn sie mit einer starken Base titriert werden. So lässt sich Bicarbonat in Verbindung mit Carbonat durch Titration mit Hydroxyl (Δ 0 H r =-40,9 kJ/mol) eindeutig bestimmen .
Titration von Säuregemischen
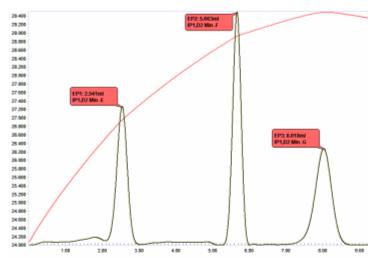
Gemische komplexer Säuren können durch thermometrische Titration mit Standard-NaOH in wässriger Lösung aufgelöst werden. In einer Mischung aus Salpeter-, Essig- und Phosphorsäure, die bei der Halbleiterherstellung verwendet wird, konnten anhand der Dissoziationskonstanten der Säuren drei Endpunkte vorhergesagt werden:
| Endpunkt 1 | Endpunkt 2 | Endpunkt 3 |
|---|---|---|
| HNO 3
(pK a = -1,3) |
HOAc
(pK a = 4,75) |
|
| H 3 PO 4
(pK a 1 = 2,12) |
H 3 PO 4
(pK a 2 = 7,21) |
H 3 PO 4
(pK a 3 = 12,36) |
Der Schlüssel zur Bestimmung der Menge jeder in der Mischung vorhandenen Säure ist die Fähigkeit, einen genauen Wert für die Menge an vorhandener Phosphorsäure zu erhalten, wie durch Titration des dritten Protons von H 3 PO 4 gezeigt .
Abbildung 10 veranschaulicht ein Titrationsdiagramm dieser Mischung, das 3 scharfe Endpunkte zeigt.
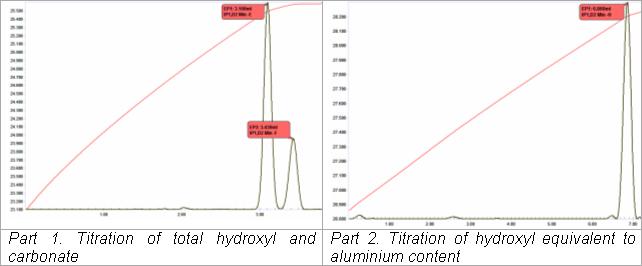
Titration komplexer alkalischer Lösungen
Die thermometrisches titrimetrische Analyse von Natriumaluminatlauge ( „ Bayer liquor“) bei der Herstellung von Aluminiumoxid aus Bauxit wird in einer automatisierten zwei Titrationssequenz erreicht. Dies ist eine Adaption einer klassischen thermometrischen Titrationsanwendung (VanDalen und Ward, 1973). Bei der ersten Titration wird Tartratlösung zu einem aliquoten Teil der Flüssigkeit zugegeben, um Aluminat zu komplexieren, wobei ein Mol Hydroxyl für jedes vorhandene Mol Aluminat freigesetzt wird. Dies wird zusammen mit dem vorhandenen "freien" Hydroxyl und dem Carbonatgehalt (als zweiter Endpunkt) acidimetrisch titriert. Der zweiten Titration geht die automatische Zugabe von Fluoridlösung voraus. Der Aluminiumoxid-Tartrat-Komplex wird zugunsten der Bildung eines Aluminiumfluorid-Komplexes und der gleichzeitigen Freisetzung von drei Mol Hydroxyl für jedes vorhandene Mol Aluminium aufgebrochen, die dann acidimetrisch titriert werden. Die gesamte Bestimmung kann in weniger als 5 Minuten abgeschlossen werden.
Nichtwässrige Säure-Base-Titrationen
Nichtwässrige Säure-Base-Titrationen können vorteilhaft thermometrisch durchgeführt werden.
Saure Laugenlösungen aus einigen Kupferminen können neben Cu(II) große Mengen an Fe(III) enthalten. Der Gehalt an "freier Säure" (Schwefelsäure) dieser Laugenlösungen ist ein kritischer Prozessparameter. Während die thermometrische Titrimetrie den Gehalt an freier Säure mit geringen Mengen an Fe(III) bestimmen kann, ist der Fe(III)-Gehalt in einigen Lösungen so hoch, dass er ernsthafte Störungen verursacht. Eine Komplexierung mit notwendigerweise großen Oxalatmengen ist aufgrund der Toxizität des Reagens unerwünscht. Eine thermometrische Titration wurde entwickelt, indem das Aliquot mit Propan-2-ol verdünnt und mit Standard-KOH in Propan-2-ol titriert wurde. Der Großteil des Metallgehalts fiel vor Beginn der Titration aus, und es wurde ein klarer, scharfer Endpunkt für den Schwefelsäuregehalt erhalten.
Katalysierte endpunktthermometrische Säure-Base-Titrationen
Die Bestimmung von Spurensäuren in organischen Matrices ist eine gängige analytische Aufgabe der Titrimetrie. Beispiele sind die Gesamtsäurezahl (TAN) in Mineral- und Schmierölen und Freie Fettsäuren (FFA) in Speisefetten und -ölen. Automatisierte potentiometrische Titrationsverfahren haben den Status einer Standardmethode, beispielsweise von ASTM für TAN und AOAC für FFA. Die Methodik ist in beiden Fällen ähnlich. Die Probe wird in einem geeigneten Lösungsmittelgemisch gelöst; sagen wir ein Kohlenwasserstoff und ein Alkohol, die auch eine kleine Menge Wasser enthalten müssen. Das Wasser soll die elektrische Leitfähigkeit der Lösung erhöhen. Die Spurensäuren werden mit Standardbase in Alkohol titriert. Die Probenumgebung ist der pH-Elektrode, die zum Erfassen der Titration verwendet wird, im Wesentlichen feindlich. Die Elektrode muss regelmäßig außer Betrieb genommen werden, um die Glasmessmembran zu rehydrieren, die ebenfalls durch die ölige Probenlösung verschmutzt werden kann.
Ein neueres thermometrisches titrimetrisches Verfahren zur Bestimmung von FFA, entwickelt von Cameiro et al. (2002) hat sich als besonders automatisierbar erwiesen. Es ist schnell, hochpräzise und die Ergebnisse stimmen sehr gut mit denen der offiziellen AOAC-Methode überein. Die Temperaturänderung für die Titration sehr schwacher Säuren wie Ölsäure um 0,1 mol/L KOH in Propan-2-ol ist zu gering, um einen genauen Endpunkt zu liefern. Bei diesem Verfahren wird dem Titrand vor der Titration eine geringe Menge Paraformaldehyd als feines Pulver zugesetzt. Am Endpunkt katalysiert der erste Überschuss an Hydroxylionen die Depolymerisation von Paraformaldehyd. Die Reaktion ist stark endotherm und ergibt eine scharfe Krümmung. Der Titrationsplot ist in Abbildung 13 dargestellt. Die Geschwindigkeit dieser Titration, gepaart mit ihrer Präzision und Genauigkeit, macht sie ideal für die Analyse von FFA in Biodiesel-Rohstoffen und -Produkten.
Redox-Titrationen
Titrationen mit Permanganat und Dichromat
Redoxreaktionen sind normalerweise stark exotherm und können ausgezeichnete Kandidaten für thermometrische Titrationen sein. Bei der klassischen Bestimmung von Eisen(II)-Ionen mit Permanganat ist die Reaktionsenthalpie mehr als doppelt so hoch wie bei einer starken Säure/starken Base: Δ 0 H r = −123,9 kJ/mol Fe. Die Bestimmung von Wasserstoffperoxid durch Permanganat-Titration ist bei Δ 0 H r = −149,6 kJ/mol H 2 O 2 . noch stärker exotherm
Titrationen mit Thiosulfat
Bei der Bestimmung von Hypochlorit (zB in handelsüblichen Bleichmittelformulierungen) kann eine direkte Titration mit Thiosulfat ohne Rückgriff auf eine jodometrische Ausrüstung eingesetzt werden.
- ClO − + H 2 O + 2e − ↔ Cl − + 2OH −
- 2S 2 O 3 2− ↔ S 4 O 6 2− + 2e −
- 2S 2 O 3 2− +ClO − +H 2 O ↔ S 4 O 6 2− +Cl − +2OH −
Praktisch sind auch thermometrische iodometrische Titrationen mit Thiosulfat als Titriermittel, beispielsweise bei der Bestimmung von Cu(II). In diesem Fall hat es sich als vorteilhaft herausgestellt, das Kaliumiodidreagens mit dem Thiosulfat-Titrierungsmittel in solchen Anteilen einzuarbeiten, dass Iod kurz vor seiner Reduktion durch Thiosulfat in Lösung freigesetzt wird. Dadurch werden Jodverluste während der Titration minimiert.
Titrationen mit Hypochlorit
Obwohl es relativ instabil ist und eine häufige Standardisierung erfordert, wurde Natriumhypochlorit in einem sehr schnellen thermometrischen Titrationsverfahren zur Bestimmung von Ammoniumionen verwendet. Dies ist eine Alternative zum klassischen Ansatz der Ammoniakdestillation aus basischer Lösung und anschließender Säure-Base-Titration. Die thermometrische Titration wird in bromidionenhaltiger Bicarbonatlösung durchgeführt (Brown et al., 1969).
Komplexometrische (EDTA) Titrationen
Thermometrische Titrationen mit Natriumsalzen von Ethylendiamintetraessigsäure (EDTA) wurden für die Bestimmung einer Reihe von Metallionen demonstriert. Die Reaktionsenthalpien sind bescheiden, daher werden Titrationen normalerweise mit Titriermittelkonzentrationen von 1 mol/L durchgeführt. Dies erfordert die Verwendung des Tetranatriumsalzes von EDTA anstelle des üblicheren Dinatriumsalzes, das in einer Konzentration von nur etwa 0,25 mol/l gesättigt ist.
Eine hervorragende Anwendung ist die sequentielle Bestimmung von Calcium und Magnesium. Während Calcium mit EDTA exotherm reagiert (Chelatwärme ~-23,4 kJ/mol), reagiert Magnesium endotherm mit einer Chelatwärme von ~+20,1 kJ/mol. Dies wird im Titrationsplot von EDTA mit Calcium und Magnesium in Meerwasser veranschaulicht (Abbildung 14). Nach der Temperaturkurve der Lösung folgt dem Knickpunkt für den Calciumgehalt (rot markierter Endpunkt) ein Bereich mit mäßigem Temperaturanstieg aufgrund der Konkurrenz zwischen den Verdünnungswärmen des Titriermittels mit der Lösung und der endothermen Reaktion von Mg 2+ und EDTA. Der Knickpunkt für die Aufnahme von Mg 2+ (blau markierter Endpunkt) durch EDTA wird durch einen rein durch die Verdünnungswärme verursachten Temperaturanstieg sichtbar.
Direkte EDTA-Titrationen mit Metallionen sind möglich, wenn die Reaktionskinetik schnell ist, z. B. Zink, Kupfer, Calcium und Magnesium. Bei langsameren Reaktionskinetiken, wie sie von Kobalt und Nickel gezeigt werden, werden jedoch Rücktitrationen verwendet. Titrationen für Kobalt und Nickel werden in einer ammoniakalischen Umgebung durchgeführt; gepuffert mit Ammoniak:Ammoniumchlorid-Lösung. Ein Überschuss an EDTA wird zugegeben und mit Cu(II)-Lösung zurücktitriert. Es wird postuliert, dass der Bruchpunkt durch den Unterschied der Reaktionsenthalpien zwischen der Bildung des Cu-EDTA-Komplexes und derjenigen für die Bildung des Cu-Amin-Komplexes sichtbar wird.
Ein katalysiertes Endpunktverfahren zur Bestimmung von Spurenmengen von Metallionen in Lösung (bis zu ungefähr 10 mg/l) verwendet 0,01 mol/l EDTA. Dies wurde bei der Bestimmung von niedrigem Cu(II)-Gehalt in speziellen Galvanisierbädern und bei der Bestimmung der Gesamthärte in Wasser angewendet. Die Reaktionsenthalpien von EDTA mit den meisten Metallionen sind oft recht gering, und typischerweise werden Titriermittelkonzentrationen um 1 mol/L mit entsprechend hohen Titrandmengen verwendet, um scharfe, reproduzierbare Endpunkte zu erhalten. Bei Verwendung eines katalytisch angezeigten Endpunkts können sehr niedrige EDTA-Titriermittelkonzentrationen verwendet werden. Es wird eine Rücktitration verwendet. Ein Überschuss an EDTA-Lösung wird zugegeben. Der Überschuss an EDTA wird mit einem geeigneten Metallion wie Mn 2+ oder Cu 2+ zurücktitriert . Am Endpunkt katalysiert der erste Überschuss an Metallionen eine stark exotherme Reaktion zwischen einem mehrwertigen Phenol (wie Resorcin) und Wasserstoffperoxid.
Niederschlagstitrationen
Die thermometrische Titrimetrie eignet sich besonders zur Bestimmung einer Reihe von Analyten, bei denen durch Reaktion mit dem Titriermittel ein Niederschlag gebildet wird. In einigen Fällen kann eine Alternative zur herkömmlichen potentiometrischen Titrationspraxis angeboten werden. In anderen Fällen können Reaktionschemien verwendet werden, für die es in der potentiometrischen Titrimetrie kein zufriedenstellendes Äquivalent gibt.
Titrationen mit Silbernitrat
Thermometrische Titrationen von Silbernitrat mit Halogeniden und Cyanid sind alle möglich. Die Reaktion von Silbernitrat mit Chlorid ist stark exotherm. Beispielsweise beträgt die Reaktionsenthalpie von Ag + mit Cl − hohe −61,2 kJ/mol. Dies ermöglicht eine bequeme Chloridbestimmung mit handelsüblichem Standard 0,1 mol/L AgNO 3 . Die Endpunkte sind sehr scharf und mit Vorsicht können Chloridkonzentrationen bis zu 15 mg/L analysiert werden. Bromid und Chlorid können im Gemisch bestimmt werden.
Titration von Sulfat
Sulfat kann mit Standardlösungen von Ba 2+ als Titriermittel schnell und einfach thermometrisch titriert werden . Industriell wurde das Verfahren zur Bestimmung von Sulfat in Sole (einschließlich Elektrolysesolen), in Nickelraffinationslösungen und insbesondere für Sulfat in Nassprozess- Phosphorsäure angewendet , wo es sich als sehr beliebt erwiesen hat. Das Verfahren kann auch zur Analyse komplexer schwefelsäurehaltiger Säuregemische verwendet werden, bei denen eine Titration in nichtwässrigen Medien nicht möglich ist.
Die Reaktionsenthalpie für die Bildung von Bariumsulfat beträgt bescheidene −18,8 kJ/mol. Dies kann die untere Sulfatgrenze in einer Probe, die analysiert werden kann, einschränken.
Titration von Aluminium mit Fluorid
Die thermometrische Titrimetrie bietet eine schnelle und hochpräzise Methode zur Bestimmung von Aluminium in Lösung. Eine Aluminiumlösung wird mit Acetatpuffer und einem Überschuss an Natrium- und Kaliumionen konditioniert. Die Titration mit Natrium- oder Kaliumfluorid führt zur exothermen Fällung eines unlöslichen Alumofluoridsalzes.
- Al 3+ + Na + + 2K + + 6F − ↔ K 2 NaAlF 6 ↓
Da 6 Mol Fluorid mit einem Mol Aluminium reagieren, ist die Titration besonders präzise und bei der Analyse von Alaun wurde ein Varianzkoeffizient (CV) von 0,03 erreicht.
Wenn Aluminiumionen (z. B. Aluminiumnitrat) als Titriermittel verwendet werden, kann Fluorid mit der gleichen Chemie bestimmt werden. Diese Titration ist nützlich bei der Bestimmung von Fluorid in komplexen Säuremischungen, die als Ätzmittel in der Halbleiterindustrie verwendet werden.
Titration von Gesamtorthophosphat
Orthophosphat-Ionen können bequem thermometrisch mit Magnesium-Ionen in Gegenwart von Ammonium-Ionen titriert werden. Ein Probenaliquot wird mit einer NH 3 /NH 4 Cl-Lösung auf ungefähr pH 10 gepuffert .
Die Reaktion:
- Mg 2+ + NH 4 + + PO 4 3− ↔ MgNH 4 PO 4 ↓
Ist exotherm. In Testanwendungen wurden CVs von unter 0,1 erreicht. Das Verfahren eignet sich zur Bestimmung von Orthophosphat in Düngemitteln und anderen Produkten.
Titration von Nickel
Nickel kann thermometrisch mit Dinatriumdimethylglyoximat als Titriermittel titriert werden. Die Chemie ist analog zum klassischen gravimetrischen Verfahren, jedoch kann die Zeit für eine Bestimmung von vielen Stunden auf wenige Minuten reduziert werden. Mögliche Interferenzen müssen berücksichtigt werden.
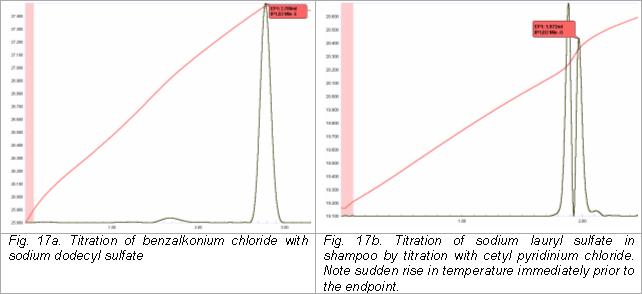
Titration von anionischen und kationischen Tensiden
Anionische und kationische Tenside können thermometrisch bestimmt werden, indem ein Typ gegen den anderen titriert wird. Zum Beispiel kann Benzalkoniumchlorid (ein kationisches Tensid vom quaternären Typ) in Reinigern und Algiziden für Schwimmbäder und Spas durch Titration mit einer Standardlösung von Natriumdodecylsulfat bestimmt werden. Alternativ können anionische Tenside wie Natriumlaurylsulfat mit Cetylpyridiniumchlorid titriert werden .
Titration von nichtionischen Tensiden
Wenn ein Überschuss an Ba 2+ zu einem nichtionischen Tensid vom Typ der Alkylpropylenoxid-Derivate zugegeben wird, wird ein pseudo-kationischer Komplex gebildet. Dies kann mit Standard-Natriumtetraphenylborat titriert werden. Zwei Mol Tetraphenylborat reagieren mit einem Mol des Ba 2+ /nichtionischen Tensidkomplexes.
Verschiedene wässrige Titrationen
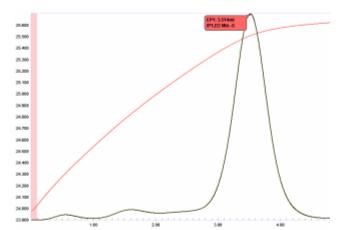
Titration von Fluorid mit Borsäure
Saure Fluoridlösungen (einschließlich Flusssäure) können durch eine einfache thermometrische Titration mit Borsäure bestimmt werden.
- B(OH) 3 + 3F − + 3H + BF 3 + 3H 2 O
Das in Abbildung 19 dargestellte Titrationsdiagramm zeigt, dass der Endpunkt ziemlich abgerundet ist, was darauf hindeutet, dass die Reaktion möglicherweise nicht bis zum stöchiometrischen Gleichgewicht verläuft. Da jedoch die Bereiche der Temperaturkurve unmittelbar vor und nach dem Endpunkt ziemlich linear sind, wird die zweite Ableitung dieser Kurve (die den Schnittpunkt der Tangenten darstellt) den Endpunkt genau lokalisieren. Tatsächlich kann mit dieser Titration eine ausgezeichnete Präzision mit einem VK von weniger als 0,1 erreicht werden.
Bestimmung von Formaldehyd
Formaldehyd kann in stromlosen Verkupferungslösungen durch Zugabe eines Überschusses an Natriumsulfitlösung und Titration des freigesetzten Hydroxylions mit Standardsäure bestimmt werden.
- H 2 C=O + HSO 3 − + H 2 O → [HO-CH 2 -SO 3 − ] + OH −
Verweise
- JM Bell und CF Cowell. Marmelade. Chem.-Nr. Soz. 35 , 49-54 (1913)
- E. VanDalen und LG Ward. Thermometrische Titrationsbestimmung von Hydroxid und Aluminiumoxid im Bayer-Verfahren
Lösungen. Anal. Chem.-Nr. 45 (13) 2248-2251, (1973)
- MJD Carneiro, MA Feres Junior und OES Godinho. Bestimmung des Säuregehalts von Ölen unter Verwendung von Paraformaldehyd als thermometrischer Endpunktindikator. J. Braz. Chem.-Nr. Soz. 13 (5) 692-694 (2002)
Literaturverzeichnis
- Rinde, LS und Rinde, SM; (1969). Thermometrische Titrimetrie. International Series of Monographies in Analytical Chemistry, Band 33 Pergamon Press (Oxford) Library of Congress Katalogkarte Nr. 68-57883
- Barthel, J.; (1975) Thermometrische Titrationen. John Wiley & Söhne, New York. ISBN 0-471-05448-8 Library of Congress Katalogkarte Nr. 75-17503
- Essen, DJ; Christensen, JJ & Izatt RM; (1974) Experimente in thermometrischer Titrimetrie und Titrationskalorimetrie. Brigham Young University Press , Provo, Utah . ISBN 0-8425-0145-2 Library of Congress Katalogkarte 74-13074
- Grime, JK; (1985) Analytische Lösungskalorimetrie. John Wiley & Söhne, New York. ISBN 0-471-86942-2 Library of Congress Katalogkarte Nr. 84-28424
- Vaughan, GA; (1973) Thermometrische und enthalpimetrische Titrimetrie. Van Nostrand Reinhold Company (London) ISBN 0-442-78385-X Library of Congress Katalogkarte Nr. 79-186764