Dicalciumphosphat - Dicalcium phosphate
|
|

|
|
| Namen | |
|---|---|
|
IUPAC-Name
Calciumhydrogenphosphat
|
|
| Andere Namen
Calciumhydrogenphosphat,
Phosphorsäure Calciumsalz (1:1) |
|
| Bezeichner | |
|
3D-Modell ( JSmol )
|
|
| ChemSpider | |
| ECHA-InfoCard |
100.028.833 |
| E-Nummer | E341(ii) (Antioxidantien, ...) |
|
PubChem- CID
|
|
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| CaHPO 4 | |
| Molmasse | 136,06 g/mol (wasserfrei) 172,09 (Dihydrat) |
| Aussehen | weißes Puder |
| Geruch | geruchlos |
| Dichte | 2,929 g/cm 3 (wasserfrei) 2,31 g/cm 3 (Dihydrat) |
| Schmelzpunkt | zersetzt |
| 0,02 g/100 ml (wasserfrei) 0,02 g/100 ml (Dihydrat) |
|
| Struktur | |
| triklinik | |
| Gefahren | |
| NFPA 704 (Feuerdiamant) | |
| Flammpunkt | Nicht brennbar |
| Verwandte Verbindungen | |
|
Andere Anionen
|
Calciumpyrophosphat |
|
Andere Kationen
|
Magnesiumphosphat Monocalciumphosphat Tricalciumphosphat Strontiumphosphat |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Dicalciumphosphat ist das Calciumphosphat mit der Formel CaHPO 4 und dessen Dihydrat. Das Präfix "di" im allgemeinen Namen entsteht, weil bei der Bildung des HPO 4 2– -Anions zwei Protonen aus der Phosphorsäure , H 3 PO 4 , entfernt werden . Es wird auch als dibasisches Calciumphosphat oder Calciummonohydrogenphosphat bezeichnet . Dicalciumphosphat wird als Lebensmittelzusatzstoff verwendet , findet sich in einigen Zahnpasten als Poliermittel und ist ein Biomaterial .
Vorbereitung
Dibasisches Calciumphosphat wird durch die Neutralisation von Calciumhydroxid mit Phosphorsäure hergestellt , die das Dihydrat als Feststoff ausfällt. Bei 60 °C fällt die wasserfreie Form aus:
Um einen Abbau zu verhindern, der Hydroxyapatit bilden würde , werden Natriumpyrophosphat oder Trimagnesiumphosphatoctahydrat zugesetzt, wenn beispielsweise zweibasisches Calciumphosphatdihydrat als Poliermittel in Zahnpasta verwendet werden soll.
In einem kontinuierlichen Prozess kann CaCl 2 mit (NH 4 ) 2 HPO 4 behandelt werden , um das Dihydrat zu bilden:
Eine Aufschlämmung des Dihydrats wird dann auf etwa 65–70 °C erhitzt, um wasserfreies CaHPO 4 als kristallines Präzipitat zu bilden, typischerweise in Form flacher diamantoider Kristalle, die für die weitere Verarbeitung geeignet sind.
Dibasisches Calciumphosphat-Dihydrat wird in "Brushit"-Calciumphosphat-Zementen (CPCs) gebildet, die medizinische Anwendungen haben. Ein Beispiel für die gesamte Abbindereaktion bei der Bildung von "β-TCP/MCPM" (β- Tricalciumphosphat / Monocalciumphosphat ) Calciumphosphatzementen ist:

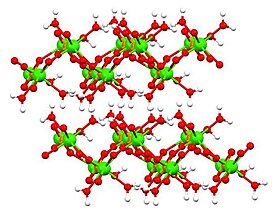
Struktur
Drei (3) Formen von Dicalciumphosphat sind bekannt:
- Dihydrat , CaHPO 4 •2H 2 O ('DPCD'), das Mineral Brushit
- Monohydrat , CaHPO 4 •H 2 O ('DCPM')
- wasserfreies CaHPO 4 , ("DCPA"), das Mineral Monetit . Unter pH 4,8 sind die Dihydrate und die wasserfreien Formen von Dicalciumphosphat die stabilsten (unlöslichsten) Calciumphosphate.
Die Struktur der wasserfreien und dihydratisierten Formen wurde durch Röntgenkristallographie bestimmt und die Struktur des Monohydrats wurde durch Elektronenkristallographie bestimmt . Sowohl das Dihydrat (in obiger Tabelle gezeigt) als auch das Monohydrat nehmen Schichtstrukturen an.
Verwendung und Vorkommen
Dibasisches Calciumphosphat wird hauptsächlich als Nahrungsergänzungsmittel in zubereiteten Frühstückszerealien, Hundesnacks, angereichertem Mehl und Nudelprodukten verwendet. Es wird auch als Tablettierungsmittel in einigen pharmazeutischen Präparaten verwendet, einschließlich einiger Produkte, die Körpergeruch beseitigen sollen . Dibasisches Calciumphosphat ist auch in einigen Nahrungsergänzungsmitteln mit Calcium enthalten (zB Bonexcin). Es wird in Geflügelfutter verwendet. Es wird auch in einigen Zahnpasten als Zahnsteinbekämpfungsmittel verwendet.
Das Erhitzen von Dicalciumphosphat ergibt Dicalciumdiphosphat , ein nützliches Poliermittel:
Als Dihydrat (Brushit) kommt es in einigen Nierensteinen und in Zahnstein vor .

