Flamme - Flame

Eine Flamme (von lat. flamma ) ist der sichtbare, gasförmige Teil eines Feuers . Sie wird durch eine stark exotherme chemische Reaktion verursacht, die in einer dünnen Zone stattfindet. Sehr heiße Flammen sind heiß genug, um ionisierte gasförmige Komponenten mit ausreichender Dichte zu haben, um als Plasma angesehen zu werden .
Mechanismus
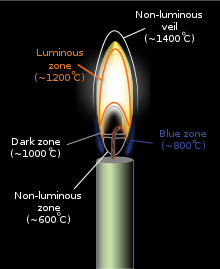
Farbe und Temperatur einer Flamme sind abhängig von der Art des an der Verbrennung beteiligten Brennstoffs, beispielsweise wenn ein Feuerzeug an eine Kerze gehalten wird. Durch die zugeführte Hitze verdampfen die Brennstoffmoleküle im Kerzenwachs (Wenn dieser Vorgang in einer inerten Atmosphäre ohne Oxidationsmittel abläuft , wird er Pyrolyse genannt ). In diesem Zustand können sie dann leicht mit Luftsauerstoff reagieren, der bei der anschließenden exothermen Reaktion genügend Wärme abgibt, um noch mehr Kraftstoff zu verdampfen und so eine gleichmäßige Flamme aufrechtzuerhalten. Die hohe Temperatur der Flamme bewirkt, dass sich die verdampften Brennstoffmoleküle zersetzen und verschiedene unvollständige Verbrennungsprodukte und freie Radikale bilden , und diese Produkte reagieren dann miteinander und mit dem Oxidationsmittel, das an der Reaktion der folgenden Flamme (Feuer) beteiligt ist. Man kann mit einem kalten Metalllöffel alle verschiedenen Teile der Flamme einer Kerze untersuchen: Höhere Teile sind Wasserdampf, das Endergebnis der Verbrennung; gelbe Teile in der Mitte sind Ruß; Unten direkt neben dem Kerzendocht befindet sich unverbranntes Wachs. Goldschmiede verwenden höhere Flammenteile mit einem metallischen Blasrohr zum Schmelzen von Gold und Silber. Ausreichende Energie in der Flamme regt die Elektronen in einigen Übergangsreaktionszwischenprodukten wie dem Methylidin-Radikal (CH) und dem zweiatomigen Kohlenstoff (C 2 ) an, was zur Emission von sichtbarem Licht führt, da diese Substanzen ihre überschüssige Energie freisetzen (siehe Spektrum unten für eine Erklärung, welche spezifischen Radikalarten welche spezifischen Farben erzeugen). Wenn die Verbrennungstemperatur einer Flamme steigt (wenn die Flamme kleine Partikel aus unverbranntem Kohlenstoff oder anderem Material enthält), steigt auch die durchschnittliche Energie der von der Flamme abgegebenen elektromagnetischen Strahlung (siehe Schwarzer Körper ).
Neben Sauerstoff können auch andere Oxidationsmittel verwendet werden, um eine Flamme zu erzeugen. Der in Chlor verbrennende Wasserstoff erzeugt eine Flamme und emittiert dabei gasförmigen Chlorwasserstoff (HCl) als Verbrennungsprodukt. Eine weitere von vielen möglichen chemischen Kombinationen ist Hydrazin und Stickstofftetroxid, das hypergolisch ist und üblicherweise in Raketentriebwerken verwendet wird. Fluorpolymere können verwendet werden, um Fluor als Oxidationsmittel für metallische Brennstoffe bereitzustellen , zB in der Zusammensetzung Magnesium/Teflon/Viton .
Die in der Flamme ablaufende chemische Kinetik ist sehr komplex und beinhaltet typischerweise eine Vielzahl chemischer Reaktionen und Zwischenverbindungen, die meisten davon Radikale . Zum Beispiel verwendet ein bekanntes chemisches Kinetik-Schema, GRI-Mech, 53 Spezies und 325 Elementarreaktionen, um die Verbrennung von Biogas zu beschreiben .
Es gibt verschiedene Methoden, die benötigten Verbrennungskomponenten auf eine Flamme zu verteilen. In einer Diffusionsflamme diffundieren Sauerstoff und Brennstoff ineinander; die Flamme tritt dort auf, wo sie sich treffen. Bei einer vorgemischten Flamme werden Sauerstoff und Brennstoff vorher vorgemischt, was zu einer anderen Flammenart führt. Kerzenflammen (eine Diffusionsflamme) funktionieren durch Verdampfung des Brennstoffs, der in einer laminaren Strömung von heißem Gas aufsteigt, das sich dann mit umgebendem Sauerstoff vermischt und verbrennt.
Farbe

Die Flammenfarbe hängt von mehreren Faktoren ab, wobei die wichtigsten typischerweise die Schwarzkörperstrahlung und die Spektralbandenemission sind , wobei sowohl die Spektrallinienemission als auch die Spektrallinienabsorption eine kleinere Rolle spielen. Bei der gebräuchlichsten Flammenart, den Kohlenwasserstoffflammen , ist der wichtigste farbbestimmende Faktor die Sauerstoffzufuhr und das Ausmaß der Brennstoff-Sauerstoff-Vormischung, die die Verbrennungsgeschwindigkeit und damit die Temperatur und Reaktionswege bestimmt und dadurch unterschiedliche Farbtöne erzeugt .

In einem Labor unter normalen Schwerkraftbedingungen und mit geschlossenem Lufteinlass brennt ein Bunsenbrenner mit gelber Flamme (auch Sicherheitsflamme genannt) mit einer Spitzentemperatur von etwa 2.000 K (3.100 °F). Das Gelb entsteht durch das Glühen sehr feiner Rußpartikel, die in der Flamme entstehen. Beim Öffnen des Lufteinlasses wird weniger Ruß produziert. Bei ausreichender Luftzufuhr entsteht kein Ruß und die Flamme wird blau. ( Die meisten dieser blau war zuvor durch die hellen gelben Emissionen verschleiert worden.) Das Spektrum eines vorgemischten (vollständige Verbrennung) butan Flamme auf der rechten Seite zeigt , dass die blaue Farbe speziell aufgrund der Emission von angeregten molekularen entsteht Radikale in der Flamme, die Emit das meiste ihres Lichts deutlich unter ≈565 Nanometer im blauen und grünen Bereich des sichtbaren Spektrums.
Der kältere Teil einer Diffusionsflamme (unvollständige Verbrennung) ist rot und geht mit steigender Temperatur in orange, gelb und weiß über, was durch Änderungen im Strahlungsspektrum des Schwarzen Körpers belegt wird. Für eine bestimmte Flammenregion ist dieser Abschnitt der Flamme umso heißer, je näher sie auf dieser Skala an Weiß liegt. Die Übergänge sind oft bei Bränden sichtbar, bei denen die Farbe, die dem Brennstoff am nächsten ist, weiß ist, mit einem orangefarbenen Abschnitt darüber und rötlichen Flammen am höchsten. Eine blaue Flamme entsteht nur, wenn die Rußmenge abnimmt und die blauen Emissionen von angeregten Molekülradikalen dominieren, obwohl das Blau oft in der Nähe des Kerzenfußes zu sehen ist, wo Ruß in der Luft weniger konzentriert ist.
Durch die Einführung erregbarer Spezies mit hellen Emissionsspektrumlinien können der Flamme spezifische Farben verliehen werden. In der analytischen Chemie wird dieser Effekt in Flammentests verwendet , um das Vorhandensein einiger Metallionen zu bestimmen. In der Pyrotechnik werden die pyrotechnischen Farbstoffe verwendet, um bunte Feuerwerkskörper herzustellen.
Temperatur

Bei der Betrachtung der Temperatur einer Flamme gibt es viele Faktoren, die sich ändern oder zutreffen können. Ein wichtiger Aspekt ist, dass die Farbe einer Flamme nicht unbedingt einen Temperaturvergleich bestimmt, da die Strahlung des Schwarzen Körpers nicht das einzige Ding ist, das die gesehene Farbe erzeugt oder bestimmt; daher ist es nur eine Schätzung der Temperatur. Andere Faktoren, die seine Temperatur bestimmen, sind:
- Adiabatische Flamme ; dh kein Wärmeverlust an die Atmosphäre (kann in bestimmten Teilen abweichen)
- Luftdruck
- Prozentualer Sauerstoffgehalt der Atmosphäre
- Die Art des verwendeten Brennstoffs (dh hängt davon ab, wie schnell der Prozess abläuft; wie heftig die Verbrennung ist)
- Jegliche Oxidation des Kraftstoffs
- Die Temperatur der Atmosphäre hängt mit der adiabatischen Flammentemperatur zusammen (dh die Wärme wird schneller auf eine kühlere Atmosphäre übertragen)
- Wie stöchiometrisch der Verbrennungsprozess ist (eine 1:1-Stöchiometrie) unter der Annahme, dass keine Dissoziation die höchste Flammentemperatur hat; Überschüssige Luft/Sauerstoff senkt sie ebenso wie Mangel an Luft/Sauerstoff
Bei Bränden (insbesondere Hausbränden) sind die kühleren Flammen oft rot und produzieren am meisten Rauch. Hier deutet die rote Farbe im Vergleich zur typischen gelben Farbe der Flammen auf eine niedrigere Temperatur hin. Dies liegt daran, dass im Raum Sauerstoffmangel herrscht und somit eine unvollständige Verbrennung stattfindet und die Flammentemperatur niedrig ist, oft nur 600 bis 850 °C (1.112 bis 1.562 °F). Dies bedeutet, dass viel Kohlenmonoxid (ein brennbares Gas) gebildet wird, bei dem die größte Gefahr von Backdraft besteht . Dabei werden brennbare Gase am oder über dem Flammpunkt der Selbstentzündung Sauerstoff, Kohlenmonoxid und überhitzten Kohlenwasserstoffen ausgesetzt, und es treten vorübergehend Temperaturen von bis zu 2.000 °C (3.630 °F) auf.
Gängige Temperaturen
Dies ist ein grober Anhaltspunkt für Flammentemperaturen für verschiedene gängige Substanzen (in 20 °C (68 °F) Luft bei 1 atm. Druck):
| Material verbrannt | Flammentemperatur |
|---|---|
| Butan | ~300 °C (~600 °F) [eine kühle Flamme bei geringer Schwerkraft) |
| Charcoal Feuer | 750–1.200 °C (1.382–2.192 °F) |
| Methan (Erdgas) | 900–1.500 °C (1.652–2.732 °F) |
| Bunsenbrenner Flamme | 900–1.600 °C (1.652–2.912 °F) [je nach Luftventil öffnen oder schließen.] |
| Kerzenflamme | ≈ 1.100 °C (≈ 2.012 °F) [Mehrheit]; Hot Spots können 1.300–1.400 °C (2.372–2.552 °F) betragen |
| Propan- Lötlampe | 1.200–1.700 °C (2.192–3.092 °F) |
| Backdraft Flammenspitze | 1.700–1.950 °C (3.092–3.542 °F) |
| Magnesium | 1.900–2.300 °C (3.452–4.172 °F) |
| Wasserstoffbrenner | Bis zu ≈2.000 °C (≈3.632 °F) |
| MAPP-Gas | 2.020 °C (3.668 °F) |
| Acetylen- Blaslampe/ Lötlampe | Bis zu ≈2.300 °C (≈4.172 °F) |
| Oxyacetylen | Bis zu 3.300 °C (5.972 °F) |
| Material verbrannt | max. Flammentemperatur (in Luft, Diffusionsflamme) |
|---|---|
| Tierfett | 800–900 °C (1.472–1.652 °F) |
| Kerosin | 990 °C (1.814 °F) |
| Benzin | 1.026 °C (1.878,8 °F) |
| Holz | 1.027 °C (1.880,6 °F) |
| Methanol | 1.200 °C (2.192 °F) |
| Holzkohle (Zwangszug) | 1.390 °C (2.534 °F) |
Höchste Temperatur
Dicyanoacetylen , eine Verbindung aus Kohlenstoff und Stickstoff mit der chemischen Formel C 4 N 2 verbrennt in Sauerstoff mit einer hellblau-weißen Flamme bei einer Temperatur von 5.260 K (4.990 °C; 9.010 °F) und bei bis zu 6.000 K (5.730 ° .) C; 10.340 °F) in Ozon . Diese hohe Flammentemperatur ist teilweise auf das Fehlen von Wasserstoff im Brennstoff zurückzuführen (Dicyanoacetylen ist kein Kohlenwasserstoff), daher befindet sich kein Wasser unter den Verbrennungsprodukten.
Cyanogen mit der Formel (CN) 2 erzeugt die zweitheißeste bekannte natürliche Flamme mit einer Temperatur von über 4.525 °C (8.177 °F), wenn es in Sauerstoff verbrennt.
Kühle Flammen
Bei Temperaturen von nur 120 °C (248 °F) können Kraftstoff-Luft-Gemische chemisch reagieren und sehr schwache Flammen erzeugen, die als kalte Flammen bezeichnet werden. Das Phänomen wurde 1817 von Humphry Davy entdeckt. Der Prozess hängt von einem ausgewogenen Temperatur- und Konzentrationsverhältnis der Reaktionsmischung ab, und wenn die Bedingungen stimmen, kann er ohne externe Zündquelle eingeleitet werden. Zyklische Schwankungen im Gleichgewicht von Chemikalien, insbesondere von Zwischenprodukten in der Reaktion, führen zu Schwingungen in der Flamme mit einer typischen Temperaturschwankung von etwa 100 ° C (212 ° F) oder zwischen "kühl" und vollständiger Zündung. Manchmal kann die Variation zu einer Explosion führen.
In der Schwerelosigkeit

Im Jahr 2000 bestätigten Experimente der NASA, dass die Schwerkraft eine indirekte Rolle bei der Flammenbildung und -zusammensetzung spielt. Die übliche Verteilung einer Flamme unter normalen Schwerkraftbedingungen hängt von der Konvektion ab , da Ruß dazu neigt, an die Spitze einer Flamme aufzusteigen (wie in einer Kerze unter normalen Schwerkraftbedingungen), wodurch sie gelb wird. In einer Mikrogravitations- oder Schwerelosigkeitsumgebung , wie im Orbit, tritt keine natürliche Konvektion mehr auf und die Flamme wird kugelförmig, mit der Tendenz, blauer und effizienter zu werden. Für diesen Unterschied gibt es mehrere mögliche Erklärungen, von denen die wahrscheinlichste die Hypothese ist, dass die Temperatur so gleichmäßig verteilt ist, dass kein Ruß gebildet wird und eine vollständige Verbrennung stattfindet. Experimente der NASA zeigen, dass Diffusionsflammen in Mikrogravitation es ermöglichen, dass mehr Ruß nach ihrer Herstellung vollständig oxidiert wird als Diffusionsflammen auf der Erde, aufgrund einer Reihe von Mechanismen, die sich in Mikrogravitation anders verhalten als unter normalen Schwerkraftbedingungen. Diese Entdeckungen haben potenzielle Anwendungen in der angewandten Wissenschaft und in der Privatwirtschaft, insbesondere im Hinblick auf die Kraftstoffeffizienz.
Thermonukleare Flammen
Flammen müssen nicht nur durch die Freisetzung chemischer Energie angetrieben werden. In Sternen breiten sich Unterschall-Brennfronten, die von brennenden leichten Kernen (wie Kohlenstoff oder Helium) bis hin zu schweren Kernen (bis hin zur Eisengruppe) angetrieben werden, als Flammen aus. Dies ist bei einigen Modellen von Typ-Ia-Supernovae wichtig . In thermonuklearen Flammen dominiert die Wärmeleitung über die Speziesdiffusion, daher wird die Flammengeschwindigkeit und -dicke durch die thermonukleare Energiefreisetzung und die Wärmeleitfähigkeit (oft in Form von entarteten Elektronen ) bestimmt.
Siehe auch
- Flammenmelder
- Internationale Stiftung für Flammenforschung
- Oxidierende und reduzierende Flammen
- Das Institut für Verbrennung
Verweise
Externe Links
- Eine Kerzenflamme wird durch ein elektrisches Feld stark beeinflusst und bewegt , da die Flamme Ionen enthält.
- Extrem emissionsarmer Brenner mit geringem Drall
- 7 Schatten des Feuers
- Lizenz, Peter. "Farbige Flammen" . Das Periodensystem der Videos . Universität Nottingham .