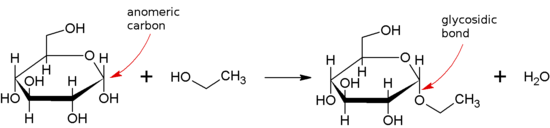
Glykosidische Bindung - Glycosidic bond
Eine glykosidische Bindung oder glykosidische Bindung ist eine Art kovalenter Bindung , die ein Kohlenhydrat- (Zucker-)Molekül mit einer anderen Gruppe verbindet, die ein anderes Kohlenhydrat sein kann oder nicht.
Eine glycosidische Bindung wird zwischen der Halbacetal- oder Halbketalgruppe eines Saccharids (oder einem von einem Saccharid abgeleiteten Molekül) und der Hydroxylgruppe einer Verbindung wie eines Alkohols gebildet . Eine Substanz, die eine glykosidische Bindung enthält, ist ein Glykosid .
Der Begriff „Glykosid“ wird jetzt auch auf Verbindungen mit Bindungen zwischen Halbacetal- (oder Halbketal-)Gruppen von Zuckern und mehreren anderen chemischen Gruppen als Hydroxylen wie -SR (Thioglykoside), -SeR (Selenoglykoside), -NR 1 R . erweitert 2 (N-Glycoside) oder sogar -CR 1 R 2 R 3 (C-Glycoside).
Insbesondere in natürlich vorkommenden Glykosiden wird die Verbindung ROH, aus der der Kohlenhydratrest entfernt wurde, oft als Aglykon bezeichnet, und der Kohlenhydratrest selbst wird manchmal als "Glykon" bezeichnet.
S-, N-, C- und O-glycosidische Bindungen
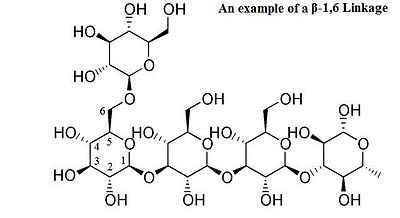
Glykosidische Bindungen der oben diskutierten Form sind als O-glykosidische Bindungen in Bezug auf den glykosidischen Sauerstoff bekannt , der das Glykosid mit dem Aglykon oder reduzierenden Endzucker verbindet. Analog betrachtet man auch S-glykosidische Bindungen (die Thioglykoside bilden ), bei denen der Sauerstoff der glykosidischen Bindung durch ein Schwefelatom ersetzt wird. Auf die gleiche Weise wird bei N-glykosidischen Bindungen der Sauerstoff der glykosidischen Bindung durch Stickstoff ersetzt . Substanzen mit N-glykosidischen Bindungen werden auch als Glykosylamine bezeichnet . Bei C-Glycosyl- Bindungen ist der glycosidische Sauerstoff durch einen Kohlenstoff ersetzt ; der Begriff "C-Glycosid" wird von der IUPAC als falsche Bezeichnung angesehen und davon abgeraten. Alle diese modifizierten glykosidischen Bindungen sind unterschiedlich hydrolyseanfällig und bei C-Glycosylstrukturen typischerweise hydrolysebeständiger.
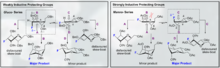
Nummerierung und α/β-Unterscheidung glykosidischer Bindungen
Wenn ein anomeres Zentrum an einer glykosidischen Bindung beteiligt ist (wie es in der Natur üblich ist), kann man zwischen α- und β-glykosidischen Bindungen anhand der relativen Stereochemie der anomeren Position und des am weitesten von C1 entfernten Stereozentrums im Saccharid unterscheiden.
Pharmakologen verbinden Substanzen häufig über glykosidische Bindungen mit Glucuronsäure , um deren Wasserlöslichkeit zu erhöhen ; dies wird als Glukuronidierung bezeichnet . Viele andere Glykoside haben wichtige physiologische Funktionen.
Chemische Ansätze
Nüchteret al. (2001) haben einen neuen Ansatz zur Fischer-Glykosidierung gezeigt . Verwendung eines Mikrowellenofen mit Vorrichtung Refluxieren in einem Rotorreaktor mit Druckbomben , Nüchter et al. (2001) konnten eine 100%ige Ausbeute an α- und β-D-Glucosiden erzielen. Dieses Verfahren kann im Multi-Kilogramm-Maßstab durchgeführt werden.
- Vishal Y Joshis Methode
Joshiet al. (2006) schlagen die Koenigs-Knorr-Methode für die stereoselektive Synthese von Alkyl-D-Glucopyranosiden durch Glykosylierung vor, mit Ausnahme der Verwendung von Lithiumcarbonat, das weniger teuer und toxisch ist als die herkömmliche Methode der Verwendung von Silber- oder Quecksilbersalzen . D-Glucose wird zuerst geschützt durch Bildung des Peracetats durch Zugabe von Essigsäureanhydrid in Essigsäure und dann Zugabe von Bromwasserstoff, der an der 5-Position bromiert. Bei Zugabe des Alkohols ROH und Lithiumcarbonat ersetzt das OR das Brom und beim Entschützen der acetylierten Hydroxyle wird das Produkt in relativ hoher Reinheit synthetisiert. Es wurde von Joshi et al. (2001), dass Lithium als Nukleophil fungiert, das den Kohlenstoff in der 5-Position angreift und durch einen Übergangszustand die Bromgruppe durch den Alkohol ersetzt wird. Vorteile dieses Verfahrens sowie seine Stereoselektivität und die geringen Kosten des Lithiumsalzes umfassen, dass es bei Raumtemperatur durchgeführt werden kann und seine Ausbeute relativ gut mit dem herkömmlichen Koenigs-Knorr-Verfahren vergleichbar ist.
Glykosidhydrolasen
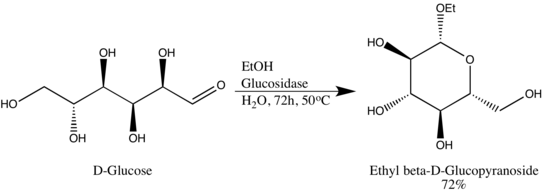
Glykosidhydrolasen (oder Glykosidasen) sind Enzyme , die glykosidische Bindungen brechen. Glykosidhydrolasen können typischerweise entweder auf α- oder auf β-glykosidische Bindungen wirken, jedoch nicht auf beide. Diese Spezifität ermöglicht es den Forschern, Glykoside in hohem epimeren Überschuss zu erhalten, ein Beispiel ist Wen-Ya Lus Umwandlung von D-Glucose in Ethyl-β-D-glucopyranosid unter Verwendung natürlich gewonnener Glucosidase. Es ist erwähnenswert, dass Wen-Ya Lu die Glucosidase in umgekehrter Weise verwendet, die der biologischen Funktionalität des Enzyms entgegengesetzt ist:
Glykosyltransferasen
Bevor Monosaccharideinheiten in lebenden Organismen in Glykoproteine, Polysaccharide oder Lipide eingebaut werden, werden sie typischerweise zuerst "aktiviert", indem sie über eine glykosidische Bindung an die Phosphatgruppe eines Nukleotids wie Uridindiphosphat (UDP), Guanosindiphosphat (GDP) gebunden werden. , Thymidindiphosphat (TDP) oder Cytidinmonophosphat (CMP). Diese aktivierten biochemischen Zwischenprodukte sind als Zuckernukleotide oder Zuckerdonatoren bekannt. Viele Biosynthesewege verwenden Mono- oder Oligosaccharide, die durch eine Diphosphatbindung an Lipide, wie Dolichol, aktiviert werden . Diese aktivierten Donoren sind dann Substrate für Enzyme, die als Glycosyltransferasen bekannt sind , die die Zuckereinheit vom aktivierten Donor auf ein akzeptierendes Nukleophil (das Akzeptorsubstrat) übertragen.
Disaccharid-Phosphorylasen
Zur Synthese von Glykosiden wurden in den letzten Jahrzehnten verschiedene biokatalytische Ansätze entwickelt, die unter Verwendung von „Glykosyltransferasen“ und „Glykosidhydrolasen“ zu den häufigsten Katalysearten zählen. Ersteres benötigt oft teure Materialien und letzteres zeigt oft geringe Ausbeuten, De Winter et al. untersuchten die Verwendung von Cellobiose-Phosphorylase (CP) zur Synthese von Alpha-Glykosiden in ionischen Flüssigkeiten. Die beste Bedingung für die Verwendung von CP wurde in Gegenwart von IL AMMOENG 101 und Ethylacetat gefunden.
Gerichtete Glykosylierungen
Es gibt mehrere chemische Ansätze, um die Selektivität von α- und β-glycosidischen Bindungen zu fördern . Die stark substratspezifische Natur der Selektivität und die Gesamtaktivität des Pyranosids können zu großen Syntheseschwierigkeiten führen. Die Gesamtspezifität der Glykosylierung kann verbessert werden, indem Ansätze verwendet werden, die die relativen Übergangszustände berücksichtigen, die der anomere Kohlenstoff während einer typischen Glykosylierung eingehen kann. Vor allem die Erkennung und Einbeziehung von Felkin-Ahn-Eisenstein-Modellen in ein rationales chemisches Design kann im Allgemeinen zuverlässige Ergebnisse liefern, vorausgesetzt, die Umwandlung kann im Übergangszustand dieser Art von Konformationskontrolle unterzogen werden.
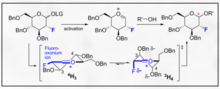
Durch Fluor gerichtete Glykosylierungen stellen einen ermutigenden Ansatzpunkt sowohl für die B-Selektivität als auch für die Einführung einer nicht-natürlichen biomimetischen C2-Funktionalität am Kohlenhydrat dar. Ein innovatives Beispiel von Bucher et al. bietet eine Möglichkeit, ein Fluoroxoniumion und das Trichloracetimidat zu nutzen, um die B-Stereoselektivität durch den Gauche-Effekt zu fördern. Diese vernünftige Stereoselektivität wird durch die Visualisierung der Felkin-Ahn-Modelle der möglichen Stuhlformen deutlich.
Diese Methode stellt einen ermutigenden Weg dar, um B-Ethyl, Isopropyl und andere Glycoside mit typischer Trichloracetimidat-Chemie selektiv zu integrieren.
O-verknüpfte Glykopeptide; pharmazeutische Anwendungen von O-glykosylierten Peptiden
O-gebundene Glycopeptide haben sich kürzlich in mehreren Tiermodellen mit Krankheitszuständen als ausgezeichnete ZNS-Durchlässigkeit und Wirksamkeit erwiesen. Außerdem ist einer der faszinierendsten Aspekte davon die Fähigkeit der O-Glykosylierung, die Halbwertszeit zu verlängern, die Clearance zu verringern und die PK/PD des aktiven Peptids über die Erhöhung der ZNS-Penetration hinaus zu verbessern. Die angeborene Verwendung von Zuckern als löslich machende Einheiten im Metabolismus der Phasen II und III (Glucuronsäuren) hat einen bemerkenswerten evolutionären Vorteil ermöglicht, da Säugetierenzyme nicht direkt entwickelt werden, um O-glykosylierte Produkte an größeren Einheiten abzubauen.
Die besondere Natur von O-gebundenen Glycopeptiden besteht darin, dass es zahlreiche Beispiele gibt, die das ZNS durchdringen. Als grundlegende Grundlage dieses Effekts wird angenommen, dass sie "Membran-Hopping" oder "Hopfen-Diffusion" beinhaltet. Es wird angenommen, dass der nicht-brownsche bewegungsgetriebene "Hopfendiffusions"-Prozess aufgrund der Diskontinuität der Plasmamembran auftritt. "Hopfendiffusion" kombiniert insbesondere freie Diffusion und interkomparmentäre Übergänge. Jüngste Beispiele umfassen insbesondere die hohe Permeabilität von Met-Enkephalin-Analoga neben anderen Peptiden. Das vollständige mOR-Agonist-Pentapeptid DAMGO ist auch nach Einführung der Glykosylierung ZNS-penetrant.
Verweise
- Marco Brito-Arias, "Synthesis and Characterization of Glycosides", zweite Auflage, Editorial Springer 2016.
Externe Links
- Definition von Glykosiden , aus dem IUPAC Compendium of Chemical Terminology, dem " Gold Book "
- Varki A et al. Grundlagen der Glykobiologie. Cold Spring Harbor Laborpresse; 1999. Online durchsuchbar