Schmidt Reaktion - Schmidt reaction
Die Schmidt-Reaktion ist eine organische Reaktion, bei der ein Azid mit einem Carbonylderivat , üblicherweise einem Aldehyd, Keton oder einer Carbonsäure, unter sauren Bedingungen unter Ausstoß von Stickstoff zu einem Amin oder Amid reagiert . Es ist benannt nach Karl Friedrich Schmidt (1887-1971), die es zuerst durch die erfolgreiche Umwandlung im Jahr 1924 berichtete Benzophenon und Stickstoffwasserstoffsäure zu Benzanilidderivaten . Überraschenderweise wurde die intramolekulare Reaktion erst 1991 berichtet, ist jedoch für die Synthese von Naturstoffen wichtig geworden.
| Schmidt-Reaktion | |
|---|---|
| Benannt nach | Karl Friedrich Schmidt |
| Reaktionstyp | Umlagerungsreaktion |
| Kennungen | |
| Organische Chemie Portal | Schmidt-Reaktion |
| RSC- Ontologie-ID | RXNO: 0000170 |
Die Reaktion ist wirksam mit Carbonsäuren, um Amine zu ergeben (oben), und mit Ketonen , um Amide zu ergeben (unten).
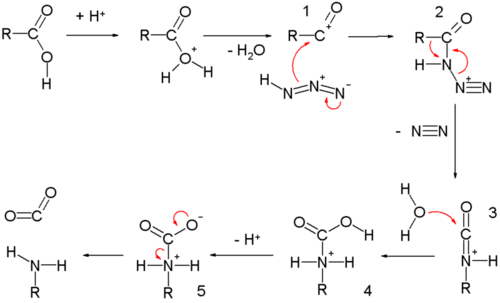
Reaktionsmechanismus
Die Reaktion ist eng mit der Curtius-Umlagerung verbunden, außer dass bei dieser Reaktion das Acylazid durch Reaktion der Carbonsäure mit Hydrazoesäure über die protonierte Carbonsäure in einem Verfahren hergestellt wird, das einer Fischer-Veresterung ähnelt . Eine Alternative, die die Bildung eines Acyliumions beinhaltet, wird wichtiger, wenn die Reaktion in konzentrierter Säure (> 90% Schwefelsäure) stattfindet. (Bei der Curtius-Umlagerung werden Natriumazid und ein Acylchlorid kombiniert, um das Acylazid-Zwischenprodukt quantitativ zu erzeugen, und der Rest der Reaktion findet unter neutralen Bedingungen statt.)
Die Carbonsäure - Schmidt - Reaktion beginnt mit Acylium Ionen 1 erhalten aus Protonierung und den Verlust von Wasser. Die Reaktion mit Salzsäure bildet das protonierte Azidoketon 2 , das eine Umlagerungsreaktion mit der Alkylgruppe R durchläuft und unter Ausstoß von Stickstoff über die CN-Bindung wandert. Das protonierte Isocyanat wird von Wasser angegriffen , das Carbamat 4 bildet , das nach Deprotonierung Kohlendioxid an das Amin verliert .
Im Reaktionsmechanismus für die Schmidt-Reaktion von Ketonen wird die Carbonylgruppe durch Protonierung zur nukleophilen Addition durch das Azid aktiviert , wobei Azidohydrin 3 gebildet wird , das bei einer Eliminierungsreaktion zu Diazoiminium 5 Wasser verliert . Eine der Alkyl- oder Arylgruppen wandert aus Kohlenstoff unter Stickstoffverlust zu Stickstoff, um ein Nitrilium-Zwischenprodukt 6 zu ergeben , wie bei der Beckmann-Umlagerung . Angriff durch Wasser wandelt 6 zu protoniert Imidsäure 7 , die den Verlust der protonendurchläuft an der Imidsäure ankommen Tautomer des fertigen Amids . In einem alternativen Mechanismus erfolgt die Migration bei 9 direkt nach der Protonierung des Zwischenprodukts 3 auf ähnliche Weise wie bei der Baeyer-Villiger-Reaktion zu protoniertem Amid 10 . Der Verlust eines Protons liefert wieder das Amid. Es wurde vorgeschlagen, dass die Dehydratisierung zu 3 zu 5 (und damit zum Beckmann-Weg) durch nichtwässrige Säuren wie konz. H 2 SO 4 , während wässrige Säuren wie konz. HCl begünstigt die Migration von 9 (Baeyer-Villiger-Weg). Diese Möglichkeiten wurden genutzt, um die Tatsache zu berücksichtigen, dass sich für bestimmte Substrate wie α-Tetralon die migrierende Gruppe je nach den verwendeten Bedingungen manchmal ändern kann, um eines der beiden möglichen Amide zu liefern.
Reaktionen mit Alkylaziden
Der Umfang dieser Reaktion wurde auf Reaktionen von Carbonylen mit Alkylaziden RN 3 erweitert . Diese Verlängerung wurde erstmals 1955 von JH Boyer berichtet (daher der Name Boyer-Reaktion ), beispielsweise die Reaktion von m-Nitrobenzaldehyd mit β-Azidoethanol :
Variationen mit intramolekularen Schmidt-Reaktionen sind seit 1991 bekannt. Dies sind Annulationsreaktionen , die bei der Synthese von Naturstoffen von Nutzen sind. wie Lactame und Alkaloide .