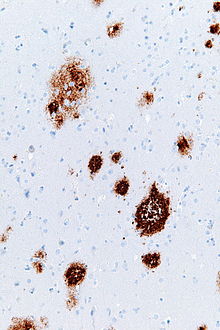
Amyloid-Plaques - Amyloid plaques
Amyloid-Plaques (auch als neuritische Plaques , Aβ-Plaques oder senile Plaques bekannt ) sind extrazelluläre Ablagerungen des Amyloid-Beta- (Aβ) -Proteins hauptsächlich in der grauen Substanz des Gehirns. Degenerative neuronale Elemente und eine Fülle von Mikroglia und Astrozyten können mit Amyloid-Plaques in Verbindung gebracht werden. Einige Plaques treten im Gehirn als Folge von Seneszenz (Alterung) auf, aber eine große Anzahl von Plaques und neurofibrillären Knäuel sind charakteristische Merkmale der Alzheimer-Krankheit . Abnorme Neuriten in Amyloid-Plaques sind gewundene, oft geschwollene Axone und Dendriten . Die Neuriten enthalten eine Vielzahl von Organellen und Zelltrümmern, und viele von ihnen enthalten charakteristische gepaarte helikale Filamente , die ultrastrukturelle Komponente der neurofibrillären Knäuel. Die Plaques sind in Form und Größe sehr variabel; in Gewebeschnitten immunhistochemisch für Aß umfassen sie eine logarithmisch-normale Größenverteilungskurve mit einem mittleren Plaquebereich von 400-450 Quadratmikrometer (um²). Besonders zahlreich sind die kleinsten Plaques (unter 200 µm²), die oft aus diffusen Ablagerungen von Aβ bestehen. Die scheinbare Größe von Plaques wird von der Art der Färbung beeinflusst, die verwendet wird, um sie zu erkennen, und von der Ebene, durch die sie zur Analyse unter dem Mikroskop geschnitten werden. Plaques bilden sich, wenn sich Aβ fehlfaltet und zu Oligomeren und längeren Polymeren aggregiert , von denen letztere charakteristisch für Amyloid sind . Es wird angenommen, dass falsch gefaltetes und aggregiertes Aβ neurotoxisch ist , insbesondere in seinem oligomeren Zustand.
Geschichte
1892 beschrieben Paul Blocq und Gheorghe Marinescu erstmals das Vorhandensein von Plaques in der grauen Substanz. Sie bezeichneten die Plaques als „Knötchen der Neurogliasklerose“. 1898 berichtete Emil Redlich von Plaques bei drei Patienten, von denen zwei eine klinisch bestätigte Demenz hatten . Redlich benutzte den Begriff „Miliarsklerose“, um Plaques zu beschreiben, weil er dachte, dass sie Hirsesamen ähnelten, und er war der erste, der die Läsionen als „Plaques“ bezeichnete. Zu Beginn des 20. Jahrhunderts stellte Oskar Fischer ihre Ähnlichkeit mit Actinomyces 'Drusen' (geodenartige Läsionen) fest, was ihn dazu veranlasste, den degenerativen Prozess als 'drusige Nekrose' zu bezeichnen. Alois Alzheimer wird in einer 1906 veröffentlichten Präsentation (veröffentlicht 1907) oft der erste Zusammenhang zwischen Plaques und Demenz zugeschrieben, aber dieser kurze Bericht konzentrierte sich hauptsächlich auf neurofibrilläre Knäuel, und Plaques wurden nur kurz erwähnt. Alzheimers erste substanzielle Beschreibung von Plaques erschien 1911. Oskar Fischer veröffentlichte dagegen 1907, 1910 und 1912 eine Reihe umfassender Untersuchungen zu Plaques und Demenz. 1911 schlug Max Bielschowsky die Amyloid-Natur der Plaque-Ablagerungen vor. Dies wurde später von Paul Divry bestätigt, der zeigte, dass Plaques, die mit dem Farbstoff Kongorot gefärbt wurden , die für Amyloide im Allgemeinen charakteristische optische Eigenschaft der Doppelbrechung aufweisen . 1911 führte Teofil Simchowicz den Begriff „senile Plaques“ ein, um ihr häufiges Vorkommen im Gehirn älterer Menschen zu bezeichnen. 1968 bestätigte eine quantitative Analyse von Gary Blessed, Bernard Tomlinson und Martin Roth die Assoziation seniler Plaques mit Demenz . Henryk Wisniewski und Robert Terry prägten 1973 den Begriff „neuritische Plaques“, um Plaques zu bezeichnen, die abnorme neuronale Prozesse (Neuriten) beinhalten. Ein wichtiger Fortschritt in den Jahren 1984 und 1985 war die Identifizierung von Aβ als dem Protein, das den Kern von Plaques bildet. Diese Entdeckung führte zur Entwicklung neuer Werkzeuge zur Untersuchung von Plaques, insbesondere von Antikörpern gegen Aβ, und stellte ein molekulares Ziel für die Entwicklung potenzieller Therapien für die Alzheimer-Krankheit dar. Die Kenntnis der Aminosäuresequenz von Aβ ermöglichte es den Wissenschaftlern auch, genetische Mutationen zu entdecken, die die autosomal-dominante Alzheimer-Krankheit verursachen, die alle die Wahrscheinlichkeit erhöhen, dass Aβ im Gehirn aggregiert.
Die Entstehung von Amyloid Beta
Amyloid Beta (Aβ) ist ein kleines Protein, meistens 40 oder 42 Aminosäuren lang, das von einem längeren Elternprotein namens Aβ-Precursor Protein (APP) freigesetzt wird . APP wird von vielen Zelltypen im Körper produziert, aber es kommt besonders häufig in Neuronen vor . Es ist ein Single-Pass- Transmembranprotein , das heißt, es passiert einmal die Zellmembranen . Das Aβ-Segment von APP befindet sich teilweise innerhalb der Membran und teilweise außerhalb der Membran. Um Aβ freizusetzen, wird APP nacheinander von zwei Enzymen gespalten : erstens durch Beta-Sekretase (oder β-Amyloid-spaltendes Enzym (BACE)) außerhalb der Membran und zweitens durch Gamma-Sekretase (γ-Sekretase), einen Enzymkomplex innerhalb der Membran . Die sequentiellen Aktionen dieser Sekretasen führen zu Aβ-Proteinfragmenten, die in den extrazellulären Raum freigesetzt werden. Durch die Aktivität von Synapsen wird die Ausschüttung von Aβ erhöht . Zusätzlich zu Aβ-Peptiden, die 40 oder 42 Aminosäuren lang sind, werden auch mehrere weniger häufig vorkommende Aβ-Fragmente erzeugt. Aβ kann auf verschiedene Weise chemisch modifiziert werden, und die Länge des Proteins und chemische Modifikationen können sowohl seine Aggregationsneigung als auch seine Toxizität beeinflussen.
Identifikation

Amyloid-Plaques sind mit dem Lichtmikroskop unter Verwendung einer Vielzahl von Färbetechniken sichtbar , einschließlich Silberfärbung , Kongorot , Thioflavin , Kresylviolett , PAS-Reaktion und lumineszierende konjugierte Oligothiophene (LCOs). Diese Verfahren färben oft verschiedene Komponenten der Plaques und sie variieren in ihrer Sensitivität Plaques können auch immunhistochemisch mit Antikörpern sichtbar gemacht werden, die gegen Aβ oder andere Komponenten der Läsionen gerichtet sind. Immunhistochemische Färbungen sind besonders nützlich, da sie sowohl empfindlich als auch spezifisch für Antigene sind, die mit Plaques assoziiert sind.
Komposition
Die Aβ-Ablagerungen, die Amyloid-Plaques umfassen, sind in Größe und Aussehen variabel. Unter dem Lichtmikroskop reichen sie von kleinen, dünnen Ansammlungen von wenigen Mikrometern Durchmesser bis hin zu viel größeren dichten oder diffusen Massen. Sogenannte „klassische Plaques“ bestehen aus einem kompakten Aβ-Amyloid-Kern, der von einer Korona aus etwas weniger dicht gepacktem Aβ umgeben ist. Klassische Plaques umfassen auch abnormale, geschwollene neuronale Prozesse ( Neuriten ), die von vielen verschiedenen Arten von Neuronen stammen, zusammen mit aktivierten Astrozyten und Mikroglia . Abnorme Neuriten und aktivierte Gliazellen sind für die meisten diffusen Plaques nicht typisch, und es wurde vermutet, dass diffuse Ablagerungen ein frühes Stadium bei der Entwicklung von Plaques sind.
Anatomische Verteilung
Dietmar Thal und seine Kollegen haben eine Abfolge von Stadien der Plaquebildung im Gehirn von Alzheimer-Patienten vorgeschlagen. In Phase 1 treten Plaques im Neocortex auf ; in Phase 2 erscheinen sie im Allocortex , der Hippocampusbildung und der Amygdala ; in Phase 3 sind die Basalganglien und das Zwischenhirn betroffen; in Phase 4 treten Plaques im Mittelhirn und in der Medulla oblongata auf ; und in Phase 5 erscheinen sie im Pons und im Kleinhirn . Daher können bei der Alzheimer-Krankheit im Endstadium Plaques in den meisten Teilen des Gehirns gefunden werden. Im Rückenmark sind sie selten .
Entstehung und Verbreitung
Die normale Funktion von Aβ ist nicht sicher, aber Plaques entstehen, wenn sich das Protein falsch faltet und sich im Gehirn durch einen Prozess der molekularen Templatbildung („Aussäen“) ansammelt. Mathias Jucker und Lary Walker haben diesen Prozess mit der Bildung und Ausbreitung von Prionen bei Krankheiten verglichen, die als spongiforme Enzephalopathien oder Prionenkrankheiten bekannt sind . Nach dem Prion-Paradigma falten sich bestimmte Proteine zu Formen, die reich an Beta-Faltblatt- Sekundärstrukturen sind . In diesem Zustand bewirken sie, dass andere Proteine des gleichen Typs die gleiche abnorme Beta-Faltblatt-reiche Struktur annehmen. Die fehlgefalteten Proteine haften aneinander und stapeln sich schließlich zu Oligomeren , die miteinander verschmelzen, um die für reife Plaques typischen Amyloidfibrillen zu bilden .
Beteiligung an Krankheiten
Reichliche Aβ-Plaques sind zusammen mit neurofibrillären Knäueln, die aus aggregiertem Tau-Protein bestehen , die beiden Läsionen, die für die neuropathologische Diagnose der Alzheimer-Krankheit erforderlich sind. Obwohl die Zahl der neurofibrillären Tangles stärker mit dem Demenzgrad korreliert als die Zahl der Plaques, weisen genetische und pathologische Befunde darauf hin, dass Aβ eine zentrale Rolle bei Risiko, Ausbruch und Fortschreiten der Alzheimer-Krankheit spielt. Von besonderer Bedeutung ist die längere (42 Aminosäuren) Spezies von Aβ, bekannt als Aβ42. Erhöhte Aβ-Spiegel sowie eine Erhöhung des Verhältnisses von Aβ42 zur 40-Aminosäuren-Form (Aβ40) sind wichtige frühe Ereignisse in der Pathogenese der Alzheimer-Krankheit.
Bis vor kurzem erforderte die Diagnose der Alzheimer-Krankheit eine mikroskopische Analyse von Plaques und Verfilzungen im Hirngewebe, normalerweise bei der Autopsie. Jedoch können Aβ-Plaques (zusammen mit der zerebralen Aβ-Amyloid-Angiopathie ) jetzt in den Gehirnen von lebenden Personen nachgewiesen werden. Dies geschieht durch die Herstellung von radioaktiv markierten Mitteln, die selektiv an Aβ-Ablagerungen im Gehirn binden, nachdem sie in den Blutkreislauf infundiert wurden. Die Liganden passieren die Blut-Hirn-Schranke und heften sich an aggregiertes Aβ, und ihre Retention im Gehirn wird durch Positronen-Emissions-Tomographie (PET) beurteilt . Darüber hinaus kann das Vorhandensein von Plaques und Tangles durch Messung der Mengen der Aβ- und Tau-Proteine in der Liquor cerebrospinalis abgeschätzt werden .
Auftreten
Die Wahrscheinlichkeit, Plaques im Gehirn zu haben, steigt mit zunehmendem Alter. Vom Alter von 60 Jahren (10 %) bis zum Alter von 80 Jahren (60 %) steigt der Anteil der Menschen mit senilen Plaques linear an. Frauen haben etwas häufiger Plaques als Männer. Sowohl Plaques als auch die Alzheimer-Krankheit treten häufiger bei alternden Personen mit Trisomie -21 ( Down-Syndrom ) auf. Es wird angenommen, dass dies auf die überschüssige Produktion von A&bgr; zurückzuführen ist, da sich das APP- Gen auf Chromosom 21 befindet, das beim Down-Syndrom in drei Kopien vorliegt.
Amyloid-Plaques treten natürlicherweise in den alternden Gehirnen nichtmenschlicher Arten auf, die von Vögeln bis hin zu Menschenaffen reichen. Bei nichtmenschlichen Primaten, den nächsten biologischen Verwandten des Menschen, wurden Plaques bei allen bisher untersuchten Arten gefunden. Neurofibrilläre Knäuel sind jedoch selten, und keine nicht-menschliche Spezies hat neben der vollständigen Neuropathologie der Alzheimer-Krankheit auch Demenz.
Forschung
Die Forschung war darauf ausgerichtet, die biochemischen , zytologischen und entzündlichen Eigenschaften von Plaques zu verstehen, die Entstehung und Vermehrung von Plaques im Gehirn zu bestimmen, genetische und umweltbedingte Risikofaktoren zu identifizieren, Methoden zu ihrer Erkennung im lebenden Gehirn zu entdecken und therapeutische Strategien zur Vorbeugung zu entwickeln oder sie zu entfernen. Die Forschung zur Bildung und Vermehrung von Amyloid-Plaques wurde durch die Entwicklung gentechnisch veränderter Mausmodelle beschleunigt . Trotz einiger Einschränkungen haben diese Modelle auch zur Entdeckung neuer therapeutischer Strategien beigetragen. Mit Hilfe von transgenen Nagetiermodellen wurde beispielsweise eine wachsende Vielfalt von Behandlungen identifiziert, die den Aβ-Spiegel und die Anzahl der Plaques im Gehirn reduzieren . Diese Strategien umfassen immuntherapeutische Ansätze und Inhibitoren der Sekretasen, die A&bgr; aus APP freisetzen. Solche Behandlungen werden jetzt zur Behandlung der Alzheimer-Krankheit klinisch evaluiert. Die bisherigen Ergebnisse deuten darauf hin, dass die Entfernung von Plaques bei Demenzpatienten wenig Nutzen bringt, möglicherweise weil das Gehirn bereits bei Auftreten der ersten Anzeichen und Symptome der Alzheimer-Krankheit stark geschädigt ist. Die Mikroglia-vermittelte Plaquebildung kann tatsächlich durch die Einkapselung von A&bgr; in dichte Plaquekerne von Vorteil sein. Aus diesem Grund glauben viele Forscher, dass eine frühere Hemmung der Aβ-Aggregation und der Plaquebildung erforderlich ist, um Tauopathie und die Demenz der Alzheimer-Krankheit zu verlangsamen oder zu verhindern . Andere Forschungen zielen darauf ab, die Entzündung zu verstehen, die oft mit Plaques verbunden ist, oder auf die Identifizierung von umweltbedingten, physiologischen und genetischen Risikofaktoren für die Bildung von Plaque und die Alzheimer-Krankheit.
Siehe auch
Verweise
- ^ a b Cras P; KawaiM; Lowery D; Gonzalez-DeWhittP; GreenbergB; Perry G (September 1991). "Senile Plaque-Neuriten bei der Alzheimer-Krankheit akkumulieren Amyloid-Vorläuferproteine" . Proceedings of the National Academy of Sciences of the United States of America . 88 (17): 7552–6. Bibcode : 1991PNAS...88.7552C . doi : 10.1073/pnas.88.17.7552 . PMC 52339 . PMID 1652752 .
- ^ Purves, Dale; Augustine, George J.; Fitzpatrick, David; Halle, William C.; LaManita, Anthony-Samuel; Weiß, Leonard E.; Mooney, Richard D.; Platt, Michael L. (2012). Neurowissenschaften (5. Aufl.). Sunderland, MA: Sinauer Associates. P. 713. ISBN 978-0-87893-695-3.
- ^ a b c d Dickson DW (1997). "Die Pathogenese der senilen Plaques" . J Neuropathol Exp Neurol . 56 (4): 321–339. doi : 10.1097/00005072-199704000-00001 . PMID 9100663 .
- ^ a b c d e f g h i j k l m n o Walker LC (2020). "Aβ-Plaques" . Kostenlose Neuropathologie . 1 (31): 31. doi : 10.17879/freeneuropathology-2020-3025 . PMC 7745791 . PMID 33345256 .
- ^ Ballard, C; Gauthier, S; Corbett, A; Brayne, C; Aarsland, D; Jones, E (19. März 2011). "Alzheimer-Krankheit". Lanzette . 377 (9770): 1019–31. doi : 10.1016/S0140-6736(10)61349-9 . PMID 21371747 . S2CID 20893019 .
- ^ Hyman BT; West-HL; Rebeck GW; Buldyrew SV; Mantegna RN; Ukleja M; Havlin S; Stanley HE (1995). "Quantitative Analyse von senilen Plaques bei der Alzheimer-Krankheit: Beobachtung der log-normalen Größenverteilung und molekularer Epidemiologie von Unterschieden, die mit dem Apolipoprotein-E-Genotyp und der Trisomie 21 (Down-Syndrom) verbunden sind" . Proceedings of the National Academy of Sciences of the United States of America . 92 (8): 3586–3590. Bibcode : 1995PNAS...92.3586H . doi : 10.1073/pnas.92.8.3586 . PMC 42212 . PMID 7724603 .
- ^ a b c Röhr D, Boon BD, et al. (Dezember 2020). "Die markierungsfreie Schwingungsbildgebung verschiedener Aβ-Plaque-Typen bei der Alzheimer-Krankheit zeigt sequentielle Ereignisse bei der Plaque-Entwicklung" . Acta Neuropathologica Mitteilungen . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Haass C; Selkoe DJ (2007). „Lösliche Proteinoligomere in der Neurodegeneration: Lehren aus dem Alzheimer-Amyloid-Beta-Peptid“. Nat Rev Mol Cell Biol . 8 (2): 101-112. doi : 10.1038/nrm2101 . PMID 17245412 . S2CID 32991755 .
- ^ Block, Paul; Marinesco, Georges (1892). Sur les lesions et la pathogenie de l'epilepsie dite essentielle . S. 445–6. OCLC 492619936 .
- ^ Buda O; Arsen D; Ceausu M; Dermengiu D; Curca GC (Januar 2009). „Georges Marinesco und die frühe Forschung in der Neuropathologie“. Neurologie . 72 (1): 88–91. doi : 10.1212/01.wnl.0000338626.93425.74 . PMID 19122036 . S2CID 45428057 .
- ^ Redlich E (1898). "Über miliare Sklerose der Hirnrinde bei seniler Atrophie". Jahrbücher für Psychiatrie und Neurologie . 17 : 208–216.
- ^ a b c Goedert M (2009). „Oskar Fischer und die Demenzforschung“ . Gehirn . 132 (4): 1102-1111. doi : 10.1093/hirn/awn256 . PMC 2668940 . PMID 18952676 .
- ^ Alzheimer, A (1907). „Uber eine eigenartige Erkranung der Hirnrinde“. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtliche Medizin . 64 : 146–8.
- ^ Divry P (1927). "Etude histo-chimique des plaques séniles". Journal Belge de Neurologie et de Psychiatrie . 9 : 643–657.
- ^ Buxbaum JN; Linke RP (2012). „Eine molekulare Geschichte der Amyloidosen“. Zeitschrift für Molekularbiologie . 421 (2–3): 142–159. doi : 10.1016/j.jmb.2012.01.024 . PMID 22321796 .
- ^ Simchowicz T.: Histologische Studien über die senile Demenz. in: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der pathologischen Anatomie der Geisteskrankheiten . Jena: G. Fischer, 1911, p. 267–444.
- ^ Ohry A; Buda O (2015). „Teofil Simchowicz (1879-1957): der Wissenschaftler, der senile Plaques in der Neuropathologie prägte“. Rumänisches Journal für Morphologie und Embryologie . 56 (4): 1545–1548. PMID 26743308 .
- ^ GrzybowskiA; Pieta A; Pugaczewska M (2017). "Teofil Simchowicz (1879-1957)" . Zeitschrift für Neurologie . 264 (8): 1831-1832. doi : 10.1007/s00415-017-8460-9 . PMC 5533842 . PMID 28315959 .
- ^ Gesegnetes G; Tomlinson BE; Roth M. (1968). „Der Zusammenhang zwischen quantitativen Messungen der Demenz und der senilen Veränderung in der zerebralen grauen Substanz älterer Personen“. Britisches Journal für Psychiatrie . 114 (512): 797–811. doi : 10.1192/bjp.114.512.797 . PMID 5662937 .
- ^ Wisniewski, Henryk M.; Terry, Robert D. (1973). „Kapitel 1: Überprüfung der Pathogenese der senilen Plaque“. In Zimmermann, HM (Hrsg.). Fortschritte in der Neuropathologie, Band 2 . Grune und Stratton. S. 1–26. ISBN 978-0-808-90775-6.
- ^ Glenner GG; Wong CW (1984). „Alzheimer-Krankheit: Erster Bericht über die Reinigung und Charakterisierung eines neuen zerebrovaskulären Amyloidproteins“. Biochemische und biophysikalische Forschungskommunikation . 120 (3): 885–890. doi : 10.1016/s0006-291x(84)80190-4 . PMID 6375662 .
- ^ Glenner GG; Wong CW (1984). „Alzheimer-Krankheit und Down-Syndrom: gemeinsame Nutzung eines einzigartigen zerebrovaskulären Amyloidfibrillenproteins“. Biochemische und biophysikalische Forschungskommunikation . 122 (3): 1131–1135. doi : 10.1016/0006-291x(84)91209-9 . PMID 6236805 .
- ^ Meister CL; Simms G; Weinman NA; Multhaup G; McDonald BL; Beyreuther K. (1985). "Amyloid-Plaque-Kernprotein bei Alzheimer-Krankheit und Down-Syndrom" . Proceedings of the National Academy of Sciences USA . 82 (12): 4245–4249. Bibcode : 1985PNAS...82.4245M . doi : 10.1073/pnas.82.12.4245 . PMC 397973 . PMID 3159021 .
- ^ a b c Walsh DM; Selkoe DJ (2020). „Amyloid-Beta-Protein und darüber hinaus: der Weg nach vorne bei der Alzheimer-Krankheit“. Aktuelle Meinung in Neurobiologie . 61 : 116–124. doi : 10.1016/j.conb.2020.02.003 . PMID 32197217 . S2CID 214600892 .
- ^ a b c d e f Lange JM; Holtzmann DM (2019). "Alzheimer-Krankheit: Ein Update zu Pathobiologie und Behandlungsstrategien" . Zelle . 179 (2): 312–339. doi : 10.1016/j.cell.2019.09.001 . PMC 6778042 . PMID 31564456 .
- ^ Walker LC (2015). „Proteopathische Stämme und die Heterogenität neurodegenerativer Erkrankungen“ . Jährliche Überprüfung der Genetik . 50 : 329–346. doi : 10.1146/annurev-genet-120215-034943 . PMC 6690197 . PMID 27893962 .
- ^ Selkoe, DJ (1999). „Kapitel 19: Biologie des β-Amyloid-Vorläuferproteins und der Mechanismus der Alzheimer-Krankheit“. In Terry, RD; Katzmann, R; Bick, KL; Sisodia, SS (Hrsg.). Alzheimer-Krankheit . Lippincott Williams und Wilkins. S. 293–310. ISBN 0-7817-1503-2.
- ^ a b c Haass C; Käther C; Thinakaran G; Sisodia S (2012). "Trafficking und proteolytische Verarbeitung von APP" . Cold Spring Harbor Perspektiven in der Medizin . 2 (5:a006270): a006270. doi : 10.1101/cshperspect.a006270 . PMC 3331683 . PMID 22553493 .
- ^ Suh YH; Checler F (September 2002). „Amyloid-Vorläuferprotein, Preseniline und Alpha-Synuclein: molekulare Pathogenese und pharmakologische Anwendungen bei der Alzheimer-Krankheit“. Pharmakologische Bewertungen . 54 (3): 469–525. doi : 10.1124/pr.54.3.469 . PMID 12223532 . S2CID 86686003 .
- ^ Dunys J; ValverdeA; Checler F (2018). "Sind N- und C-terminal verkürzte Aβ-Spezies wichtige pathologische Auslöser bei der Alzheimer-Krankheit?" . Zeitschrift für biologische Chemie . 293 (40): 15419–15428. doi : 10.1074/jbc.R118.003999 . PMC 6177599 . PMID 30143530 .
- ^ Kummer-Abgeordneter; Heneka MT (2014). "Abgeschnittene und modifizierte Amyloid-Beta-Spezies" . Alzheimer-Forschung und -Therapie . 6 (3): 28. doi : 10.1186/alzrt258 . PMC 4055046 . PMID 25031638 .
- ^ Lamy C, Duyckaerts C, Delaere P, et al. (1989). „Vergleich von sieben Färbemethoden für senile Plaques und neurofibrilläre Knäuel in einer prospektiven Serie von 15 älteren Patienten“. Neuropathologie und Angewandte Neurobiologie . 15 (6): 563–78. doi : 10.1111/j.1365-2990.1989.tb01255.x . PMID 2482455 . S2CID 25220224 .
- ^ Klingstedt T; Nilsson KPR (2012). „Lumineszierende konjugierte Poly- und Oligo-Thiophene: optische Liganden für die spektrale Zuordnung einer Vielzahl von Proteinaggregaten“. Transaktionen der Biochemischen Gesellschaft . 40 (4): 704–710. doi : 10.1042/BST20120009 . PMID 22817720 .
- ^ Mavrogiorgou P; Gertz HJ; Ferszt R; WolfR; Bär KJ; Juckel G (Dezember 2011). "Sind Routinemethoden gut genug, um senile Plaques und neurofibrilläre Knäuel in verschiedenen Gehirnregionen von Demenzpatienten zu färben?" (PDF) . Psychiatrie Danubina . 23 (4): 334–9. PMID 22075733 . Archiviert vom Original (PDF) am 11.08.2017 . Abgerufen 2014-06-22 .
- ^ Braak H; Thal DR; Ghebremedhin E; Del Tredici K (2011). "Stadien des pathologischen Prozesses bei der Alzheimer-Krankheit: Alterskategorien von 1 bis 100 Jahren" . Zeitschrift für Neuropathologie und experimentelle Neurologie . 70 (11): 960–969. doi : 10.1097/NEN.0b013e318232a379 . PMID 22002422 .
- ^ Thal DR; Rüb O; Orantes M; Braak H (2002). „Phasen der Abeta-Ablagerung im menschlichen Gehirn und ihre Bedeutung für die Entwicklung von AD“. Neurologie . 58 (12): 1791–1800. doi : 10.1212/wnl.58.12.1791 . PMID 12084879 . S2CID 41133337 .
- ^ Thal DR; WalterJ; Saido TC; Fändrich M. (2015). "Neuropathologie und Biochemie von Aβ und seinen Aggregaten bei der Alzheimer-Krankheit" . Acta Neuropathologica . 129 (2): 167–182. doi : 10.1007/s00401-014-1375-y . PMID 25534025 . S2CID 19701015 .
- ^ a b Jucker, M; Walker, LC (2013). "Selbstvermehrung pathogener Proteinaggregate bei neurodegenerativen Erkrankungen" . Natur . 501 (7465): 45–51. Bibcode : 2013Natur.501...45J . doi : 10.1038/nature12481 . PMC 3963807 . PMID 24005412 .
- ^ Wanderer LC; Jucker M (2015). „Neurodegenerative Erkrankungen: Erweiterung des Prionenkonzepts“ . Jährliche Überprüfung der Neurowissenschaften . 38 : 87–103. doi : 10.1146/annurev-neuro-071714-033828 . PMC 4803040 . PMID 25840008 .
- ^ Prusiner SB (1998). "Prionen" . Proceedings of the National Academy of Sciences USA . 95 (23): 13363–13383. Bibcode : 1998PNAS...9513363P . doi : 10.1073/pnas.95.23.13363 . PMC 33918 . PMID 9811807 .
- ^ Eisenberg D; Jucker M (2015). "Der Amyloidzustand von Proteinen bei menschlichen Krankheiten" . Zelle . 148 (6): 1188–1203. doi : 10.1016/j.cell.2012.02.022 . PMC 3353745 . PMID 22424229 .
- ^ Nelson PT, Alafuzoff I, Bigio EH, et al. (2012). "Korrelation von neuropathologischen Veränderungen der Alzheimer-Krankheit mit dem kognitiven Status: eine Übersicht über die Literatur" . Zeitschrift für Neuropathologie und experimentelle Neurologie . 71 (5): 362–381. doi : 10.1097/NEN.0b013e31825018f7 . PMC 3560290 . PMID 22487856 .
- ^ a b Findeis MA (November 2007). „Die Rolle des Amyloid-Beta-Peptid 42 bei der Alzheimer-Krankheit“. Pharmakologie & Therapeutik . 116 (2): 266–86. doi : 10.1016/j.pharmthera.2007.06.006 . PMID 17716740 .
- ^ Thal DR, Ronisz A, Tousseyn T, et al. (2019). "Verschiedene Aspekte der mit der Alzheimer-Krankheit zusammenhängenden Amyloid-β-Peptid-Pathologie und ihre Beziehung zur Amyloid-Positronen-Emissions-Tomographie-Bildgebung und Demenz" . Acta Neuropathologica Mitteilungen . 7 (1): 178. doi : 10.1186/s40478-019-0837-9 . PMC 6854805 . PMID 31727169 .
- ^ Mathis CA; Lopresti BJ; Ikonomovic MD; Klunk WE (2017). "Small-Molecule PET Tracer für die Bildgebung von Proteinopathien" . Seminare in Nuklearmedizin . 47 (5): 553–575. doi : 10.1053/j.semnuclmed.2017.06.003 . PMC 5657567 . PMID 28826526 .
- ^ Ritchie C; Smalagisches N; Noel-Storr AH; Ukoumunne O; Leitern EG; Martin S (2017). „CSF-Tau und das CSF-Tau/ABeta-Verhältnis für die Diagnose von Alzheimer-Demenz und anderen Demenzen bei Menschen mit leichter kognitiver Beeinträchtigung (MCI)“ . Cochrane Database of Systematic Reviews . 3 (3): CD010803. doi : 10.1002/14651858.CD010803.pub2 . PMC 6464349 . PMID 28328043 .
- ^ Hansson O; LehmannS; Otto M; Zetterberg H; Lewczuk P (2019). "Vor- und Nachteile der Verwendung des CSF Amyloid Beta (Abeta) 42/40-Verhältnisses bei der Diagnose der Alzheimer-Krankheit" . Alzheimer-Forschung und -Therapie . 11 (1): 34. doi : 10.1186/s13195-019-0485-0 . PMC 6477717 . PMID 31010420 .
- ^ a b Stam FC; Wigboldus JM; Smeulders AW (1986). "Altersinzidenz der senilen Hirnamyloidose" (PDF) . Pathologie - Forschung und Praxis . 181 (5): 558–562. doi : 10.1016/S0344-0338(86)80149-2 . PMID 3786248 .
- ^ Franke, M. (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen" . Berlin, Deutschland: Neuropathologische Abteilung. Archiviert vom Original am 19.07.2011.
- ^ a b Kopf E; Powell D; Gold-BT; Schmitt FA (2012). "Alzheimer-Krankheit beim Down-Syndrom" . European Journal of Neurodegenerative Disease . 1 (3): 353–364. PMC 4184282 . PMID 25285303 .
- ^ Heuer E; Rosen RF; Zitrone A; Walker LC (2012). "Nichtmenschliche Primatenmodelle der Alzheimer-ähnlichen zerebralen Proteopathie" . Aktuelles pharmazeutisches Design . 18 (8): 1159–1169. doi : 10.2174/138161212799315885 . PMC 3381739 . PMID 22288403 .
- ^ Wanderer LC; Jucker M (2017). „Die außergewöhnliche Anfälligkeit des Menschen für die Alzheimer-Krankheit“ . Trends in der Molekularen Medizin . 23 (6): 534–545. doi : 10.1016/j.molmed.2017.04.001 . PMC 5521004 . PMID 28483344 .
- ^ Jucker M (2010). „Die Vorteile und Grenzen von Tiermodellen für die translationale Forschung bei neurodegenerativen Erkrankungen“. Naturmedizin . 16 (11): 1210–1214. doi : 10.1038/nm.2224 . PMID 21052075 . S2CID 30167302 .
- ^ Myers A; McGonigle P (2010). „Überblick über transgene Mausmodelle für die Alzheimer-Krankheit“. Aktuelle Protokolle in den Neurowissenschaften . 89 (1:e81): 1210–1214. doi : 10.1002/cpns.81 . PMID 31532917 . S2CID 202024310 .
- ^ Huang Y, Happonen KE (April 2021). „Mikroglia verwenden TAM-Rezeptoren, um Amyloid-β-Plaques zu erkennen und zu verschlingen“ . Naturimmunologie . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Heppner FL; Ransohoff RM; Becher B (2015). „Immunangriff: Die Rolle der Entzündung bei der Alzheimer-Krankheit“. Nature Bewertungen Neurowissenschaften . 16 (6): 358–372. doi : 10.1038/nrn3880 . PMID 25991443 . S2CID 6116253 .
- ^ De Strooper B; Karran E. (2016). "Die zelluläre Phase der Alzheimer-Krankheit" . Zelle . 164 (4): 603–615. doi : 10.1016/j.cell.2015.12.056 . PMID 26871627 .
- ^ Killin LOJ; Starr JM; Shiue IJ; Russ TC (2016). „Umweltrisikofaktoren für Demenz: eine systematische Überprüfung“ . BMC Geriatrie . 16 (1): 175. doi : 10.1186/s12877-016-0342-y . PMC 5059894 . PMID 27729011 .
Weiterlesen
- Jellinger KA (2005). "Neurodegenerative Erkrankungen (ZNS) - Eine aktuelle Übersicht" (PDF) . Zeitschrift für Neurologie, Neurochirurgie und Psychiatrie . 6 (1): 9–18.
- Cruz L, Urbanc B, Buldyrev SV et al. (Juli 1997). "Aggregation und Disaggregation von senilen Plaques bei der Alzheimer-Krankheit" . Proceedings of the National Academy of Sciences of the United States of America . 94 (14): 7612–6. Bibcode : 1997PNAS...94.7612C . doi : 10.1073/pnas.94.14.7612 . PMC 23870 . PMID 9207140 .