Van 't Hoff-Gleichung - Van 't Hoff equation
Die Van ‚t Hoff - Gleichung bezieht sich die Änderung in der Gleichgewichtskonstante , K eq , einer chemischen Reaktion auf die Änderung der Temperatur , T , da die Standard - Enthalpie - Änderung , Δ r H ⊖ , für den Prozess. Es wurde 1884 vom niederländischen Chemiker Jacobus Henricus van 't Hoff in seinem Buch Études de dynamique chimique ( Studies in Dynamic Chemistry ) vorgeschlagen.
Die Van't Hoff-Gleichung wurde häufig verwendet, um die Änderungen der Zustandsfunktionen in einem thermodynamischen System zu untersuchen . Das aus dieser Gleichung abgeleitete Van't Hoff-Diagramm ist besonders effektiv bei der Schätzung der Enthalpie- und Entropieänderung einer chemischen Reaktion .
Gleichung
Zusammenfassung und Verwendungen
Der Standarddruck , wird verwendet, um den Referenzzustand für die Van ‚t Hoff - Gleichung zu definieren, die sind
wobei ln den natürlichen Logarithmus bezeichnet , die thermodynamische Gleichgewichtskonstante und R die ideale Gaskonstante ist . Diese Gleichung ist bei jeder Temperatur und bei allen Drücken exakt, abgeleitet aus der Forderung, dass die Gibbssche freie Reaktionsenergie im Zustand des chemischen Gleichgewichts stationär ist .
In der Praxis wird die Gleichung oft zwischen zwei Temperaturen integriert unter der Annahme, dass die Standardreaktionsenthalpie konstant ist (und außerdem wird diese oft auch gleich ihrem Wert bei Standardtemperatur angenommen ). Da in der Realität und die Standardreaktionsentropie für die meisten Prozesse mit der Temperatur variiert, ist die integrierte Gleichung nur ungefähr. Näherungen werden in der Praxis auch an die Aktivitätskoeffizienten innerhalb der Gleichgewichtskonstante gemacht.
Eine Hauptanwendung der integrierten Gleichung ist die Schätzung einer neuen Gleichgewichtskonstante bei einer neuen absoluten Temperatur unter der Annahme einer konstanten Standardenthalpieänderung über den Temperaturbereich. Um die integrierte Gleichung zu erhalten, ist es bequem, zuerst die Van 't Hoff-Gleichung umzuschreiben als
Das bestimmte Integral zwischen den Temperaturen T 1 und T 2 ist dann
In dieser Gleichung ist K 1 die Gleichgewichtskonstante bei absoluter Temperatur T 1 und K 2 ist die Gleichgewichtskonstante bei absoluter Temperatur T 2 .
Entwicklung aus der Thermodynamik
Kombination der bekannten Formel für die Gibbssche freie Reaktionsenergie
wobei S die Entropie des Systems ist, mit der Gibbs-Isothermengleichung der freien Energie:
wir erhalten
Die Differenzierung dieses Ausdrucks nach der Variablen T unter der Annahme, dass beide und unabhängig von T sind, liefert die Van 't Hoff-Gleichung. Es wird erwartet, dass diese Annahmen bei großen Temperaturschwankungen etwas zusammenbrechen.
Vorausgesetzt, dass und sind konstant, liefert die obige Gleichung ln K als lineare Funktion von 1/Tund ist daher als lineare Form der Van 't Hoff-Gleichung bekannt. Wenn der Temperaturbereich klein genug ist, damit die Standardreaktionsenthalpie und die Reaktionsentropie im Wesentlichen konstant sind, ergibt eine Auftragung des natürlichen Logarithmus der Gleichgewichtskonstante gegen die reziproke Temperatur eine gerade Linie. Die Neigung der Linie kann durch die multipliziert werden Gaskonstante R , den Standard zu erhalten Enthalpie Veränderung der Reaktion, und der Schnittpunkt kann durch multiplizieren R den Standard zu erhalten Entropie Veränderung.
Van 't Hoff-Isotherme
Die Van 't Hoff- Isotherme kann verwendet werden, um die Temperaturabhängigkeit der Gibbs-Reaktionsenergie für Nichtstandardzustandsreaktionen bei konstanter Temperatur zu bestimmen:
wo die Gibbs'sche freie Energie der Reaktion unter Nicht-Standard - Zuständen bei der Temperatur ist , ist die Gibbs'sche freie Energie für die Reaktion auf , ist das Ausmaß der Reaktion , und Q r ist der thermodynamische Reaktionsquotient . Da kann die Temperaturabhängigkeit beider Terme durch Van t'Hoff-Gleichungen als Funktion von T beschrieben werden . Dies findet Anwendungen im Bereich der Elektrochemie . insbesondere bei der Untersuchung der Temperaturabhängigkeit von Volta-Zellen.
Die Isotherme kann auch bei fester Temperatur verwendet werden, um das Massenwirkungsgesetz zu beschreiben . Befindet sich eine Reaktion im Gleichgewicht , gilt Q r = K eq und . Andernfalls sagt die Van 't Hoff-Isotherme die Richtung voraus, die das System verschieben muss, um das Gleichgewicht zu erreichen; wenn Δ r G <0 , wobei die Reaktion bewegt sich in der Vorwärtsrichtung, während , wenn Δ r G > 0 ist , die Reaktion bewegt sich in der Rückwärtsrichtung. Siehe Chemisches Gleichgewicht .
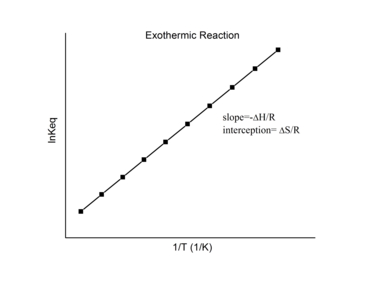
Van 't Hoff-Plot
Bei einer reversiblen Reaktion kann die Gleichgewichtskonstante bei verschiedenen Temperaturen gemessen werden. Diese Daten können in einem Graphen mit ln K eq auf der y- Achse und1/Tauf der x- Achse. Die Daten sollten eine lineare Beziehung haben, deren Gleichung durch Anpassen der Daten unter Verwendung der linearen Form der Van 't Hoff-Gleichung gefunden werden kann
Dieses Diagramm wird als "Van't Hoff-Diagramm" bezeichnet und wird häufig verwendet, um die Enthalpie und Entropie einer chemischen Reaktion abzuschätzen . Aus diesem Diagramm ist −Δ r H/R ist die Steigung, und Δ R S/R ist der Achsenabschnitt der linearen Anpassung.
Durch die Messung der Gleichgewichtskonstante , K eq , bei unterschiedlichen Temperaturen kann die Van ‚t Hoff - Diagramms verwendet werden , um eine Reaktion zu bewerten , wenn sich die Temperatur ändert. Wenn man die Steigung und den Achsenabschnitt aus dem Van 't Hoff-Diagramm kennt, können die Enthalpie und die Entropie einer Reaktion leicht erhalten werden mit
Der Van 't Hoff-Plot kann verwendet werden, um die Enthalpie einer chemischen Reaktion sowohl qualitativ als auch quantitativ schnell zu bestimmen. Diese Enthalpieänderung kann positiv oder negativ sein, was zu zwei Hauptformen des Van 't Hoff-Plots führt.
Endotherme Reaktionen
Bei einer endothermen Reaktion wird Wärme absorbiert, wodurch die Nettoenthalpieänderung positiv wird. Somit gilt nach der Definition der Steigung:
Wenn die Reaktion endotherm , Δ r H > 0 (und die Gaskonstante R > 0 ), so
Für eine endotherme Reaktion sollte der Van 't Hoff-Plot also immer eine negative Steigung aufweisen.
Exotherme Reaktionen
Bei einer exothermen Reaktion wird Wärme freigesetzt, wodurch die Nettoenthalpieänderung negativ wird. Somit gilt nach der Definition der Steigung:
Für eine exotherme Reaktion Δ r H < 0 , also
Für eine exotherme Reaktion sollte die Van 't Hoff-Darstellung daher immer eine positive Steigung aufweisen.
Fehlerausbreitung
Auf den ersten Blick scheint es unter Verwendung der Tatsache, dass Δ r G ⊖ = − RT ln K = Δ r H ⊖ − T Δ r S ⊖ ist, dass zwei Messungen von K ausreichen würden, um einen genauen Wert von Δ_r H ⊖ . zu erhalten :
wobei K 1 und K 2 die Gleichgewichtskonstantenwerte sind, die bei den Temperaturen T 1 bzw. T 2 erhalten werden. Jedoch ist die Genauigkeit von Δ r H ⊖ ist , Werte auf diese Weise erhaltenen stark abhängig von der Genauigkeit der konstanten Werte gemessen Gleichgewicht.
Die Verwendung der Fehlerfortpflanzung zeigt, dass der Fehler in Δ r H ⊖ ungefähr 76 kJ/mol mal die experimentelle Unsicherheit in (ln K 1 − ln K 2 ) oder ungefähr 110 kJ/mol mal die Unsicherheit in den ln K- Werten beträgt . Ähnliche Überlegungen gelten für die Reaktionsentropie aus Δ r S ⊖ =1/T(Δ H ⊖ + RT ln K ) .
Bemerkenswert ist , wenn die Gleichgewichtskonstanten an drei oder mehr Temperaturen gemessen, die Werte von Δ r H ⊖ und Δ R S ⊖ werden häufig durch erhaltenen geradlinigen Fitting . Es wird erwartet, dass der Fehler durch dieses Verfahren reduziert wird, obwohl sich die Annahme, dass die Reaktionsenthalpie und die Reaktionsentropie konstant sind, als richtig erweisen kann oder nicht. Wenn eine oder beide Größen eine signifikante Temperaturabhängigkeit aufweisen, sollte sich dies in einem nichtlinearen Verhalten im Van t'Hoff-Diagramm manifestieren; allerdings wären vermutlich mehr als drei Datenpunkte nötig, um dies zu beobachten.
Anwendungen des Van 't Hoff Plots
Van 't Hoff-Analyse
In der biologischen Forschung wird der Van 't Hoff-Plot auch als Van 't Hoff-Analyse bezeichnet. Es ist am effektivsten, um das bevorzugte Produkt in einer Reaktion zu bestimmen.
Angenommen, bei einer Reaktion bilden sich zwei Produkte B und C:
- a A + d D → b B,
- a A + d D → c C.
In diesem Fall kann K eq als Verhältnis von B zu C und nicht als Gleichgewichtskonstante definiert werden.
Wann B/C > 1, B ist das bevorzugte Produkt, und die Daten im Van 't Hoff-Diagramm liegen im positiven Bereich.
Wann B/C < 1, C ist das bevorzugte Produkt, und die Daten des Van 't Hoff-Diagramms liegen im negativen Bereich.
Anhand dieser Informationen kann eine Van 't Hoff-Analyse helfen, die am besten geeignete Temperatur für ein bevorzugtes Produkt zu bestimmen.
Im Jahr 2010 wurde eine Van 't Hoff-Analyse verwendet, um zu bestimmen, ob Wasser bevorzugt eine Wasserstoffbrücke mit dem C- Terminus oder dem N- Terminus der Aminosäure Prolin bildet. Die Gleichgewichtskonstante für jede Reaktion wurde bei einer Vielzahl von Temperaturen gefunden und ein Van 't Hoff-Diagramm erstellt. Diese Analyse zeigte, dass das Wasser enthalpisch die Wasserstoffbrückenbindung zum C- Terminus bevorzugt, entropisch jedoch die Wasserstoffbrückenbindung mit dem N- Terminus günstiger war. Insbesondere fanden sie, dass die C- Terminus-Wasserstoffbrücken um 4.2–6.4 kJ/mol begünstigt waren. Die N- Terminus-Wasserstoffbrücke wurde um 31–43 J/(K mol) begünstigt.
Diese Daten allein konnten nicht schließen, an welcher Stelle Wasser bevorzugt Wasserstoffbrückenbindungen eingehen wird, daher wurden zusätzliche Experimente durchgeführt. Es wurde festgestellt, dass bei niedrigeren Temperaturen die enthalpisch begünstigte Spezies, das an den C- Terminus wasserstoffgebundene Wasser , bevorzugt wurde. Bei höheren Temperaturen wurde die entropisch begünstigte Spezies, das Wasser mit Wasserstoffbrückenbindung am N- Terminus, bevorzugt.
Mechanistische Studien
Eine chemische Reaktion kann bei unterschiedlichen Temperaturen unterschiedliche Reaktionsmechanismen durchlaufen.
In diesem Fall kann ein Van 't Hoff-Plot mit zwei oder mehr linearen Anpassungen verwendet werden. Jede lineare Anpassung hat eine andere Steigung und einen anderen Achsenabschnitt, was auf unterschiedliche Änderungen der Enthalpie und Entropie für jeden unterschiedlichen Mechanismus hinweist. Das Van 't Hoff-Diagramm kann verwendet werden, um die Enthalpie und Entropieänderung für jeden Mechanismus und den bevorzugten Mechanismus bei verschiedenen Temperaturen zu finden.
In der Beispielfigur läuft die Reaktion Mechanismus 1 bei hoher Temperatur und Mechanismus 2 bei niedriger Temperatur ab.
Temperaturabhängigkeit
Das Van 't Hoff-Diagramm ist linear und basiert auf der stillschweigenden Annahme, dass Enthalpie und Entropie bei Temperaturänderungen konstant sind. In einigen Fällen ändern sich die Enthalpie und Entropie jedoch dramatisch mit der Temperatur. Eine Näherung erster Ordnung ist davon auszugehen, dass die beiden unterschiedlichen Reaktionsprodukte unterschiedliche Wärmekapazitäten aufweisen. Unter Einbeziehung dieser Annahme ergibt sich ein zusätzlicher TermC/T 2im Ausdruck für die Gleichgewichtskonstante als Funktion der Temperatur. Eine polynomielle Anpassung kann dann verwendet werden, um Daten zu analysieren, die eine nicht konstante Standardreaktionsenthalpie aufweisen:
wo
Somit kann die Enthalpie und Entropie einer Reaktion auch bei einer Temperaturabhängigkeit bei bestimmten Temperaturen bestimmt werden.
Selbstorganisation des Tensids
Die Van ‚t Hoff Bezug ist besonders nützlich für die Bestimmung der Mizellenbildung Enthalpie Δ H⊖
mvon Tensiden aus der Temperaturabhängigkeit der kritischen Micellenkonzentration (CMC):
Die Beziehung verliert jedoch ihre Gültigkeit, wenn die Aggregationszahl auch temperaturabhängig ist und stattdessen die folgende Beziehung verwendet werden sollte:
wobei G N + 1 und G N die freien Energien des Tensids in einer Mizelle mit der Aggregationszahl N + 1 bzw. N sind. Dieser Effekt ist besonders relevant für nichtionische ethoxylierte Tenside oder Polyoxypropylen-Polyoxyethylen-Blockcopolymere (Poloxamer, Pluronics, Synperonics). Die erweiterte Gleichung kann zur Extraktion von Aggregationszahlen selbstorganisierter Micellen aus kalorimetrischen Differential-Scanning- Thermogrammen genutzt werden.
Siehe auch
- Clausius-Clapeyron-Beziehung
- Van 't Hoff-Faktor ( ich )
- Gibbs-Helmholtz-Gleichung
- Löslichkeitsgleichgewicht



























![{\displaystyle {\begin{ausgerichtet}\Delta_{r}H_{1}&=-R\times {\text{Steigung}}_{1},&\Delta_{r}S_{1}&= R\times {\text{Achsenabschnitt}}_{1};\\[5pt]\Delta_{r}H_{2}&=-R\times {\text{Steigung}}_{2},&\ Delta _{r}S_{2}&=R\times {\text{intercept}}_{2}.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b7e4e668b82b9ee277ed6bf1aaae55cb12f15a8)




