Scheinbare molare Eigenschaft - Apparent molar property
Eine scheinbare molare Eigenschaft einer Lösungskomponente in einer Mischung oder Lösung ist eine Menge, die mit dem Zweck definiert wird, den Beitrag jeder Komponente zur Nichtidealität der Mischung zu isolieren . Es zeigt die Änderung der entsprechenden Lösungseigenschaft (z. B. Volumen ) an, wenn die gesamte Komponente der Lösung pro Mol hinzugefügter Komponente hinzugefügt wird. Es wird als offensichtlich bezeichnet, weil es die molare Eigenschaft dieser Komponente in Lösung zu repräsentieren scheint , vorausgesetzt, dass die Eigenschaften der anderen Lösungskomponenten während der Zugabe als konstant angenommen werden. Diese Annahme ist jedoch oft nicht gerechtfertigt, da die Werte der scheinbaren molaren Eigenschaften einer Komponente stark von ihren molaren Eigenschaften im reinen Zustand abweichen können.
Zum Beispiel wird das Volumen einer Lösung, die zwei Komponenten enthält, die als Lösungsmittel und gelöster Stoff identifiziert werden, angegeben durch
wobei V 0 das Volumen des reinen Lösungsmittels vor der Zugabe des gelösten Stoffes und sein Molvolumen (bei der gleichen Temperatur und dem gleichen Druck wie die Lösung) ist, n 0 die Molzahl des Lösungsmittels ist, das scheinbare Molvolumen des gelösten Stoffes ist und n 1 ist die Molzahl des gelösten Stoffes in der Lösung. Durch Dividieren dieser Beziehung durch die molare Menge einer Komponente kann eine Beziehung zwischen der scheinbaren molaren Eigenschaft einer Komponente und dem Mischungsverhältnis der Komponenten erhalten werden.
Diese Gleichung dient als Definition von . Der erste Term ist gleich dem Volumen der gleichen Lösungsmittelmenge ohne gelösten Stoff und der zweite Term ist die Volumenänderung bei Zugabe des gelösten Stoffes. kann dann als molares Volumen des gelösten Stoffes angesehen werden, wenn angenommen wird, dass das molare Volumen des Lösungsmittels durch die Zugabe des gelösten Stoffes unverändert bleibt. Diese Annahme muss jedoch oft als unrealistisch angesehen werden, wie in den Beispielen unten gezeigt, so dass sie nur als scheinbarer Wert beschrieben wird.
Eine scheinbare molare Menge kann in ähnlicher Weise für die als Lösungsmittel identifizierte Komponente definiert werden . Einige Autoren haben über scheinbare molare Volumina beider (flüssiger) Komponenten derselben Lösung berichtet. Dieses Verfahren kann auf ternäre und mehrkomponentige Mischungen ausgedehnt werden.
Scheinbare Mengen können auch mit Masse anstelle der Molzahl ausgedrückt werden. Dieser Ausdruck erzeugt scheinbare spezifische Größen, wie das scheinbare spezifische Volumen.
wobei die spezifischen Mengen mit Kleinbuchstaben gekennzeichnet sind.
Scheinbare (molare) Eigenschaften sind keine Konstanten (auch nicht bei einer gegebenen Temperatur), sondern sind Funktionen der Zusammensetzung. Bei unendlicher Verdünnung werden eine scheinbare molare Eigenschaft und die entsprechende partielle molare Eigenschaft gleich.
Einige allgemein verwendete scheinbare molare Eigenschaften sind die scheinbare molare Enthalpie , die scheinbare molare Wärmekapazität und das scheinbare molare Volumen.
Beziehung zur Molalität
Das scheinbare (molale) Volumen eines gelösten Stoffes kann als Funktion der Molalität b dieses gelösten Stoffes (und der Dichte der Lösung und des Lösungsmittels) ausgedrückt werden . Das Lösungsvolumen pro Mol des gelösten Stoffes ist
Subtrahiert man das Volumen des reinen Lösungsmittels pro Mol des gelösten Stoffes, erhält man das scheinbare Molvolumen:
Für mehr gelöste Stoffe wird die obige Gleichheit mit der mittleren Molmasse der gelösten Stoffe modifiziert, als ob sie ein einzelner gelöster Stoff mit der Molalität b T wären :
- ,
Die Summe der Produktmolalitäten – scheinbare molare Volumina der gelösten Stoffe in ihren binären Lösungen entspricht dem Produkt zwischen der Summe der Molalitäten der gelösten Stoffe und dem scheinbaren molaren Volumen der oben erwähnten ternären Mehrkomponentenlösung.
- ,
Verhältnis zum Mischungsverhältnis
Eine Beziehung zwischen dem scheinbaren molaren Anteil einer Mischungskomponente und dem molaren Mischungsverhältnis erhält man durch Division der Definitionsbeziehung
auf die Molzahl einer Komponente. Damit ergibt sich folgende Beziehung:
Verhältnis zu partiellen (molaren) Mengen
Beachten Sie die gegensätzlichen Definitionen zwischen partieller molarer Menge und scheinbarer molarer Menge: bei partiellen molaren Volumina , definiert durch partielle Ableitungen
- ,
man kann schreiben , und so gilt immer. Im Gegensatz dazu wird bei der Definition des scheinbaren molaren Volumens stattdessen das molare Volumen des reinen Lösungsmittels, , verwendet, was geschrieben werden kann als
- ,
zum Vergleich. Mit anderen Worten, wir nehmen an, dass sich das Volumen des Lösungsmittels nicht ändert, und verwenden das partielle Molvolumen, bei dem die Molzahl des gelösten Stoffes genau null ist ("das Molvolumen"). Somit ist in der Definition von Ausdruck für scheinbare Molvolumen ,
- ,
der Begriff wird dem reinen Lösungsmittel zugeschrieben, während das "verbleibende" Überschussvolumen, , als vom gelösten Stoff stammend betrachtet wird. Bei hoher Verdünnung mit haben wir , und somit konvergieren auch das scheinbare molare Volumen und das partielle molare Volumen des gelösten Stoffes: .
Quantitativ lässt sich der Zusammenhang zwischen partiellen molaren Eigenschaften und den scheinbaren aus der Definition der scheinbaren Mengen und der Molalität ableiten. Für Volumen,
Zusammenhang mit dem Aktivitätskoeffizienten eines Elektrolyten und seiner Solvathüllenzahl
Das Verhältnis R a zwischen dem scheinbaren Molvolumen eines gelösten Elektrolyten in einer konzentrierten Lösung und das Molvolumen des Lösungsmittels (Wasser) auf die statistische Komponente des verknüpft sein Aktivitätskoeffizient des Elektrolyten und dessen Solvathülle Nummer h :
,
wobei ν die Anzahl der Ionen aufgrund der Dissoziation des Elektrolyten ist und b die Molalität wie oben ist.
Beispiele
Elektrolyte
Das scheinbare Molvolumen des Salzes ist normalerweise geringer als das Molvolumen des festen Salzes. Festes NaCl hat beispielsweise ein Volumen von 27 cm 3 pro Mol, aber das scheinbare Molvolumen bei niedrigen Konzentrationen beträgt nur 16,6 cm³/Mol. Tatsächlich haben einige wässrige Elektrolyte negative scheinbare Molvolumina: NaOH –6,7, LiOH –6,0 und Na 2 CO 3 –6,7 cm 3 /Mol. Das bedeutet, dass ihre Lösungen in einer bestimmten Wassermenge ein geringeres Volumen haben als die gleiche Menge an reinem Wasser. (Der Effekt ist jedoch gering.) Der physikalische Grund ist, dass nahegelegene Wassermoleküle stark von den Ionen angezogen werden, so dass sie weniger Platz einnehmen.
Alkohol
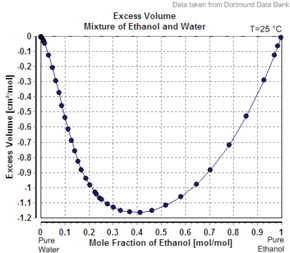
Ein weiteres Beispiel dafür, dass das scheinbare Molvolumen der zweiten Komponente geringer ist als ihr Molvolumen als Reinsubstanz, ist der Fall von Ethanol in Wasser. Bei 20 Massenprozent Ethanol hat die Lösung beispielsweise ein Volumen von 1,0326 Liter pro kg bei 20 °C, während reines Wasser 1,0018 l/kg (1,0018 cc/g) beträgt. Das scheinbare Volumen des zugesetzten Ethanols beträgt 1,0326 l – 0,8 kg x 1,0018 l/kg = 0,2317 l. Die Molzahl des Ethanols beträgt 0,2 kg / (0,04607 kg/mol) = 4,341 mol, so dass das scheinbare molare Volumen 0,2317 . beträgt L / 4,341 Mol = 0,0532 L / Mol = 53,2 cm³/Mol (1,16 cm³/g). Reines Ethanol hat jedoch bei dieser Temperatur ein Molvolumen von 58,4 cm³/Mol (1,27 cm³/g).
Wenn die Lösung ideal wäre , wäre ihr Volumen die Summe der unvermischten Komponenten. Das Volumen von 0,2 kg reinem Ethanol beträgt 0,2 kg x 1,27 l/kg = 0,254 l und das Volumen von 0,8 kg reinem Wasser beträgt 0,8 kg x 1,0018 l/kg = 0,80144 l, das ideale Lösungsvolumen wäre also 0,254 l + 0,80144 L = 1,055 l. Die Nichtidealität der Lösung spiegelt sich in einer leichten Abnahme (ungefähr 2,2 %, 1,0326 statt 1,055 l/kg) des Volumens des kombinierten Systems beim Mischen wider. Wenn der prozentuale Ethanolanteil gegen 100 % ansteigt, steigt das scheinbare Molvolumen auf das Molvolumen von reinem Ethanol an.
Elektrolyt – Nicht-Elektrolyt-Systeme
Scheinbare Größen können Wechselwirkungen in Elektrolyt-Nicht-Elektrolyt-Systemen unterstreichen, die Wechselwirkungen wie Einsalzen und Aussalzen zeigen , aber auch Einblicke in Ionen-Ionen-Wechselwirkungen, insbesondere durch ihre Abhängigkeit von der Temperatur, geben.
Mehrkomponentenmischungen oder -lösungen
Bei Mehrkomponentenlösungen können die scheinbaren molaren Eigenschaften auf verschiedene Weise definiert werden. Für das Volumen einer ternären (3-komponentigen) Lösung mit einem Lösungsmittel und zwei gelösten Stoffen als Beispiel würde es immer noch nur eine Gleichung geben , die nicht ausreicht, um die beiden scheinbaren Volumina zu bestimmen. (Dies steht im Gegensatz zu partiellen molaren Eigenschaften , die wohldefinierte intensive Eigenschaften der Materialien sind und daher in Mehrkomponentensystemen eindeutig definiert sind. Zum Beispiel wird partielles molares Volumen für jede Komponente i als definiert .)
Eine Beschreibung ternärer wässriger Lösungen berücksichtigt nur das gewichtete mittlere scheinbare Molvolumen der gelösten Stoffe, definiert als
- ,
wo ist das Lösungsvolumen und das Volumen von reinem Wasser. Dieses Verfahren kann auf Mischungen mit mehr als 3 Komponenten erweitert werden.
- ,
Die Summe der Produktmolalitäten – scheinbare molare Volumina der gelösten Stoffe in ihren binären Lösungen entspricht dem Produkt zwischen der Summe der Molalitäten der gelösten Stoffe und dem scheinbaren molaren Volumen der oben erwähnten ternären Mehrkomponentenlösung.
- ,
Ein anderes Verfahren besteht darin, das ternäre System als pseudobinär zu behandeln und das scheinbare Molvolumen jedes gelösten Stoffes in Bezug auf ein binäres System zu definieren, das beide anderen Komponenten enthält: Wasser und den anderen gelösten Stoff. Die scheinbaren molaren Volumina jedes der beiden gelösten Stoffe sind dann
- und
Das scheinbare Molvolumen des Lösungsmittels beträgt:
Dies ist jedoch eine unbefriedigende Beschreibung der volumetrischen Eigenschaften.
Das scheinbare Molvolumen zweier Komponenten oder gelöster Stoffe, die als eine Pseudokomponente angesehen werden oder nicht mit den Volumina partieller binärer Gemische mit einer gemeinsamen Komponente V ij , V jk verwechselt werden , die in einem bestimmten Mischungsverhältnis vermischt ein bestimmtes ternäres Gemisch bilden V oder V ijk .
Natürlich kann das Komplementvolumen einer Komponente in Bezug auf andere Komponenten der Mischung als Differenz zwischen dem Volumen der Mischung und dem Volumen einer binären Untermischung einer bestimmten Zusammensetzung definiert werden, wie:
Es gibt Situationen, in denen es keinen rigorosen Weg gibt, um zu definieren, was Lösungsmittel und was gelöst ist, wie bei flüssigen Mischungen (z. B. Wasser und Ethanol), die sich auflösen können oder nicht als Feststoff wie Zucker oder Salz. In diesen Fällen können und müssen allen Komponenten der Mischung scheinbare molare Eigenschaften zugeschrieben werden.
Siehe auch
- Volumenanteil
- Ideale Lösung
- Regelmäßige Lösung
- Enthalpieänderung der Lösung
- Mischungsenthalpie
- Blockdesign
- Verdünnungswärme
- Hydratationsenergie
- Ionentransportnummer
- Solvatationsschale
- Partielle molare Eigenschaft
- Überschüssige molare Menge
- Einsalzen
- Ternäres Grundstück
- Thermodynamische Aktivität
Verweise
- ^ Diese Bezeichnung ist willkürlich. Bei Mischungen aus zwei Flüssigkeiten kann beides als Lösungsmittel bezeichnet werden. Bei Mischungen aus einer Flüssigkeit und einem Feststoff wird die Flüssigkeit normalerweise als Lösungsmittel und der Feststoff als gelöster Stoff identifiziert, aber die Theorie ist immer noch gültig, wenn die Bezeichnungen umgekehrt sind.
- ^ Rock, Peter A., Chemical Thermodynamics, MacMillan 1969, S. 227-230 für Wasser-Ethanol-Gemische.
- ^ HH Ghazoyan und Sh. A. Markarian (2014) DENSITIES, EXCESS MOLAR AND PARTIAL MOLAR VOLUMES FOR DIETHYLSULFOXID MIT METHANOL ODER ETHANOL BINÄRSYSTEMEN IM TEMPERATURBEREICH 298,15 – 323,15 K PROCEDING OF THE YEREVAN State UNIVERSITY Nr.2, S.17-25. Siehe Tabelle 4.
- ^ Glückauf, E. (1955). „Der Einfluss der ionischen Hydratation auf Aktivitätskoeffizienten in konzentrierten Elektrolytlösungen“. Transaktionen der Faraday Society . 51 : 1235–1244. doi : 10.1039/TF9555101235 .
- ^ Herbert Harned und Benton Owen , The Physical Chemistry of Electrolytic Solutions , 1950, p. 253.
- ^ Berechnet aus Daten im CRC Handbook of Chemistry and Physics, 49. Auflage.
- ^ Zitronensäure Apelblat, Alexander (Springer 2014) S.50 ISBN 978-3-319-11233-6
- ^ Harned, Owen, op. zit. dritte Auflage 1958, S. 398-399
- ^ Zitronensäure Apelblat S.320
- ^ Apelblat S.320
Externe Links
- Scheinbare molare Eigenschaften: Lösungen: Hintergrund
- Die (p,ρ,T)-Eigenschaften und scheinbaren Molvolumina von Ethanollösungen von LiI oder ZnCl2
- Scheinbare molare Volumina und scheinbare molare Wärmekapazitäten von Pr(NO3)3(aq), Gd(NO3)3(aq), Ho(NO3)3(aq) und Y(NO3)3(aq) bei T = (288.15 .) , 298,15, 313,15 und 328.15) K und p = 0,1 MPa
- Isotopeneffekte für Elektrolyte scheinbare Eigenschaften