Protein spielt eine wichtige Rolle bei der Bildung umhüllter Vesikel
Clathrin ist ein Protein , das eine wichtige Rolle bei der Bildung umhüllter Vesikel spielt . Clathrin wurde erstmals 1976 von Barbara Pearse isoliert und benannt . Es bildet eine Triskelion- Form, die aus drei Clathrin-Schwerketten und drei leichten Ketten besteht. Wenn die Triskelien interagieren, bilden sie ein polyedrisches Gitter, das das Vesikel umgibt, daher der Name des Proteins, der vom lateinischen Clathrum abgeleitet ist, was Gitter bedeutet. Hüllproteine wie Clathrin werden verwendet, um kleine Vesikel aufzubauen, um Moleküle innerhalb der Zellen zu transportieren. Die Endozytose und Exozytose von Vesikeln ermöglicht es den Zellen, zu kommunizieren, Nährstoffe zu übertragen, Signalrezeptoren zu importieren, eine Immunantwort nach Probennahme aus der extrazellulären Welt zu vermitteln und die Zelltrümmer zu entfernen, die von einer Gewebeentzündung hinterlassen wurden. Der endozytische Weg kann von Viren und anderen Krankheitserregern gekapert werden, um während einer Infektion in die Zelle einzudringen.
Struktur
Das Clathrin-Triskelion besteht aus drei Clathrin-Schwerketten, die an ihren C-Termini wechselwirken , wobei jede ~190 kDa schwere Kette eine ~25 kDa leichte Kette fest daran gebunden hat. Die drei schweren Ketten bilden das strukturelle Rückgrat des Clathrin-Gitters, und es wird angenommen, dass die drei leichten Ketten die Bildung und den Abbau eines Clathrin-Gitters regulieren. Es gibt zwei Formen von Clathrin-Leichtketten, die mit a und b bezeichnet werden. Die schwere Clathrin-Hauptkette, die sich beim Menschen auf Chromosom 17 befindet, kommt in allen Zellen vor. Ein zweites Gen für die schwere Clathrin-Kette auf Chromosom 22 wird im Muskel exprimiert.
Die Clathrin-Schwerkette wird oft als Bein beschrieben, mit Subdomänen, die den Fuß (die N-terminale Domäne) repräsentieren , gefolgt von den Knöchel-, distalen Bein-, Knie-, proximalen Bein- und Trimerisierungsdomänen. Die N-terminale Domäne besteht aus einer siebenblättrigen β-Propeller-Struktur. Die anderen Domänen bilden eine Superhelix aus kurzen Alpha-Helices. Dies wurde ursprünglich aus der Struktur der proximalen Beindomäne bestimmt, die identifiziert wurde und aus einem kleineren Strukturmodul besteht, das als Clathrin-Schwerketten-Wiederholungsmotive bezeichnet wird. Die leichten Ketten binden hauptsächlich an den proximalen Beinteil der schweren Kette mit einer gewissen Wechselwirkung nahe der Trimerisierungsdomäne. Der β-Propeller am „Fuß“ von Clathrin enthält mehrere Bindungsstellen für die Interaktion mit anderen Proteinen.
Ein Clathrinkäfig mit einem einzigen blau hervorgehobenen Triskelion. Die CryoEM-Karte EMD_5119 wurde in UCSF Chimera gerendert und ein Clathrin-Triskelion wurde hervorgehoben.
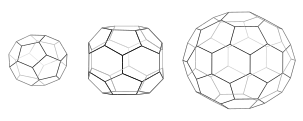
Jeder Käfig hat 12 Fünfecke. Mini-Schicht (links) hat 4 Sechsecke und tetraedrische Symmetrie wie in einem abgestumpften Triakis-Tetraeder. Sechseckiger Lauf (Mitte) hat 8 Sechsecke und D6-Symmetrie. Fußball (rechts) hat 20 Sechsecke und Ikosaeder-Symmetrie wie bei einem abgestumpften Ikosaeder.
Wenn sich Triskelien in Lösung zusammenfügen, können sie mit ausreichender Flexibilität interagieren, um 6-seitige Ringe ( Sechsecke ) zu bilden, die ein flaches Gitter ergeben, oder 5-seitige Ringe ( Fünfecke ), die für eine gekrümmte Gitterbildung notwendig sind. Wenn sich viele Triskelionen verbinden, können sie eine korbähnliche Struktur bilden. Die abgebildete Struktur besteht aus 36 Triskelien, von denen eine blau dargestellt ist. Eine weitere übliche Baugruppe ist ein abgeschnittenes Ikosaeder . Um ein Vesikel zu umschließen, müssen genau 12 Fünfecke im Gitter vorhanden sein.
In einer Zelle bindet Clathrin-Triskelion im Zytoplasma an ein Adapterprotein, das eine Membran gebunden hat, und verbindet jeweils einen seiner drei Füße mit der Membran. Clathrin kann nicht direkt an Membranen oder Fracht binden und verwendet dafür Adapterproteine. Dieses Triskelion bindet sich an andere membrangebundene Triskelien, um ein abgerundetes Gitter aus Sechsecken und Fünfecken zu bilden, das an die Platten eines Fußballs erinnert und die Membran zu einer Knospe zieht. Durch die Konstruktion verschiedener Kombinationen von 5-seitigen und 6-seitigen Ringen können sich Vesikel unterschiedlicher Größe zusammensetzen. Der kleinste üblicherweise abgebildete Clathrinkäfig, Minimantel genannt, hat 12 Fünfecke und nur zwei Sechsecke. Auch kleinere Käfige mit null Sechsecken bilden sich wahrscheinlich nicht aus dem nativen Protein, weil die Füße der Triskelien zu sperrig sind.
Funktion
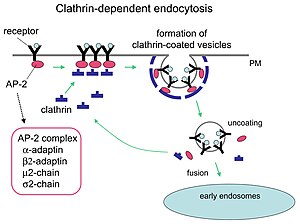
Mechanismus der Clathrin-vermittelten Endozytose.
Clathrin spielt eine entscheidende Rolle bei der Bildung abgerundeter Vesikel im Zytoplasma für den intrazellulären Transport. Clathrin-beschichtete Vesikel (CCV) sortieren Fracht selektiv an der Zellmembran , dem trans- Golgi-Netzwerk und den endosomalen Kompartimenten für mehrere Membrantransportwege. Nachdem ein Vesikel in das Zytoplasma knospt, zerfällt die Hülle schnell, wodurch das Clathrin recycelt werden kann, während das Vesikel an eine Vielzahl von Orten transportiert wird.
Adaptermoleküle sind für die Selbstorganisation und Rekrutierung verantwortlich. Zwei Beispiele für Adapterproteine sind AP180 und Epsin . AP180 wird bei der synaptischen Vesikelbildung verwendet. Es rekrutiert Clathrin zu Membranen und fördert auch dessen Polymerisation . Epsin rekrutiert auch Clathrin zu Membranen und fördert dessen Polymerisation und kann helfen, die Membran zu verformen, und somit können Clathrin-beschichtete Vesikel knospen. In einer Zelle bindet ein im Zytoplasma schwebendes Triskelion an ein Adapterprotein und verbindet jeweils einen seiner Füße mit der Membran. Der Skelion bindet sich an andere, die an der Membran befestigt sind, um ein polyedrisches Gitter, Skelion, zu bilden, das die Membran zu einer Knospe zieht. Das Skelett bindet nicht direkt an die Membran, sondern bindet an die Adapterproteine, die die Moleküle auf der Membranoberfläche erkennen.
Clathrin hat neben der Beschichtung von Organellen noch eine weitere Funktion . In sich nicht teilenden Zellen erfolgt die Bildung von Clathrin-beschichteten Vesikeln kontinuierlich. Die Bildung von Clathrin-beschichteten Vesikeln wird in Zellen, die eine Mitose durchlaufen, gestoppt . Während der Mitose bindet Clathrin im Komplex mit zwei anderen Proteinen an den Spindelapparat : TACC3 und ch-TOG/ CKAP5 . Clathrin hilft beim Konglomerat der Chromosomen, indem es die Kinetochorfasern der mitotischen Spindel stabilisiert . Die aminoterminale Domäne der schweren Kette von Clathrin und die TACC-Domäne von TACC3 bilden die Mikrotubuli-Bindungsoberfläche für TACC3/ch-TOG/Clathrin, um an die mitotische Spindel zu binden . Die Stabilisierung von Kinetochorfasern erfordert die trimere Struktur von Clathrin, um Mikrotubuli zu vernetzen.
Die Clathrin-vermittelte Endozytose (CME) reguliert viele zellphysiologische Prozesse wie die Internalisierung von Wachstumsfaktoren und Rezeptoren, das Eindringen von Krankheitserregern und die synaptische Übertragung. Es wird angenommen, dass zelluläre Eindringlinge den Nährstoffweg nutzen, um Zugang zu den Replikationsmechanismen einer Zelle zu erhalten. Bestimmte Signalmoleküle öffnen den Nährstoffweg. Zwei chemische Verbindungen namens Pitstop 1 und Pitstop 2, selektive Clathrin-Inhibitoren, können die pathogene Aktivität stören und so die Zellen vor dem Eindringen schützen. Diese beiden Verbindungen blockieren selektiv die endozytische Ligandenassoziation mit der terminalen Domäne von Clathrin in vitro. Die Spezifität dieser Verbindungen zur Blockierung der Clathrin-vermittelten Endozytose wurde jedoch in Frage gestellt.
Siehe auch
Verweise
Weiterlesen
-
Wakeham DE, Chen CY, Greene B, Hwang PK, Brodsky FM (Oktober 2003). "Die Selbstorganisation von Clathrin beinhaltet koordinierte schwache Wechselwirkungen, die für die zelluläre Regulation günstig sind" . Das EMBO-Journal . 22 (19): 4980–90. doi : 10.1093/emboj/cdg511 . PMC 204494 . PMID 14517237 .
-
Ford MG, Mills IG, Peter BJ, Vallis Y, Praefcke GJ, Evans PR, McMahon HT (September 2002). „Krümmung von Clathrin-beschichteten Gruben von Epsin angetrieben“. Natur . 419 (6905): 361–6. Bibcode : 2002Natur.419..361F . doi : 10.1038/nature01020 . PMID 12353027 . S2CID 4372368 .
-
Fotin A, Cheng Y, Sliz P, Grigorieff N, Harrison SC, Kirchhausen T, Walz T (2004). „Molekulares Modell für ein vollständiges Clathringitter aus der Elektronenkryomikroskopie“. Natur . 432 (7017): 573–9. Bibcode : 2004Natur.432..573F . doi : 10.1038/nature03079 . PMID 15502812 . S2CID 4396282 .
-
Mousavi SA, Malerød L, Berg T, Kjeken R (2004). "Clathrin-abhängige Endozytose" . Biochemische Zeitschrift . 377 (Teil 1): 1–16. doi : 10.1042/BJ20031000 . PMC 1223844 . PMID 14505490 .
-
Smith CJ, Grigorieff N., Pearse BM (September 1998). „Clathrin-Beschichtungen bei 21 A Auflösung: eine zelluläre Anordnung, die entwickelt wurde, um mehrere Membranrezeptoren zu recyceln“ . Das EMBO-Journal . 17 (17): 4943–53. doi : 10.1093/emboj/17.17.4943 . PMC 1170823 . PMID 9724631 . (Modell der Clathrin-Baugruppe)
-
Pérez-Gómez J, Moore I (März 2007). "Pflanzenendozytose: Es ist doch Clathrin" . Aktuelle Biologie . 17 (6): R217–9. doi : 10.1016/j.cub.2007.01.045 . PMID 17371763 . S2CID 17680351 . (Übersicht zur Beteiligung von Clathrin an der Pflanzenendozytose)
-
Royle SJ, Bright NA, Lagnado L (April 2005). „Clathrin wird für die Funktion der Mitosespindel benötigt“ . Natur . 434 (7037): 1152–7. Bibcode : 2005Natur.434.1152R . doi : 10.1038/nature03502 . PMC 3492753 . PMID 15858577 .
-
Hood FE, Williams SJ, Burgess SG, Richards MW, Roth D, Straube A, Pfuhl M, Bayliss R, Royle SJ (August 2013). "Koordination benachbarter Domänen vermittelt TACC3-ch-TOG-Clathrin-Zusammenbau und mitotische Spindelbindung" . J Cell Biol . 202 (3): 463–78. doi : 10.1083/jcb.201211127 . PMC 3734082 . PMID 23918938 .
-
Knuehl C, Chen CY, Manalo V, Hwang PK, Ota N, Brodsky FM (2006). "Neue Bindungsstellen auf Clathrin und Adaptern regulieren verschiedene Aspekte der Fellmontage" . Verkehr . 7 (12): 1688–700. doi : 10.1111/j.1600-0854.2006.00499.x . PMID 17052248 . S2CID 19087208 .
-
Edeling MA, Smith C, Owen D (2006). „Leben eines Clathrin-Mantels: Erkenntnisse aus Clathrin- und AP-Strukturen“. Nature Bewertungen Molekulare Zellbiologie . 7 (1): 32–44. doi : 10.1038/nrm1786 . PMID 16493411 . S2CID 19393938 .
-
Dutta D, Williamson CD, Cole NB, Donaldson JG (September 2012). „Pitstop 2 ist ein starker Inhibitor der Clathrin-unabhängigen Endozytose“ . PLOS ONE . 7 (9): e45799. Bibcode : 2012PLoSO...745799D . doi : 10.1371/journal.pone.0045799 . PMC 3448704 . PMID 23029248 .
Externe Links