Pleckstrin-Homologiedomäne - Pleckstrin homology domain
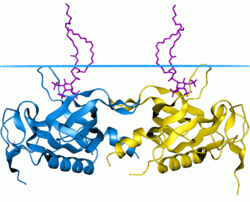 PH-Domäne der Tyrosin-Proteinkinase BTK
| |||||||||
| Bezeichner | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Symbol | PH | ||||||||
| Pfam | PF00169 | ||||||||
| Pfam- Clan | CL0266 | ||||||||
| InterPro | IPR001849 | ||||||||
| CLEVER | PH | ||||||||
| PROSITE | PDOC50003 | ||||||||
| SCOP2 | 1dyn / SCOPe / SUPFAM | ||||||||
| OPM-Superfamilie | 49 | ||||||||
| OPM-Protein | 1pls | ||||||||
| CDD | cd00821 | ||||||||
| |||||||||
Die Pleckstrin-Homologiedomäne ( PH-Domäne ) oder ( PHIP ) ist eine Proteindomäne mit etwa 120 Aminosäuren , die in einer Vielzahl von Proteinen vorkommt, die an der intrazellulären Signalübertragung oder als Bestandteile des Zytoskeletts beteiligt sind .
Diese Domäne kann Phosphatidylinositol- Lipide innerhalb biologischer Membranen (wie Phosphatidylinositol (3,4,5)-trisphosphat und Phosphatidylinositol (4,5)-bisphosphat ) und Proteine wie die βγ-Untereinheiten von heterotrimeren G-Proteinen und Proteinkinase C . binden . Durch diese Interaktionen spielen PH-Domänen eine Rolle bei der Rekrutierung von Proteinen zu verschiedenen Membranen , wodurch sie zu geeigneten Zellkompartimenten geleitet oder mit anderen Komponenten der Signalübertragungswege interagieren können .
Spezifität der Lipidbindung
Einzelne PH - Domänen besitzen Spezifitäten für Phosphoinositiden an verschiedenen Stellen innerhalb des phosphoryliert Inosit Ring, beispielsweise einige bind Phosphatidylinositol (4,5) -bisphosphate aber nicht phosphatidylinositol (3,4,5) -trisphosphate oder Phosphatidylinositol (3,4) -bisphosphate , während andere möglicherweise die erforderliche Affinität besitzen. Dies ist wichtig, da es die Rekrutierung verschiedener PH-Domänen enthaltender Proteine empfindlich für die Aktivitäten von Enzymen macht, die diese Stellen am Inositolring entweder phosphorylieren oder dephosphorylieren, wie z. B. Phosphoinositid-3-Kinase bzw. PTEN . Somit üben solche Enzyme einen Teil ihrer Wirkung auf die Zellfunktion aus, indem sie die Lokalisierung von stromabwärts gelegenen Signalproteinen modulieren, die PH-Domänen besitzen, die ihre Phospholipidprodukte binden können.
Struktur
Die 3D-Struktur mehrerer PH-Domänen wurde bestimmt. Alle bekannten Fälle haben eine gemeinsame Struktur, die aus zwei senkrechten antiparallelen Beta-Faltblättern besteht , gefolgt von einer C-terminalen amphipathischen Helix. Die Schleifen, die die Beta-Stränge verbinden, unterscheiden sich stark in der Länge, was den Nachweis der PH-Domäne relativ schwierig macht und gleichzeitig die Quelle der Spezifität der Domäne liefert. Der einzige konservierte Rest unter den PH-Domänen ist ein einzelnes Tryptophan, das sich innerhalb der Alpha-Helix befindet und dazu dient, den Kern der Domäne zu nukleieren.
Proteine mit PH-Domäne
PH-Domänen können in vielen verschiedenen Proteinen wie OSBP oder ARF gefunden werden . Die Rekrutierung für den Golgi-Apparat ist in diesem Fall sowohl von PtdIns als auch von ARF abhängig. Eine große Anzahl von PH-Domänen weist eine geringe Affinität für Phosphoinositide auf und es wird angenommen, dass sie als Proteinbindungsdomänen fungieren. Ein genomweiter Blick in Saccharomyces cerevisiae zeigte, dass die meisten der 33 Hefe-PH-Domänen tatsächlich promiskuitiv an Phosphoinositide binden, während sich nur eine (Num1-PH) hochspezifisch verhielt. Proteine, von denen berichtet wird, dass sie PH-Domänen enthalten, gehören zu den folgenden Familien:
- Pleckstrin , das Protein, bei dem diese Domäne zuerst nachgewiesen wurde, ist das Hauptsubstrat der Proteinkinase C in Blutplättchen. Pleckstrin enthält zwei PH-Domänen. ARAP-Proteine enthalten fünf PH-Domänen.
- Serin/Threonin-spezifische Proteinkinasen wie die Akt/Rac-Familie, Proteinkinase D1 und die trypanosomale NrkA-Familie.
- Nicht-Rezeptor-Tyrosinkinasen, die zur Btk/Itk/Tec-Unterfamilie gehören.
- Insulinrezeptorsubstrat 1 ( IRS-1 ).
- Regulatoren kleiner G-Proteine : 64 RhoGEFs der Dbl-ähnlichen Familie und mehrere GTPase-aktivierende Proteine wie ABR-, BCR- oder ARAP-Proteine.
- Zytoskelettproteine wie Dynamin (siehe InterPro : IPR001401 ), Caenorhabditis elegans kinesinähnliches Protein unc-104 (siehe InterPro : IPR001752 ), Spektrin-Beta-Kette, Syntrophin (2 PH-Domänen) und S. cerevisiae Nuclear Migration Protein NUM1.
- Oxysterol-bindende Proteine OSBP, S. cerevisiae OSH1 und YHR073w.
- Ceramidkinase , eine Lipidkinase, die Ceramide zu Ceramid-1-phosphat phosphoryliert .
- G-Protein-Rezeptor-Kinasen (GRK) der GRK2-Unterfamilie (beta-adrenerge Rezeptor-Kinasen): GRK2 und GRK3 .
Unterfamilien
Beispiele
Humane Gene, die Proteine kodieren, die diese Domäne enthalten, umfassen:
- ABR , ADRBK1 , ADRBK2 , AFAP , AFAP1 , AFAP1L1 , AFAP1L2 , AKAP13 , AKT1 , AKT2 , AKT3 , ANLN , APBB1IP , APPL1 , APPL2 , ARHGAP10 , ARHGAP12 , ARHGAP15 , ARHGAP21 , ARHGAP22 , ARHGAP23 , ARHGAP24 , ARHGAP25 , ARHGAP26 , ARHGAP27 , ARHGAP9 , ARHGEF16 , ARHGEF18 , ARHGEF19 , ARHGEF2 , ARHGEF3 , ARHGEF4 , ARHGEF5 , ARHGEF6 , ARHGEF7 , ARHGEF9 , ASEF2 ,
- BMX , BTK ,
- C20orf42 , C9orf100 , CADPS , CADPS2 , CDC42BPA , CDC42BPB , CDC42BPG , CENTA1 , CENTA2 , CENTB1 , CENTB2 , CENTB5 , CENTD1 , CENTD2 , CENTD3 , CENTG1 , CENTG2 , CENTG3 , CERK , CIT , CNKSR1 , CNKSR2 , COL4A3BP , CTGLF1 , CTGLF2 , CTGLF3 , * CTGLF4 , CTGLF5 , CTGLF6 ,
- DAB2IP , DAPP1 , DDEF1 , DDEF2 , DdeFL1 , DEF6 , DEPDC2 , DGKD , DGKH , DGKK , DNM1 , DNM2 , DNM3 , DOCK10 , DOCK11 , DOCK9 , DOK1 , DOK2 , DOK3 , DOK4 , DOK5 , DOK6 , DTGCU2 ,
- EXOC8 ,
- FAM109A , FAM109B , FARP1 , FARP2 , FGD1 , FGD2 , FGD3 , FGD4 , FGD5 , FGD6 ,
- GAB1 , GAB2 , GAB3 , GAB4 , GRB10 , GRB14 , GRB7 ,
- IRS1 , IRS2 , IRS4 , ITK , ITSN1 , ITSN2 ,
- KALRN , KIF1A , KIF1B , KIF1Bbeta ,
- MCF2 , MCF2L , MCF2L2 , MRIP , MYO10 ,
- NET1 , NGEF ,
- OBPH1 , OBSCN , OPHN1 , OSBP , OSBP2 , OSBPL10 , OSBPL11 , OSBPL3 , OSBPL5 , OSBPL6 , OSBPL7 , OSBPL8 , OSBPL9 ,
- PHLDA2 , PHLDA3 , PHLDB1 , PHLDB2 , PHLPP , PIP3-E , PLCD1 , PLCD4 , PLCG1 , PLCG2 , PLCH1 , PLCH2 , PLCL1 , PLCL2 , PLD1 , PLD2 , PLEK , PLEK2 , PLEKHA1 , PLEKHA2 , PLEKHA3 , PLEKHA4 , PLEKHA5 , PLEKHA6 , PLEKHA7 , PLEKHA8 , PLEKHB1 , PLEKHB2 , PLEKHC1 , PLEKHF1 , PLEKHF2 , PLEKHG1 , PLEKHG2 , PLEKHG3 , PLEKHG4 , PLEKHG5 , PLEKHG6 , PLEKHH1 , PLEKHH2 , PLEKHH3 , PLEKHJ1 , PLEKHK1 , PLEKHM1 , PLEKHM2 , PLEKHO1 , PLEKHQ1 , PREX1 , PRKCN , PRKD1 , PRKD2 , PRKD3 , PSCD1 , PSCD2 , PSCD3 , PSCD4 , PSD , PSD2 , PSD3 , PSD4 , RALGPS1 , RALGPS2 , RAPH1 ,
- RASA1 , RASA2 , RASA3 , RASA4 , RASAL1 , RASGRF1 , RGNEF , ROCK1 , ROCK2 , RTKN ,
- SBF1 , SBF2 , SCAP2 , SGEF , SH2B , SH2B1 , SH2B2 , SH2B3 , SH3BP2 , SKAP1 , SKAP2 , SNTA1 , SNTB1 , SNTB2 , SOS1 , SOS2 , SPATA13 , SPNB4 , SPTBN1 , SPTBN2 , SPTBN4 , SPTBN5 , STAP1 , SWAP70 , SYNGAP1 ,
- TBC1D2 , TEC , TIAM1 , TRIO , TRIOBP , TYL ,
- URP1 , URP2 ,
- VAV1 , VAV2 , VAV3 , VEPH1
Siehe auch
- Pleckstrin
- Die nicht verwandte FYVE-Domäne bindet Phosphatidylinositol-3-phosphat und wurde in über 60 Proteinen gefunden.
- Die GRAM-Domäne ist eine strukturell verwandte Proteindomäne.
Verweise
Externe Links
- Nash Lab Protein-Interaktionsdomänen - PH-Domänenbeschreibung
- UMich Orientation of Proteins in Membranes family/superfamily-51 - Berechnete Orientierungen von PH-Domänen in Membranen
