Herzinsuffizienz mit erhaltener Auswurffraktion - Heart failure with preserved ejection fraction
| Diastolische Dysfunktion | |
|---|---|
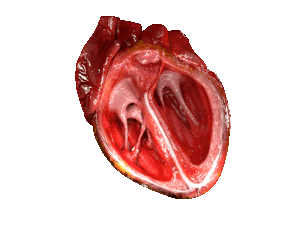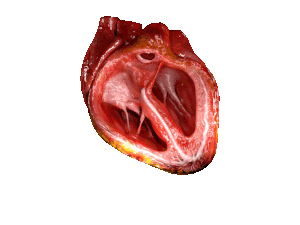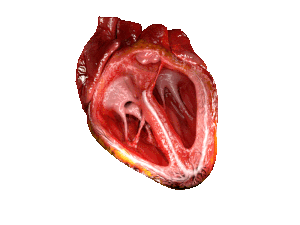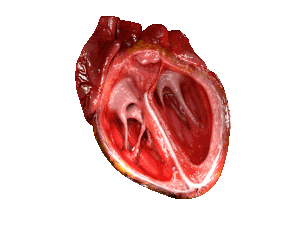 | |
| Bei Patienten mit HFpEF ist die linke Herzkammer (große Kammer rechts im Bild) versteift und hat nach dem Abpumpen von 🩸 Blut aus dem Herzen eine eingeschränkte Entspannung. | |
| Spezialität | Kardiologie |
Herzinsuffizienz mit erhaltener Auswurffraktion ( HFpEF ) ist eine Form der Herzinsuffizienz, bei der die Auswurffraktion – der prozentuale Anteil des Blutvolumens, das bei jedem Herzschlag aus dem linken Ventrikel ausgestoßen wird, geteilt durch das Blutvolumen bei maximaler Füllung des linken Ventrikels – ist normal, definiert als mehr als 50 %; Dies kann durch Echokardiographie oder Herzkatheteruntersuchung gemessen werden . Ungefähr die Hälfte der Menschen mit Herzinsuffizienz hat eine erhaltene Auswurffraktion, während die andere Hälfte eine Verringerung der Auswurffraktion aufweist, die als Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF) bezeichnet wird.
Risikofaktoren für HFpEF sind Bluthochdruck , Hyperlipidämie , Diabetes , Rauchen und obstruktive Schlafapnoe .
HFpEF zeichnet sich durch eine abnorme diastolische Funktion aus: Es kommt zu einer Zunahme der Steifheit des linken Ventrikels , was zu einer Abnahme der linksventrikulären Relaxation während der Diastole führt, was zu einem erhöhten Druck und/oder einer beeinträchtigten Füllung führt. Es besteht ein erhöhtes Risiko für Vorhofflimmern und pulmonale Hypertonie .
Der Zusammenhang zwischen diastolischer Herzinsuffizienz und HFpEF ist umstritten .
Anzeichen und Symptome
Klinische Manifestationen von HFpEF ähneln denen, die bei HFrEF beobachtet wurden, und umfassen Kurzatmigkeit einschließlich belastungsinduzierter Dyspnoe , paroxysmale nächtliche Dyspnoe und Orthopnoe , Belastungsintoleranz, Müdigkeit, erhöhter Jugularvenendruck und Ödeme .
Patienten mit HFpEF tolerieren Stress, insbesondere hämodynamische Veränderungen der ventrikulären Belastung oder erhöhte diastolische Drücke, schlecht. Häufig ist der systolische Blutdruck bei HFpEF dramatischer angestiegen, als es für HFrEF typisch ist.
Risikofaktoren
Zur Entwicklung von HFpEF tragen verschiedene Mechanismen bei, von denen viele noch zu wenig erforscht sind und im Dunkeln bleiben. Trotzdem gibt es klare Risikofaktoren, die zur Entwicklung von HFpEF beitragen.
Bluthochdruck , Fettleibigkeit , metabolisches Syndrom und Bewegungsmangel wurden als wichtige Risikofaktoren für verschiedene Arten von Herzerkrankungen, einschließlich HFpEF, identifiziert. Es gibt mechanistische und epidemiologische Beweise für einen Zusammenhang zwischen Insulinresistenz und HFpEF.
Dieser proinflammatorische Zustand kann auch Veränderungen im vaskulären Endothel des Herzens induzieren . Insbesondere durch die Verringerung der Verfügbarkeit von Stickstoffmonoxid , einem wichtigen Vasodilatator und Regulator der Proteinkinase G- Aktivität. Wenn die Aktivität der Proteinkinase G abnimmt, unterliegen die Kardiomyozyten hypertrophen Veränderungen. Endotheliale Zellen sind auch verantwortlich für die Herstellung von E-Selektin , die Rekruten Lymphozyten in das Gewebe unter dem Endothel , die anschließend freigeben transforming growth factor beta , die Förderung der Fibrose und somit ventrikuläre Versteifung. Es wird angenommen, dass Herzmakrophagen eine wichtige Rolle bei der Entwicklung von Fibrose spielen, da sie in HFpEF erhöht sind und profibrotische Zytokine wie IL-10 freisetzen . Weitere Untersuchungen zur Rolle der Entzündung bei HFpEF sind erforderlich.
Hypertonie
Zustände wie Bluthochdruck, die eine erhöhte linksventrikuläre Nachlast begünstigen, können sowohl auf grober als auch auf mikroskopischer Ebene zu strukturellen Veränderungen des Herzens führen. Es wird angenommen, dass ein erhöhter Druck in Verbindung mit einem entzündungsfördernden Zustand (Insulinresistenz, Fettleibigkeit) die ventrikuläre Versteifung und den Umbau fördert, was zu einem schlechten Herzzeitvolumen bei HFpEF führt. Es Änderungen sind eine Folge der linksventrikulären Muskel Hypertrophie durch den hohen Druck verursacht, was zu dem linken Ventrikel immer steif.
Ischämie
Bei einem hohen Anteil von HFpEF-Patienten wird eine Ischämie oder eine unzureichende Sauerstoffversorgung des Myokards beobachtet. Diese Ischämie kann sekundär zu einer koronaren Herzkrankheit oder ein Ergebnis der zuvor beschriebenen Veränderungen der Mikrovaskulatur sein . Ischämie kann zu einer beeinträchtigten Entspannung des Herzens führen; Wenn sich Myozyten nicht richtig entspannen, bleiben die Myosin-Kreuzbrücken intakt und erzeugen während der gesamten Diastole Spannung und erhöhen so die Belastung des Herzens. Dies wird als partielle persistente Systole bezeichnet . Ischämie kann sich auf unterschiedliche Weise manifestieren, entweder als Folge eines erhöhten Sauerstoffbedarfs des Gewebes oder einer verminderten Fähigkeit des Herzens, das Gewebe mit Sauerstoff zu versorgen. Ersteres ist das Ergebnis von Stress, wie Bewegung, während letztere das Ergebnis reduziert ist koronaren Flow.
Altern
Die kardiale Seneszenz oder zelluläre Verschlechterung, die als Teil des normalen Alterns auftritt, ähnelt stark den Manifestationen von HFpEF. Insbesondere sind der Verlust der Herzreserve , eine verminderte vaskuläre Compliance und eine diastolische Dysfunktion für beide Prozesse charakteristisch. Es wurde vermutet, dass HFpEF lediglich eine Beschleunigung eines normalen Alterungsprozesses darstellt.
Die senile systemische Amyloidose , die aus der Akkumulation von aggregiertem Wildtyp- Transthyretin als Teil des degenerativen Alterungsprozesses resultiert, entwickelt sich mit zunehmendem Alter als wichtiger und unterdiagnostizierter Faktor für HFpEF.
Sonstiges
Jeder Zustand oder Prozess, der zu einer Versteifung des linken Ventrikels führt, kann zu einer diastolischen Dysfunktion führen. Andere Ursachen für eine linksventrikuläre Versteifung sind:
- Aortenstenose jeglicher Ursache, bei der der Ventrikelmuskel als Folge der erhöhten Druckbelastung, die durch die Stenose auf ihn ausgeübt wird, hypertrophiert und damit steif wird.
- Diabetes
- Alter – ältere Patienten, vor allem, wenn sie Bluthochdruck haben.
Ursachen für isoliertes rechtsventrikuläres diastolisches Versagen sind selten. Zu diesen Ursachen gehören:
- Konstriktive Perikarditis
- Restriktive Kardiomyopathie , die Amyloidose (am häufigsten restriktiv), Sarkoidose und Fibrose umfasst.
Pathophysiologie
Grobe strukturelle Anomalien
Strukturelle Veränderungen, die bei HFpEF auftreten, unterscheiden sich oft radikal von denen bei Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF). Bei vielen Patienten kommt es zu einer erhöhten Verdickung der Ventrikelwand im Vergleich zur Kammergröße, die als konzentrische Hypertrophie bezeichnet wird . Dies führt zu einer erhöhten linksventrikulären Masse und wird typischerweise von einem normalen oder leicht reduzierten enddiastolischen Füllvolumen begleitet. Umgekehrt ist HFrEF typischerweise mit einer exzentrischen Hypertrophie verbunden , die durch eine Zunahme der Herzkammergröße ohne eine begleitende Zunahme der Wanddicke gekennzeichnet ist. Dies führt zu einer entsprechenden Zunahme des linksventrikulären enddiastolischen Volumens.
Zelluläre Anomalien
Zelluläre Veränderungen liegen im Allgemeinen Veränderungen in der Herzstruktur zugrunde. Bei HFpEF wurde gezeigt, dass Kardiomyozyten einen vergrößerten Durchmesser ohne Längenzunahme aufweisen; dies steht im Einklang mit der beobachteten konzentrischen ventrikulären Hypertrophie und der erhöhten linksventrikulären Masse. HFrEF-Kardiomyozyten weisen die entgegengesetzte Morphologie auf; erhöhte Länge ohne erhöhten Zelldurchmesser. Auch dies steht im Einklang mit der exzentrischen Hypertrophie, die in diesem Zustand beobachtet wird.
Veränderungen in der extrazellulären Umgebung sind bei Herzerkrankungen von erheblicher Bedeutung. Insbesondere die Regulation von Genen, die die Fibrose verändern, trägt zur Entwicklung und Progression von HFrEF bei. Diese Regulation ist dynamisch und beinhaltet Veränderungen in fibrillären Kollagenen durch vermehrte Ablagerung sowie Hemmung von Enzymen, die extrazelluläre Matrixkomponenten abbauen (Matrix- Metalloproteinasen , Kollagenasen ). Während die HFrEF im Frühstadium anfangs mit einer signifikanten Störung der extrazellulären Matrixproteine verbunden ist, kann es im weiteren Verlauf zu einem fibrotischen Ersatz des Myokards kommen, was zu Narbenbildung und erhöhtem interstitiellen Kollagen führt. Fibrotische Veränderungen in HFpEF sind variabler. Obwohl bei diesen Patienten typischerweise eine erhöhte Menge an Kollagen beobachtet wird, unterscheidet sie sich normalerweise nicht dramatisch von gesunden Personen.
Diastolische Dysfunktion
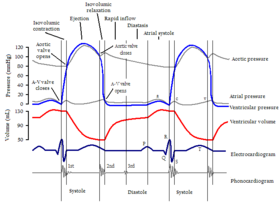
Diastolische Veränderungen der HFpEF sind der vorherrschende Faktor bei einer beeinträchtigten Herzfunktion und dem anschließenden klinischen Erscheinungsbild. Die diastolische Dysfunktion hat viele Facetten und ein bestimmter Patient kann verschiedene Kombinationen der folgenden Symptome aufweisen: unvollständige Myokardrelaxation, beeinträchtigte ventrikuläre Füllungsrate, erhöhter linker Vorhofdruck bei der Füllung, erhöhte passive Steifheit und verminderte Dehnbarkeit des Ventrikels, eingeschränkte Fähigkeit, die Frank -Starling-Mechanismus mit erhöhtem Leistungsbedarf , erhöhtem diastolischen Linksherz- oder Lungenvenendruck.
Ein diastolisches Versagen tritt auf, wenn der Ventrikel nicht richtig gefüllt werden kann, weil er sich aufgrund seiner dicken oder starren Wand nicht entspannen kann. Diese Situation stellt normalerweise eine konzentrische Hypertrophie dar . Im Gegensatz dazu weist die systolische Herzinsuffizienz normalerweise eine exzentrische Hypertrophie auf .
Das diastolische Versagen ist durch einen erhöhten diastolischen Druck im linken Ventrikel gekennzeichnet, trotz eines im Wesentlichen normalen/physiologischen enddiastolischen Volumens (EDV). Histologische Beweise, die eine diastolische Dysfunktion unterstützen, zeigen eine ventrikuläre Hypertrophie , eine erhöhte interstitielle Kollagenablagerung und eine Infiltration des Myokards. Diese Einflüsse führen zusammengenommen zu einer Abnahme der Dehnbarkeit und Elastizität (Dehnbarkeit) des Myokards. Als Folge wird das Herzzeitvolumen verringert. Wenn der linksventrikuläre diastolische Druck erhöht ist, muss auch der venöse Druck in der Lunge erhöht werden: Die linksventrikuläre Steifheit erschwert das Eindringen von Blut aus dem linken Vorhof. Dadurch steigt der Druck im Vorhof an und wird zurück auf das Lungenvenensystem übertragen, wodurch dessen hydrostatischer Druck erhöht und ein Lungenödem gefördert wird .
Es kann fehlgeleitet sein, das volumenüberladene Herz als diastolische Dysfunktion zu klassifizieren, wenn es sich steif und nicht nachgiebig verhält. Der Begriff diastolische Dysfunktion sollte nicht auf das erweiterte Herz angewendet werden. Dilatierte ("umgebaute") Herzen haben im Verhältnis zum diastolischen Druck ein erhöhtes Volumen und daher eine erhöhte ( nicht verringerte) Dehnbarkeit. Der Begriff diastolische Dysfunktion wird in diesem Fall manchmal fälschlicherweise verwendet, wenn eine erhöhte Flüssigkeitsretention zu einer Überfüllung des Herzens führt ( High-Output-Herzinsuffizienz ).
Obwohl der Begriff diastolische Herzinsuffizienz häufig verwendet wird, wenn Anzeichen und Symptome einer Herzinsuffizienz mit normaler linksventrikulärer systolischer Funktion vorliegen, ist dies nicht immer angemessen. Die diastolische Funktion wird durch das relative enddiastolische Volumen im Verhältnis zum enddiastolischen Druck bestimmt und ist daher unabhängig von der linksventrikulären systolischen Funktion. Eine Linksverschiebung der enddiastolischen Druck-Volumen-Beziehung (dh verminderte linksventrikuläre Dehnbarkeit) kann sowohl bei Patienten mit normaler als auch bei Patienten mit verminderter linksventrikulärer systolischer Funktion auftreten. Ebenso kann bei Patienten mit erweiterter linksventrikulärer und normaler systolischer Funktion eine Herzinsuffizienz auftreten. Dies wird häufig bei Herzklappenerkrankungen und High-Output-Herzinsuffizienz beobachtet. Keine dieser Situationen stellt eine diastolische Herzinsuffizienz dar.
Die Versteifung des linken Ventrikels trägt zu einer Herzinsuffizienz mit erhaltener Auswurffraktion bei, ein Zustand, der durch körperliche Betätigung verhindert werden kann.
Bei diastolischer Herzinsuffizienz ist das Blutvolumen in den Ventrikeln während der Diastole geringer als es sein sollte, und der Blutdruck in den Kammern ist erhöht.
Diastole
Während der Diastole sinkt der ventrikuläre Druck von der Spitze, die am Ende der Systole erreicht wird . Fällt dieser Druck unter den Vorhofdruck, öffnen sich die Vorhofklappen ( Mitralklappe links und Trikuspidalklappe rechts) und das Blut fließt aus den Vorhöfen in die Herzkammern. Zuerst werden die Ventrikel durch einen Druckgradienten gefüllt, aber gegen Ende ziehen sich die Vorhöfe zusammen (Atrial-Kick) und zwingen mehr Blut in die Ventrikel zu strömen. Die Vorhofkontraktion ist für etwa 20 % des gesamten Füllblutvolumens verantwortlich. (Bei Vorhofflimmern gehen diese zusätzlichen 20% Füllvolumen verloren und der Patient kann Symptome einer systolischen Herzinsuffizienz haben). Eine vollständige linksventrikuläre Füllung ist unerlässlich, um das maximale Herzzeitvolumen aufrechtzuerhalten. Die linksventrikuläre Füllung hängt von der ventrikulären Relaxation und Compliance , der Mitralklappenfläche, dem atrioventrikulären Gradienten, der atrialen Kontraktion und dem endsystolischen Volumen ab. Die Diastole hat vier Phasen: isovolumetrische Entspannung, schnelle Füllung, Diastase und Vorhofkontraktion. Alle diese Phasen können mittels Doppler-Echokardiographie ausgewertet werden .
Nicht-diastolische Dysfunktion
Obwohl HFpEF durch eine normale Ejektionsfraktion gekennzeichnet ist, ist dieser Parameter ein eher schlechter Index der kontraktilen Funktion des Herzens. Einige Studien haben gezeigt, dass Metriken der belastungsunabhängigen Kontraktilität (wie die linksventrikuläre Steifheit) eine verminderte systolische Funktion bei HFpEF-Patienten im Vergleich zu gesunden Kontrollpersonen zeigen und durch Gewebe-Doppler-Befunde bestätigt werden, die Veränderungen der Längskontraktion und Bewegungsanomalien aufzeigen. Während diese systolischen Beeinträchtigungen in Ruhe minimal sein können, werden sie bei erhöhter Belastung stärker ausgeprägt, wie bei körperlicher Betätigung.
Pulmonale Hypertonie und rechtsventrikuläre Dysfunktion
Die meisten HFpEF-Patienten weisen eine pulmonale Hypertonie auf, die signifikant mit einer erhöhten Morbidität und Mortalität verbunden ist. Der linksatriale und pulmonalvenöse Druck erhöht sich bei HFpEF aufgrund der diastolischen Insuffizienz, wodurch der Pulmonalarteriendruck erhöht wird. Bei Patienten mit fortgeschrittener HFpEF können sich Veränderungen im Lungengefäßsystem entwickeln, die zu einer präkapillären pulmonalen Hypertonie führen. Eine rechtsventrikuläre Dysfunktion ist auch bei HFpEF-Patienten häufig und tritt bei 20-35% der Patienten auf. Diese rechtsventrikuläre Dysfunktion tritt häufiger bei Patienten mit fortgeschrittener HFpEF sowie bei Patienten mit pulmonaler Hypertonie und niedrigeren Ejektionsfraktionen auf.
Pulsschlag
Das Herzzeitvolumen ist abhängig vom Schlagvolumen und der Herzfrequenz . Ein erheblicher Teil (55-77 %) der HFpEF-Patienten ist nicht in der Lage, die Herzfrequenz zu erhöhen, um den erhöhten Leistungsbedarf zu kompensieren (wie beim Training); Dies wird als chronotrope Inkompetenz bezeichnet. In Kombination mit dem charakteristischen Defizit des Schlagvolumens, das bei HFpEF-Patienten beobachtet wird, zeigen viele Personen eine schlechte Belastbarkeit.
Dyssynchronie
Bei bis zu 58 % der HFpEF-Patienten besteht eine nicht gleichzeitige Kontraktion des linken und rechten Ventrikels, Dysychronie . Dyssynchronie ist jedoch auch bei HFrEF häufig und ihre Rolle insbesondere bei HFpEF bleibt unklar. Während Therapien für Dyssynchronie, wie biventrikuläre Stimulation , HFrEF-Patienten Vorteile bringen, ist bei HFpEF-Patienten derzeit kein nennenswerter Nutzen erkennbar.
Systemische Anomalien
Patienten mit HFpEF zeigen neben kardialen Anomalien auch Veränderungen des Skelettmuskelstoffwechsels sowie der Fettverteilung und des Charakters. Die Bedeutung dieser Veränderungen zeigt sich darin, dass stabile, nicht dekompensierte Patienten von Bewegung zu profitieren scheinen; gezielt erhöhte VO2 max und Belastungstoleranz. Dieser Vorteil scheint jedoch auf Veränderungen der Muskeln und des Gefäßsystems zurückzuführen zu sein, im Gegensatz zu direkt am Herzen, das eine minimale Veränderung der Leistung nach dem Training zeigt.
Diagnose
HFpEF wird typischerweise mit Echokardiographie diagnostiziert . Techniken wie Katheterisierung sind invasive Verfahren und damit für Patienten mit reservierten komorbiden Bedingungen oder diejenigen , die im Verdacht stehen , HFpEF zu haben , aber klar , nicht-invasive Befunde fehlen. Die Katheterisierung stellt eine definitivere diagnostische Beurteilung dar, da Druck- und Volumenmessungen gleichzeitig und direkt vorgenommen werden. Bei beiden Techniken wird das Herz auf die linksventrikuläre diastolische Funktion untersucht. Wichtige Parameter umfassen die Rate der isovolumischen Relaxation, die Rate der ventrikulären Füllung und die Steifheit.
Häufig werden Patienten einer Stressechokardiographie unterzogen, bei der die obige Beurteilung der diastolischen Funktion während des Trainings erfolgt. Dies wird unternommen, weil Störungen in der Diastole während der erhöhten Belastungsanforderungen übertrieben werden. Übung erfordert eine erhöhte linksventrikuläre Füllung und nachfolgende Leistung. Typischerweise reagiert das Herz mit einer Erhöhung der Herzfrequenz und der Entspannungszeit. Bei Patienten mit HFpEF sind jedoch beide Reaktionen aufgrund der erhöhten ventrikulären Steifheit vermindert. Tests während dieses anspruchsvollen Zustands können Anomalien aufdecken, die in Ruhe nicht so wahrnehmbar sind.
Die diastolische Dysfunktion muss von der diastolischen Herzinsuffizienz unterschieden werden. Diastolische Dysfunktion kann bei älteren und anscheinend recht gesunden Patienten gefunden werden. Wenn die diastolische Dysfunktion eine abnormale mechanische Eigenschaft beschreibt, beschreibt die diastolische Herzinsuffizienz ein klinisches Syndrom. Die Mathematik, die die Beziehung zwischen dem Verhältnis von Systole zu Diastole in akzeptierten Begriffen des systolischen Endvolumens zum diastolischen Endvolumen beschreibt, impliziert viele mathematische Lösungen für Vorwärts- und Rückwärtsherzversagen.
Kriterien für die Diagnose einer diastolischen Dysfunktion oder diastolischen Herzinsuffizienz bleiben ungenau. Dies hat es schwierig gemacht, valide klinische Studien zur Behandlung der diastolischen Herzinsuffizienz durchzuführen. Das Problem wird durch die Tatsache verschlimmert, dass systolische und diastolische Herzinsuffizienz häufig koexistieren, wenn Patienten mit vielen ischämischen und nichtischämischen Ursachen der Herzinsuffizienz vorstellig werden. Das eng definierte diastolische Versagen wurde oft als "Herzinsuffizienz mit normaler systolischer Funktion" (dh linksventrikuläre Ejektionsfraktion von 60 % oder mehr) definiert. Die chagasische Herzkrankheit kann ein optimales akademisches Modell der diastolischen Herzinsuffizienz darstellen, das die systolische Funktion verschont.
Ein Patient hat eine diastolische Dysfunktion, wenn er Anzeichen und Symptome einer Herzinsuffizienz hat, aber die linksventrikuläre Ejektionsfraktion normal ist. Ein zweiter Ansatz besteht darin, einen erhöhten BNP- Spiegel bei Vorliegen einer normalen Ejektionsfraktion zu verwenden, um diastolische Herzinsuffizienz zu diagnostizieren. Die Übereinstimmung sowohl volumetrischer als auch biochemischer Messungen und Marker verleiht eine noch stärkere Terminologie bezüglich der wissenschaftlich-mathematischen Ausdrucksweise der diastolischen Herzinsuffizienz. Beides ist wahrscheinlich eine zu weit gefasste Definition für diastolische Herzinsuffizienz, und diese Patientengruppe wird genauer als eine Herzinsuffizienz mit normaler systolischer Funktion beschrieben. Die Echokardiographie kann zur Diagnose einer diastolischen Dysfunktion verwendet werden, ist jedoch eine begrenzte Methode, sofern sie nicht durch eine Stress-Bildgebung ergänzt wird . Die MUGA- Bildgebung ist ein früherer mathematischer Versuch, systolische von diastolischer Herzinsuffizienz zu unterscheiden.
Kein einziger echokardiographischer Parameter kann die Diagnose einer diastolischen Herzinsuffizienz bestätigen. Mehrere echokardiographische Parameter wurden als ausreichend empfindlich und spezifisch vorgeschlagen, einschließlich mitraler Einströmgeschwindigkeitsmuster, Lungenvenenströmungsmuster, E/A-Umkehrung, Gewebe-Doppler-Messungen und M-Modus-Echomessungen (dh der Größe des linken Vorhofs). Es wurden auch Algorithmen entwickelt, die mehrere echokardiographische Parameter kombinieren, um diastolisches Herzversagen zu diagnostizieren.
Es gibt vier grundlegende echokardiographische Muster der diastolischen Herzinsuffizienz, die von I bis IV eingestuft werden:
- Die mildeste Form wird als "abnormales Entspannungsmuster" oder diastolische Dysfunktion Grad I bezeichnet. Im Doppler-Echokardiogramm mit Mitralinfluss zeigt sich eine Umkehrung des normalen E/A-Verhältnisses . Dieses Muster kann sich bei einigen Patienten mit dem Alter normal entwickeln, und viele Patienten mit Grad I haben keine klinischen Anzeichen oder Symptome einer Herzinsuffizienz.
- Eine diastolische Dysfunktion vom Grad II wird als "pseudonormale Füllungsdynamik" bezeichnet. Dies wird als mittelschwere diastolische Dysfunktion angesehen und ist mit einem erhöhten Füllungsdruck im linken Vorhof verbunden. Diese Patienten haben häufiger Symptome einer Herzinsuffizienz, und viele haben aufgrund des erhöhten Drucks im linken Herzen eine Vergrößerung des linken Vorhofs.
Diastolische Dysfunktionen der Grade III und IV werden als "restriktive Füllungsdynamiken" bezeichnet. Dies sind beides schwere Formen der diastolischen Dysfunktion, und die Patienten neigen zu fortgeschrittenen Herzinsuffizienzsymptomen:
- Patienten mit diastolischer Dysfunktion der Klasse III zeigen im Echokardiogramm eine Umkehrung ihrer diastolischen Anomalien, wenn sie das Valsalva-Manöver durchführen. Dies wird als "reversible restriktive diastolische Dysfunktion" bezeichnet.
- Patienten mit diastolischer Dysfunktion der Klasse IV zeigen keine Reversibilität ihrer Echokardiogramm-Anomalien und leiden daher an einer "fixierten restriktiven diastolischen Dysfunktion".
Das Vorliegen einer diastolischen Dysfunktion der Klasse III oder IV ist mit einer signifikant schlechteren Prognose verbunden. Diese Patienten haben eine Vergrößerung des linken Vorhofs, und viele haben eine reduzierte linksventrikuläre Ejektionsfraktion, die auf eine Kombination aus systolischer und diastolischer Dysfunktion hinweist.
Die bildgebende volumetrische Definition der systolischen Herzleistung wird allgemein als Ejektionsfraktion akzeptiert . Die volumetrische Definition des Herzens in der Systole wurde zuerst von Adolph Fick als Herzzeitvolumen beschrieben . Fick kann leicht und kostengünstig in das Herzzeitvolumen und die Auswurffraktion invertiert werden, um die Diastole mathematisch zu beschreiben . Ein Rückgang der Ejektionsfraktion gepaart mit einem Rückgang des E/A-Verhältnisses scheint ein stärkeres Argument zur Unterstützung einer mathematischen Definition der diastolischen Herzinsuffizienz zu sein.
Ein weiterer Parameter zur Beurteilung der diastolischen Funktion ist die E/E'-Verhältnis , das das Verhältnis der Mitralspitzengeschwindigkeit der frühen Füllung (E) zur frühen diastolischen Mitralringgeschwindigkeit (E') ist. Von einer diastolischen Dysfunktion wird ausgegangen, wenn das E/E'-Verhältnis 15 überschreitet.
Neuere echokardiographische Techniken wie das Speckle-Tracking zur Dehnungsmessung, insbesondere für den linken Vorhof, werden zunehmend für die Diagnose von HFpEF eingesetzt.
Behandlung
Trotz steigender Inzidenz von HFpEF blieben wirksame Ansätze für Therapeutika weitgehend erfolglos. Gegenwärtig richten sich die Behandlungsempfehlungen auf die Linderung der Symptome und auf Begleiterkrankungen. Dazu gehört häufig die Gabe von Diuretika zur Linderung von Komplikationen, die mit einer Volumenüberlastung einhergehen , wie zum Beispiel Beinschwellungen und Bluthochdruck.
Zu den häufig auftretenden Zuständen, die behandelt werden müssen und für die unabhängige Empfehlungen für die Standardbehandlung gelten, gehören Vorhofflimmern , koronare Herzkrankheit, Bluthochdruck und Hyperlipidämie. Es gibt besondere Faktoren, die für HFpEF einzigartig sind und die bei der Therapie berücksichtigt werden müssen. Leider bieten derzeit verfügbare randomisierte klinische Studien, die sich mit dem therapeutischen Abenteuer für diese Erkrankungen bei HFpEF befassen, widersprüchliche oder begrenzte Beweise.
Spezifische Aspekte der Therapie sollten bei HFpEF vermieden werden, um eine Verschlechterung des Zustands zu verhindern. Zu den Überlegungen, die auf Herzinsuffizienz verallgemeinert werden können, gehören die Vermeidung einer schnellen Herzfrequenz, Erhöhung des Blutdrucks, Entwicklung von Ischämie und Vorhofflimmern. Spezifischer für HFpEF ist die Vermeidung einer Reduzierung der Vorspannung . Da Patienten eine normale Ejektionsfraktion, aber ein reduziertes Herzzeitvolumen aufweisen, reagieren sie besonders empfindlich auf Veränderungen der Vorbelastung und können schnell Anzeichen eines Leistungsversagens zeigen. Dies bedeutet, dass die Verabreichung von Diuretika und Vasodilatatoren sorgfältig überwacht werden muss.
HFrEF und HFpEF stellen unterschiedliche Einheiten in Bezug auf Entwicklung und effektives therapeutisches Management dar. Insbesondere die kardiale Resynchronisation, die Verabreichung von Betablockern und Angiotensin-Converting-Enzym-Inhibitoren werden bei HFrEF mit guter Wirkung angewendet, sind jedoch bei der Verringerung der Morbidität und Mortalität bei HFpEF weitgehend unwirksam. Viele dieser Therapien sind bei der Verringerung des Ausmaßes der Herzdilatation und der Erhöhung der Ejektionsfraktion bei HFrEF-Patienten wirksam. Es überrascht nicht, dass sie angesichts ihres nicht erweiterten Phänotyps und ihrer relativ normalen Ejektionsfraktion keine Verbesserung bei HFpEF-Patienten bewirken. Das Verständnis und die gezielten Mechanismen von HFpEF sind daher für die Entwicklung von Therapeutika von wesentlicher Bedeutung.
Randomisierte Studien an HFpEF-Patienten haben gezeigt, dass Bewegung die linksventrikuläre diastolische Funktion und die Entspannungsfähigkeit des Herzens verbessert und mit einer verbesserten aeroben Leistungsfähigkeit einhergeht . Der Nutzen, den Patienten aus körperlicher Betätigung zu ziehen scheinen, scheint kein direkter kardialer Effekt zu sein, sondern ist eher auf Veränderungen des peripheren Gefäßsystems und der Skelettmuskulatur zurückzuführen, die bei HFpEF-Patienten Anomalien aufweisen.
Die Patienten sollten regelmäßig untersucht werden, um das Fortschreiten der Erkrankung, das Ansprechen auf Interventionen und die Notwendigkeit einer Therapieänderung zu bestimmen. Die Fähigkeit, tägliche Aufgaben zu erledigen, der hämodynamische Status, die Nierenfunktion, der Elektrolythaushalt und die Serumspiegel der natriuretischen Peptide sind wichtige Parameter. Das Verhaltensmanagement ist bei diesen Patienten wichtig und es wird empfohlen, dass Personen mit HFpEF Alkohol, Rauchen und eine hohe Natriumaufnahme vermeiden.
Pharmakologische Therapie
Indikationen
Die Behandlung von HFpEF hängt in erster Linie von der Behandlung der Symptome und der sich verschlimmernden Zustände ab. Die Rolle spezifischer Behandlungen für diastolische Dysfunktion an sich ist noch unklar.
Nutzen
Derzeit wird eine Behandlung mit ACE-Hemmern, Kalziumkanalblockern, Betablockern und Angiotensinrezeptorblockern eingesetzt, die jedoch bei HFpEF-Patienten keinen nachgewiesenen Nutzen haben. Darüber hinaus sollte die Anwendung von Diuretika oder anderen Therapien, die die Belastungsbedingungen oder den Blutdruck verändern können, mit Vorsicht angewendet werden. Es wird nicht empfohlen, Patienten mit Phosphodiesterase-5-Hemmern oder Digoxin zu behandeln .
Agenten
Mineralocorticoid-Rezeptor-Antagonisten
Ein Antimineralocorticoid wird derzeit für Patienten mit HFpEF empfohlen, die erhöhte Spiegel des natriuretischen Peptids im Gehirn aufweisen . Spironolacton ist das erste Mitglied dieser Medikamentenklasse und wird am häufigsten eingesetzt. Während der Behandlung sollten die Serumkaliumspiegel sowie die Nierenfunktion, insbesondere die glomeruläre Filtrationsrate, überwacht werden.
Betablocker
Betablocker spielen bei der HFpEF-Behandlung eine eher unklare Rolle, obwohl es Hinweise auf eine positive Rolle bei der Patientenbehandlung gibt. Die Evidenz aus einer Metaanalyse zeigte eine signifikante Verringerung der Gesamtmortalität bei einer Betablocker-Therapie, obwohl die Gesamtwirkung hauptsächlich durch kleine, ältere Studien mit Patienten nach einem Myokardinfarkt getrieben wurde. Einige Hinweise deuten darauf hin, dass gefäßerweiternde Betablocker, wie Nebivolol , Patienten mit Herzinsuffizienz unabhängig von der Auswurffraktion einen Nutzen bringen können. Darüber hinaus kann die bradykarde Wirkung von Betablockern aufgrund der chronotropen Störung und der verminderten LV-Füllung bei HFpEF eine verbesserte Füllung ermöglichen, den myokardialen Sauerstoffbedarf reduzieren und den Blutdruck senken. Dieser Effekt kann jedoch auch zu einer verminderten Reaktion auf Trainingsanforderungen beitragen und zu einer übermäßigen Verringerung der Herzfrequenz führen.
Betablocker sind die Therapie der ersten Wahl: Sie senken die Herzfrequenz und geben so den Herzkammern mehr Zeit, sich zu füllen. Sie können auch das Überleben verbessern. Es gibt einige Hinweise darauf, dass Kalziumkanalblocker bei der Verringerung der ventrikulären Steifheit von Nutzen sein können. In einigen Fällen ( Verapamil hat den Vorteil, die Herzfrequenz zu senken).
Angiotensin-Converting-Enzym (ACE)-Hemmer
Ebenso kann eine Behandlung mit Angiotensin-Converting-Enzym-Hemmern wie Enalapril , Ramipril und vielen anderen aufgrund ihrer Wirkung auf die Verhinderung des ventrikulären Umbaus von Vorteil sein, jedoch unter Kontrolle, um eine Hypotonie zu vermeiden. ACE-Hemmer scheinen die Morbidität oder Mortalität im Zusammenhang mit HFpEF allein nicht zu verbessern. Sie sind jedoch wichtig bei der Behandlung von Bluthochdruck , einem wichtigen Akteur in der Pathophysiologie von HFpEF.
Angiotensin-II-Rezeptorblocker (ARBs)
Die Behandlung mit ARB führt zu einer Verbesserung der diastolischen Dysfunktion und des Bluthochdrucks, die mit anderen blutdrucksenkenden Medikamenten vergleichbar ist.
Diuretika
Diuretika können nützlich sein, wenn eine erhebliche Stauung auftritt, aber die Patienten müssen überwacht werden, da sie häufig einen niedrigen Blutdruck entwickeln .
Experimental
Die Verwendung einer selbstexpandierenden Vorrichtung, die an der äußeren Oberfläche des linken Ventrikels befestigt wird, wurde vorgeschlagen, wartet jedoch noch auf die FDA-Zulassung. Wenn der Herzmuskel zusammendrückt, wird Energie in das Gerät geladen, das die Energie absorbiert und in der diastolischen Phase an die linke Herzkammer abgibt. Dies hilft, die Muskelelastizität zu erhalten.
Prognose
Der Verlauf von HFpEF und sein klinischer Verlauf sind im Vergleich zu HFrEF wenig verstanden. Trotzdem scheinen Patienten mit HFrEF und HFpEF vergleichbare Ergebnisse in Bezug auf Krankenhausaufenthalt und Mortalität zu haben. Die Todesursachen bei Patienten variieren erheblich. Bei Patienten mit fortgeschrittener Herzinsuffizienz (NYHA-Klassen II-IV) war jedoch kardiovaskulärer Tod, einschließlich Herzinfarkt und plötzlicher Herztod , die vorherrschende Ursache in bevölkerungsbezogenen Studien.
Bis vor kurzem wurde allgemein angenommen, dass die Prognose für Personen mit diastolischer Dysfunktion und damit verbundenem intermittierendem Lungenödem besser ist als für Personen mit systolischer Dysfunktion. Tatsächlich wurden in zwei Studien, die 2006 im New England Journal of Medicine erschienen sind , Beweise dafür vorgelegt, dass die Prognose bei diastolischer Dysfunktion die gleiche ist wie bei systolischer Dysfunktion .
Verweise
Literaturverzeichnis
- Estafanous, FG (2001). Kardiale Anästhesie 2 Ed: Principles and Clinical Practice (2 Ed.). Lippincott Williams & Wilkins. ISBN 978-0781721950.
- O'Rouke, RA, Fuster, V. (2001). Hurst's The Heart (10 (Internationale Ausgabe) Hrsg.). McGraw-Hill. S. 658–60. ISBN 978-0-07-116296-8.
Externe Links
| Einstufung |
|---|

