Ventrikulärer Umbau - Ventricular remodeling
In der Kardiologie , ventrikulären Remodellierung (oder kardialen Remodeling bezeichnet) auf Veränderungen in der Größe, Form, Struktur und Funktion des Herzens . Dies kann als Ergebnis passieren Übung (physiologischen Remodeling) oder nach einer Verletzung des Herzmuskels (pathologischen Remodeling). Die Verletzung ist typischerweise auf einen akuten Myokardinfarkt (normalerweise transmuralen oder ST-Strecken-Hebungsinfarkt) zurückzuführen, kann jedoch eine Reihe von Ursachen haben, die zu einem erhöhten Druck oder Volumen führen , was zu einer Druck- oder Volumenüberlastung (Beanspruchung) des Herzens führt. Chronischer Bluthochdruck , angeborene Herzfehler mit intrakardialem Shunt und Herzklappenerkrankungen können ebenfalls zu einem Umbau führen. Nach Auftreten des Insults kommt es im linksventrikulären Myokard zu einer Reihe histopathologischer und struktureller Veränderungen, die zu einer fortschreitenden Abnahme der linksventrikulären Leistung führen. Letztlich kann ein ventrikulärer Umbau zu einer verminderten kontraktilen ( systolischen ) Funktion und einem reduzierten Schlagvolumen führen .
Der physiologische Umbau ist reversibel, während der pathologische Umbau meist irreversibel ist. Remodeling der Ventrikel unter Druckanforderung links/rechts machen Mismatches unvermeidlich. Pathologische Druck-Mismatches zwischen dem pulmonalen und dem systemischen Kreislauf führen zu einem kompensatorischen Umbau des linken und rechten Ventrikels. Der Begriff "Reverse Remodeling" in der Kardiologie impliziert eine Verbesserung der ventrikulären Mechanik und Funktion nach einer entfernten Verletzung oder einem pathologischen Prozess.
Ventrikuläres Remodeling kann ventrikuläre Hypertrophie , ventrikuläre Dilatation , Kardiomegalie und andere Veränderungen umfassen. Es ist ein Aspekt der Kardiomyopathie , von der es viele Arten gibt. Konzentrische Hypertrophie ist auf Drucküberlastung zurückzuführen , während exzentrische Hypertrophie auf Volumenüberlastung zurückzuführen ist .
Pathophysiologie
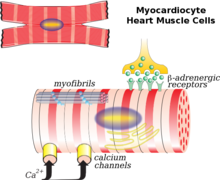
Der Herzmuskel ist die wichtigste Zelle, die am Umbau beteiligt ist. Auch Fibroblasten , Kollagen , das Interstitium und in geringerem Maße die Herzkranzgefäße spielen eine Rolle. Ein häufiges Szenario für das Remodeling ist nach einem Myokardinfarkt. Es ist myokardiale Nekrose (Zelltod) und unverhältnismäßig Ausdünnung des Herzens. Dieser dünne, geschwächte Bereich kann der Druck- und Volumenbelastung des Herzens nicht wie das andere gesunde Gewebe standhalten. Als Ergebnis kommt es zu einer Dilatation der Kammer aufgrund der Infarktregion. Die anfängliche Umbauphase nach einem Myokardinfarkt führt zu einer Reparatur des nekrotischen Bereichs und einer Myokardnarbenbildung , die bis zu einem gewissen Grad als vorteilhaft angesehen werden können, da die LV-Funktion und das Herzzeitvolumen verbessert oder erhalten werden . Im Laufe der Zeit wird das Herz jedoch weniger elliptisch und mehr kugelförmig, da das Herz ständig umgebaut wird. Die ventrikuläre Masse und das Volumen nehmen zu, was zusammen die Herzfunktion negativ beeinflusst. Schließlich kann die diastolische Funktion oder die Fähigkeit des Herzens, sich zwischen den Wehen zu entspannen, beeinträchtigt werden, was zu einem weiteren Rückgang führt.
Nach einem Myokardinfarkt (MI) kann der Tod von Herzmuskelzellen durch Nekrose , Apoptose oder Autophagie ausgelöst werden , was zu einer Verdünnung der Herzwand führt. Die überlebenden Herzmuskelzellen ordnen sich entweder parallel oder hintereinander an und tragen je nach Belastung der Ventrikelwand zur ventrikulären Dilatation oder ventrikulären Hypertrophie bei. Außerdem wird angenommen, dass eine reduzierte Expression von V1-Mysoin und L-Typ-Calciumkanälen auf Herzmuskelzellen ebenfalls ein kardiales Remodelling verursacht. Fettsäure macht unter normalen Körperbedingungen 60 bis 90 % der Energieversorgung des Herzens aus. Wenn die Fettsäureoxidation nach einem MI abnimmt, führt dies zu einer verminderten Energieversorgung der Herzmuskelzellen, einer Ansammlung von Fettsäuren auf toxische Niveaus und einer Dysfunktion der Mitochondrien . Diese Folgen führten auch zu einem Anstieg des oxidativen Stresses am Herzen, der die Proliferation von Fibroblasten , die Aktivierung von Metalloproteinasen und die Induktion von Apoptose verursachte, was weiter unten erläutert wird. Außerdem trägt die entzündliche Immunantwort nach MI ebenfalls zu den oben genannten Veränderungen bei.
Außerdem ist das kardiale Interstitium, das hauptsächlich aus Kollagenfasern vom Typ I und Typ III besteht, auch am kardialen Umbau beteiligt. Herzkollagen wird von Fibroblasten synthetisiert und von Metalloproteinasen abgebaut. Fibroblasten werden nach MI aktiviert, was zu einer erhöhten Kollagensynthese und Fibrose des Herzens führt. Eine erhöhte Expression von MMP1 und MMP9 führte zum Abbau von Kollagenfasern und anschließend zu einer Dilatation des Herzens. Mehrere Signalwege wie Angiotensin II , Transforming Growth Factor Beta (TGF-beta) und Endothelin 1 sind dafür bekannt, die Synthese und den Abbau von Kollagenfasern im Herzen auszulösen.
Andere Faktoren wie Bluthochdruck, Aktivierung des sympathischen Systems, das Noradrenalin freisetzt , Aktivierung des Renin-Angiotensin-Systems, das Renin und antidiuretische Hormone freisetzt, tragen wesentlich zum kardialen Umbau bei. Es wird jedoch angenommen, dass atriale natriuretische Peptide kardioprotektiv sind.
Auswertung
Der Umbau des Herzens wird durch die Durchführung eines Echokardiogramms beurteilt . Mit diesem Test können Größe und Funktion der Vorhöfe und Ventrikel charakterisiert werden.
Behandlung
Viele Faktoren beeinflussen den zeitlichen Verlauf und das Ausmaß der Remodellierung, einschließlich der Schwere der Verletzung, sekundäre Ereignisse (rezidivierende Ischämie oder Infarkt), neurohormonale Aktivierung, genetische Faktoren und Genexpression und Behandlung. Medikamente können den Umbau abschwächen. Angiotensin-Converting-Enzym-(ACE)-Hemmer haben in Tiermodellen durchweg gezeigt, dass sie Remodeling oder transmuralen Infarkt und chronische Drucküberlastung verringern. Klinische Studien haben gezeigt, dass eine ACE-Hemmer-Therapie nach einem Myokardinfarkt zu einer verbesserten myokardialen Leistung, einer verbesserten Ejektionsfraktion und einer verringerten Mortalität im Vergleich zu Patienten führt, die mit Placebo behandelt wurden. Ebenso führt die Hemmung von Aldosteron , entweder direkt oder indirekt, zu einer Verbesserung des Umbaus. Carvedilol , ein Betablocker der 3. Generation , kann den Umbauprozess tatsächlich umkehren, indem es das linksventrikuläre Volumen reduziert und die systolische Funktion verbessert. Eine frühzeitige Korrektur angeborener Herzfehler kann, falls angemessen, ein Remodeling verhindern, ebenso wie die Behandlung von chronischem Bluthochdruck oder Herzklappenerkrankungen . Oft wird auch ein reverses Remodeling oder eine Verbesserung der linksventrikulären Funktion beobachtet.
Siehe auch
Verweise
Weiterlesen
- „Linksventrikulärer Umbau bei Herzinsuffizienz: Aktuelle Konzepte in klinischer Bedeutung und Bewertung“ . bild.onlinejacc.org . Abgerufen 2016-02-12 .