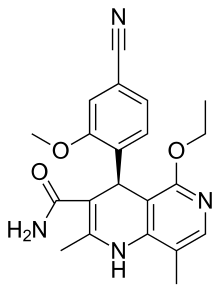
Finerenon - Finerenone
 | |
| Klinische Daten | |
|---|---|
| Namen austauschen | Kerendia |
| Andere Namen | BUCHT 94-8862 |
| Lizenzdaten | |
| Wege Verwaltung |
Mit dem Mund |
| Wirkstoffklasse | Kaliumsparendes Diuretikum |
| ATC-Code | |
| Rechtsstellung | |
| Rechtsstellung | |
| Bezeichner | |
| |
| CAS-Nummer | |
| PubChem- CID | |
| Arzneimittelbank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox-Dashboard ( EPA ) | |
| ECHA-Infokarte |
100.247.614 |
| Chemische und physikalische Daten | |
| Formel | C 21 H 22 N 4 O 3 |
| Molmasse | 378.432 g·mol -1 |
| 3D-Modell ( JSmol ) | |
| |
| |
Finerenon , das unter dem Markennamen Kerendia verkauft wird , ist ein Medikament zur Verringerung des Risikos von Nierenfunktionsstörungen, Nierenversagen, kardiovaskulärem Tod, nicht tödlichem Herzinfarkt und Krankenhausaufenthalt wegen Herzinsuffizienz bei Erwachsenen mit chronischer Nierenerkrankung im Zusammenhang mit Typ-2-Diabetes . Finerenon ist ein nicht-steroidaler Mineralocorticoid-Rezeptor-Antagonist (MRA).
Häufige Nebenwirkungen sind Hyperkaliämie (hoher Kaliumspiegel), Hypotonie (niedriger Blutdruck) und Hyponatriämie (niedriger Natriumspiegel).
Finerenon wurde im Juli 2021 in den USA für medizinische Zwecke zugelassen.
Medizinische Anwendungen
Finerenon ist angezeigt , um bei Erwachsenen mit chronischer Nierenerkrankung im Zusammenhang mit Typ-2-Diabetes das Risiko einer Verschlechterung der Nierenfunktion, eines Nierenversagens, eines kardiovaskulären Todes, eines nicht tödlichen Herzinfarkts und einer Krankenhauseinweisung wegen Herzinsuffizienz zu reduzieren.
Pharmakologie
Finerenon hat eine geringere relative Affinität zu anderen Steroidhormonrezeptoren als derzeit verfügbare Aldosteronantagonisten wie Eplerenon und Spironolacton , was zu weniger Nebenwirkungen wie Gynäkomastie , Impotenz und geringer Libido führen sollte .
Finerenon blockiert Mineralocorticoid-Rezeptoren , was es zu einem kaliumsparenden Diuretikum macht .
Diese Tabelle vergleicht hemmende (blockierende) Konzentrationen ( IC 50 , Einheit: nM ) von drei Antimineralocorticoiden. Die Hemmung des Mineralocorticoid-Rezeptors ist für die gewünschte Wirkung der Medikamente verantwortlich, während die Hemmung der anderen Rezeptoren potenziell zu Nebenwirkungen führt. Niedrigere Werte bedeuten eine stärkere Hemmung.
| Spironolacton | Eplerenon | Finerenon | |
|---|---|---|---|
| Mineralocorticoid-Rezeptor | 24 | 990 | 18 |
| Glukokortikoid-Rezeptor | 2400 | 22.000 | >10.000 |
| Androgenrezeptor | 77 | 21.200 | >10.000 |
| Progesteron-Rezeptor | 740 | 31.200 | >10.000 |
Die oben aufgeführten Medikamente haben eine unbedeutende Affinität zum Östrogenrezeptor .
Finerenon wirkt als Antagonist von Mineralocorticoid-Rezeptoren, die die S810L-Mutation beherbergen, im Gegensatz zu anderen traditionellen MR-Inhibitoren wie Spironolacton und Eplerenon, die nebenbei als Agonisten wirken.
Geschichte
Die Wirksamkeit von Finerenon zur Verbesserung der Nieren- und Herzergebnisse wurde in einer randomisierten, multizentrischen, doppelblinden, placebokontrollierten Studie bei Erwachsenen mit chronischer Nierenerkrankung im Zusammenhang mit Typ-2-Diabetes untersucht. In dieser Studie erhielten 5.674 Teilnehmer nach dem Zufallsprinzip entweder Finerenon oder ein Placebo.
Die Studie verglich die beiden Gruppen hinsichtlich der Anzahl der Teilnehmer, deren Krankheit zu einem kombinierten (oder kombinierten) Endpunkt fortgeschritten war, der eine Verringerung der Nierenfunktion von mindestens 40 %, eine Progression zum Nierenversagen oder einen Nierentod beinhaltete. Die Ergebnisse zeigten, dass 504 der 2.833 Teilnehmer, die Finerenon erhielten, mindestens eines der Ereignisse im zusammengesetzten Endpunkt aufwiesen, verglichen mit 600 der 2.841 Teilnehmer, die ein Placebo erhielten.
Die US-amerikanische Food and Drug Administration (FDA) hat dem Antrag auf eine vorrangige Überprüfung von Finerenon und eine Fast-Track- Zulassung stattgegeben . Die FDA hat Bayer Healthcare die Zulassung von Kerendia erteilt.
Forschung
In der Phase-II-ARTS-DN-Studie reduzierte Finerenon dosisabhängig das Verhältnis von Albumin zu Kreatinin im Urin bei Patienten mit diabetischer Nierenerkrankung . Basierend auf diesen Ergebnissen wird Finerenon in den großen Phase-III-Ergebnisstudien FIDELIO und FIGARO untersucht, um zu beurteilen, ob Finerenon das Risiko einer CKD-Progression und unerwünschter kardiovaskulärer Ereignisse bei Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes reduziert. An diesen Studien nahmen mehr als 13.000 Patienten teil, wobei der primäre Abschluss von FIDELIO im Jahr 2020 und FIGARO im Jahr 2021 erwartet wird.
Verweise
Weiterlesen
- Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, et al. (Dezember 2020). „Wirkung von Finerenon auf die Ergebnisse einer chronischen Nierenerkrankung bei Typ-2-Diabetes“ . N Engl J Med . 383 (23): 2219–2229. doi : 10.1056/NEJMoa2025845 . PMID 33264825 .
Externe Links
- "Finerenon" . Informationsportal für Arzneimittel . US-amerikanische Nationalbibliothek für Medizin.
