Hochintensiver fokussierter Ultraschall - High-intensity focused ultrasound
Hochintensiver fokussierter Ultraschall ( HIFU ) ist eine nicht-invasive therapeutische Technik, die nichtionisierende Ultraschallwellen zum Erwärmen oder Abtragen von Gewebe verwendet. HIFU kann verwendet werden, um den Blut- oder Lymphfluss zu erhöhen oder Gewebe, wie Tumore , über thermische und mechanische Mechanismen zu zerstören . Angesichts der Verbreitung und der relativ geringen Kosten von Ultraschall wurde HIFU intensiv erforscht und entwickelt. Die Prämisse von HIFU ist, dass es sich um eine nicht-invasive kostengünstige Therapie handelt, die den aktuellen Behandlungsstandard mindestens übertreffen kann.
Die Technologie ähnelt der Ultraschallbildgebung , obwohl niedrigere Frequenzen und kontinuierliche statt gepulster Wellen verwendet werden, um die erforderlichen thermischen Dosen zu erreichen. Es können jedoch auch gepulste Wellen verwendet werden, wenn eine mechanische statt einer thermischen Beschädigung erwünscht ist. Akustische Linsen werden häufig verwendet, um am Zielgewebe die nötige Intensität zu erreichen, ohne das umliegende Gewebe zu beschädigen. Eine Analogie ist die Verwendung einer Lupe, um das Sonnenlicht zu fokussieren; nur der Brennpunkt der Lupe hat eine hohe Intensität. Obwohl traditionell Linsen verwendet wurden, werden Phased-Arrays immer häufiger verwendet, da sie eine einfache Änderung der Fokusposition ermöglichen.
HIFU wird traditionell mit anderen bildgebenden Verfahren wie medizinischem Ultraschall oder MRT kombiniert , um eine Führung der Behandlung und Überwachung zu ermöglichen.
Geschichte
Die ersten Untersuchungen von HIFU zur nicht-invasiven Ablation wurden von Lynn et al. in den frühen 1940er Jahren. Umfangreiche wichtige Früharbeiten wurden in den 1950er und 1960er Jahren von William Fry und Francis Fry an der University of Illinois und Carl Townsend, Howard White und George Gardner am Interscience Research Institute of Champaign, Illinois, durchgeführt, die in klinischen Behandlungen neurologischer Störungen gipfelten. Insbesondere hochintensiver Ultraschall und Ultraschallvisualisierung wurden stereotaktisch mit einer Cincinnati-Präzisionsfräsmaschine durchgeführt, um eine genaue Ablation von Hirntumoren durchzuführen. Bis vor kurzem gab es nur wenige klinische Studien mit HIFU zur Ablation (obwohl mit Ultraschallerwärmung bedeutende Arbeiten zur Hyperthermie durchgeführt wurden), möglicherweise aufgrund der Komplexität der Behandlungen und der Schwierigkeit, den Strahl nicht invasiv zu richten. Mit den jüngsten Fortschritten in der medizinischen Bildgebung und Ultraschalltechnologie hat das Interesse an der HIFU-Ablation von Tumoren zugenommen.
Das erste kommerzielle HIFU-Gerät namens Sonablate 200 wurde von der amerikanischen Firma Focus Surgery, Inc. entwickelt und 1994 nach Erhalt der CE-Zulassung in Europa auf den Markt gebracht, was eine erste medizinische Validierung der Technologie für die benigne Prostatahyperplasie (BPH) brachte. Umfassende Studien durch Ärzte an mehr als einem Standort, die das Gerät verwenden, haben die klinische Wirksamkeit bei der Zerstörung von Prostatagewebe ohne Blutverlust oder langfristige Nebenwirkungen gezeigt. Spätere Studien zu lokalisiertem Prostatakrebs von Murat und Kollegen am Edouard Herriot Hospital in Lyon im Jahr 2006 zeigten, dass nach der Behandlung mit dem Ablatherm (EDAP TMS, Lyon, Frankreich) die progressionsfreien Überlebensraten bei niedrigem und mittlerem Risiko sehr hoch sind Patienten mit rezidivierendem Prostatakrebs (70 % bzw. 50 %) Die HIFU-Behandlung von Prostatakrebs ist derzeit eine zugelassene Therapie in Europa, Kanada, Südkorea, Australien und anderswo. Ab 2012 laufen in den USA klinische Studien mit dem Sonablate 500 für Prostatakrebspatienten und solche, die ein Strahlenversagen erlitten haben.
Der Einsatz von magnetresonanzgeführtem fokussiertem Ultraschall wurde 1992 erstmals zitiert und patentiert. Die Technologie wurde später 1998 an InsighTec in Haifa, Israel, übertragen. Das InsighTec ExAblate 2000 war das erste MRgFUS-System, das die FDA-Marktzulassung in den USA erhielt.
Medizinische Anwendungen
Es besteht kein klarer Konsens über die Grenzen zwischen HIFU und anderen Formen des therapeutischen Ultraschalls . In der akademischen Literatur bezieht sich HIFU normalerweise auf das hohe Energieniveau, das erforderlich ist, um Gewebe durch Ablation oder Kavitation zu zerstören , obwohl es manchmal auch verwendet wird, um Anwendungen mit geringerer Intensität wie Ergotherapie und Physiotherapie zu beschreiben.
In jedem Fall wird HIFU verwendet, um Gewebe tief im Körper nicht-invasiv zu erwärmen, ohne dass ein Einschnitt erforderlich ist. Die Hauptanwendungen sind die Zerstörung von Gewebe, die Erhöhung der Durchblutung und die physikalische Therapie . Der Einsatz von Ultraschall bei der Behandlung von Muskel-Skelett-Erkrankungen ist eine weitere Anwendung in der Physiotherapie.
Neurologische Störungen
Eine der ersten Anwendungen von HIFU war die Behandlung der Parkinson-Krankheit in den 1940er Jahren. Obwohl zu diesem Zeitpunkt unwirksam, hat HIFU die Fähigkeit zur Läsionspathologie. Ein fokussiertes Ultraschallsystem ist in Israel, Kanada, Europa, Korea und Russland zur Behandlung von essentiellem Tremor , neuropathischen Schmerzen und Parkinson-Tremor zugelassen . Dieser Ansatz ermöglicht eine Behandlung des Gehirns ohne Schnitt oder Bestrahlung. Im Jahr 2016 genehmigte die US-amerikanische Food and Drug Administration ( FDA ) das Exablate-System von Insightec zur Behandlung des essentiellen Tremors. Die Behandlung anderer thalamokortikaler Dysrhythmien und psychiatrischer Erkrankungen wird derzeit untersucht.
Uterusadenomyose und Myome
Die Behandlung symptomatischer Uterusmyome wurde im Oktober 2004 die erste zugelassene Anwendung von HIFU durch die US-amerikanische Food and Drug Administration (FDA). Studien haben gezeigt, dass HIFU sicher und wirksam ist und dass die Patienten eine symptomatische Linderung für mindestens zwei Jahre erhalten ohne das Risiko von Komplikationen bei Operationen oder anderen invasiveren Ansätzen. Bis zu 16-20% der Patienten benötigen eine zusätzliche Behandlung.
Krebs
HIFU ist eine attraktive Option bei Tumoren an schwer zugänglichen oder nicht resezierbaren Stellen. Von besonderem Interesse sind Darmkrebs und Hirntumor. Bei der Empfehlung einer Behandlung muss ein Arzt andere Modalitäten in Betracht ziehen, um festzustellen, ob HIFU eine praktikable Option ist.
Prostatakrebs
HIFU wird bei Männern mit Prostatakrebs untersucht . HIFU wurde 2015 in den USA zur Ablation von Prostatagewebe zugelassen. HIFU wird auch zur Ablation von Prostatakrebs eingesetzt.
Leberkrebs
HIFU ist bei Leberkrebs gut untersucht und berichtet in vielen Studien über eine hohe Ansprechrate und ein positives Patientenergebnis.
Abskopale Wirkung
Während der Behandlung von metastasiertem Leberkrebs mit HIFU wurden Immunantworten an Orten beobachtet, die von der Herdregion entfernt sind. Obwohl der Mechanismus dieser systemischen Reaktion unbekannt ist, wird angenommen, dass sie durch die Freisetzung von Tumorantigenen mit beibehaltener Immunogenität durch Histotripsie ausgelöst wird.
Andere Krebsarten
HIFU wurde erfolgreich bei der Behandlung von Krebs eingesetzt , um solide Tumoren des Knochens, des Gehirns, der Brust, der Bauchspeicheldrüse, des Mastdarms, der Niere, der Hoden und der Prostata zu zerstören.
Palliativpflege
Es wurde festgestellt, dass HIFU palliative Wirkungen hat. Für die palliative Behandlung von Knochenmetastasen wurde die CE-Zulassung erteilt . Experimentell wurde eine palliative Wirkung bei fortgeschrittenem Bauchspeicheldrüsenkrebs festgestellt .
Prostatavergrößerung
Die Behandlung der Prostatavergrößerung ( benigne Prostatahyperplasie ) durch HIFU aus dem Darminneren (transrektal) hat sich als erfolglos erwiesen.
In einigen Ländern, nicht in den USA, wird HIFU auch von der Innenseite der Prostata, also über einen Katheter in der Prostataharnröhre, angeboten . Belege für 2019 fehlen.
In England stufte das National Institute for Health and Care Excellence (NICE) 2018 die Methode als „nicht empfohlen“ ein. In den USA (Stand 2019) ist nicht einmal das für die Behandlung benötigte technische Gerät zugelassen.
Mechanismus
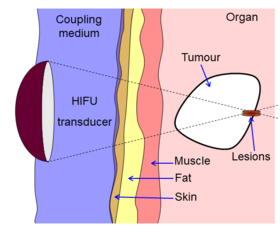
HIFU-Strahlen werden präzise auf eine kleine Region des erkrankten Gewebes fokussiert, um lokal hohe Energieniveaus zu deponieren.
Der Fokussierungseffekt des Wandlers ermöglicht die Abgabe hoher Schalldrücke an einen Brennpunkt, ohne dass andere Gewebe ungewollt geschädigt werden. Dieser Druckanstieg kann eine Reihe von Effekten verursachen, einschließlich Erwärmung und Kavitation .

- Ultraschallquellen können verwendet werden, um eine regionale Erwärmung und mechanische Veränderungen in biologischem Gewebe zu erzeugen, z. B. bei der Krebsbehandlung .
- Fokussierter Ultraschall kann verwendet werden, um eine stark lokalisierte Erwärmung zu erzeugen, um Zysten und Tumoren (gutartig oder bösartig) zu behandeln. Dies wird als magnetresonanzgesteuerter fokussierter Ultraschall (MRgFUS) oder hochintensiver fokussierter Ultraschall (HIFU) bezeichnet. Diese Verfahren verwenden im Allgemeinen niedrigere Frequenzen als medizinisch-diagnostischer Ultraschall (von 0,250 bis 2 MHz), aber deutlich höhere Energien. Die HIFU-Behandlung wird oft durch MRT geleitet .
- Fokussierter Ultraschall kann verwendet werden, um Nierensteine durch Lithotripsie aufzulösen .
- Ultraschall kann zur Kataraktbehandlung durch Phakoemulsifikation verwendet werden .
Im Jahr 2015 hat die FDA zwei HIFU-Geräte zur Ablation von Prostatagewebe zugelassen.
Temperatur
Die Temperatur des Gewebes im Fokus steigt auf 65 bis 85 °C und zerstört das erkrankte Gewebe durch Koagulationsnekrose . Wird das Gewebe länger als 1 Sekunde über den Schwellenwert von 60 °C angehoben, ist dieser Vorgang irreversibel. Höhere Temperaturen werden in der Regel vermieden, um ein Sieden von Flüssigkeiten im Gewebe zu verhindern. Jede Beschallung (individuelle Ultraschallenergiedeposition) behandelt einen genau definierten Teil des Zielgewebes. Das gesamte therapeutische Ziel wird behandelt, indem mehrere Beschallungen verwendet werden, um ein Volumen des behandelten Gewebes gemäß einem vom Arzt entwickelten Protokoll zu erzeugen. Eine Anästhesie ist nicht erforderlich, jedoch wird generell eine Sedierung empfohlen.
Das Ausmaß des im Gewebe verursachten Schadens kann mit kumulativen Äquivalentminuten (CEM) modelliert werden. Im Laufe der Jahre wurden mehrere Formulierungen der CEM-Gleichung vorgeschlagen, aber die Gleichung, die derzeit für die meisten Forschungen zur HIFU-Therapie verwendet wird, stammt aus einem 1984 erschienenen Artikel von Dewey und Sapareto:
wobei das Integral über die Behandlungszeit ist, R=0,5 für Temperaturen über 43 °C und 0,25 für Temperaturen zwischen 43 °C und 37 °C, eine Referenztemperatur von 43 °C und Zeit in Minuten. Diese Formel ist eine empirische Formel, die aus Experimenten von Dewey und Sapareto abgeleitet wurde, indem das Überleben von Zellkulturen nach Hitzeeinwirkung gemessen wurde.
Wenn sich eine Schallwelle durch das Gewebe ausbreitet, wird ein Teil davon absorbiert und in Wärme umgewandelt. Mit fokussierten Strahlen kann ein sehr kleiner Erwärmungsbereich tief im Gewebe erreicht werden (normalerweise in der Größenordnung von Millimetern). Eine Gewebeschädigung tritt als Funktion sowohl der Temperatur auf, auf die das Gewebe erhitzt wird, als auch der Dauer der Exposition des Gewebes diesem Hitzeniveau in einer als "thermische Dosis" bezeichneten Metrik auf. Durch Fokussieren an mehr als einer Stelle oder durch Abtasten des Fokus kann ein Volumen thermisch abgetragen werden. Thermische Dosen von 120-240 min bei 43 °C koagulieren zelluläres Protein und führen zu irreversibler Gewebezerstörung.
Es gibt einige Hinweise darauf, dass HIFU bei Krebserkrankungen angewendet werden kann, um die Tumormikroumgebung zu stören und eine Immunantwort auszulösen sowie möglicherweise die Wirksamkeit der Immuntherapie zu verbessern.
Mechanisch
Trägheitskavitation
Bei ausreichend hohen akustischen Intensitäten kann Kavitation (Mikrobläschen, die sich bilden und mit dem Ultraschallfeld interagieren) auftreten. Im Feld erzeugte Mikrobläschen schwingen und wachsen (aufgrund von Faktoren einschließlich gleichgerichteter Diffusion ) und können schließlich implodieren (Trägheits- oder vorübergehende Kavitation). Bei der Trägheitskavitation treten im Inneren der Blasen sehr hohe Temperaturen auf, und der Kollaps während der Verdünnungsphase ist mit einer Stoßwelle und Strahlen verbunden, die das Gewebe mechanisch schädigen können.
Stabile Kavitation
Stabile Kavitation erzeugt Mikroströmungen, die hohe Scherkräfte auf Kräfte induzieren und zur Apoptose führen. Aufwendig, Blasen, die durch die Verdampfung von Wasser aufgrund akustischer Kräfte erzeugt werden, schwingen unter einem Niederdruck-Schallfeld. Starke Strömung kann Zellschäden verursachen, aber auch die Gewebetemperatur durch konvektiven Wärmeverlust reduzieren.
Theorie
Es gibt mehrere Möglichkeiten, Ultraschall zu fokussieren – über eine Linse (z. B. eine Polystyrollinse ), einen gekrümmten Schallkopf , ein Phased-Array oder eine beliebige Kombination der drei. Dadurch wird es auf eine kleine Fokuszone konzentriert; es ähnelt im Konzept der Fokussierung von Licht durch eine Lupe . Dies kann unter Verwendung eines exponentiellen Modells der Ultraschalldämpfung bestimmt werden . Das Ultraschallintensitätsprofil wird durch eine exponentiell abnehmende Funktion begrenzt, wobei die Abnahme des Ultraschalls eine Funktion der durch das Gewebe zurückgelegten Strecke ist:
ist die Anfangsintensität des Strahls, ist der Dämpfungskoeffizient (in Einheiten der inversen Länge) und z ist die durch das Dämpfungsmedium (zB Gewebe) zurückgelegte Strecke.
In diesem Modell ist ein Maß für die Leistungsdichte der vom Ultraschallfeld aufgenommenen Wärme. Manchmal wird SAR auch verwendet, um die von einem bestimmten Medium absorbierte Wärmemenge auszudrücken und wird durch Teilen von Q durch die Gewebedichte erhalten. Dies zeigt, dass die Gewebeerwärmung proportional zur Intensität ist und dass die Intensität umgekehrt proportional zur Fläche ist, über die ein Ultraschallstrahl ausgebreitet wird Fokus.
Der Ultraschallstrahl kann auf folgende Weise fokussiert werden:
- Geometrisch, zum Beispiel mit einer Linse oder mit einem sphärisch gekrümmten Wandler .
- Elektronisch durch Einstellen der relativen Phasen von Elementen in einem Array von Wandlern (ein " Phased Array "). Durch dynamisches Anpassen der elektronischen Signale an die Elemente eines Phased-Arrays kann der Strahl an unterschiedliche Orte gelenkt und Aberrationen im Ultraschallstrahl aufgrund von Gewebestrukturen korrigiert werden.
Strahllieferung
Die Beam Delivery besteht aus Beam Steering und Bildführung. Der Strahl hat die Fähigkeit, überliegendes Gewebe unbeschadet zu durchdringen und auf einen lokalisierten Bereich mit einer Größenbeschränkung von 3–4 cm zu fokussieren. Der Bereich im Brennpunkt des Strahls erfährt eine Koagulationsnekrose. Nach der Ablation bildet sich eine deutliche Grenze zwischen gesundem und nekrotischem Gewebe (Breite kleiner als 50 µm).
Strahllenkung
Der am häufigsten verwendete Wandler ist ein konkaver Fokussierwandler mit fester Blende und fester Brennweite. Phased-Array-Wandler können auch mit anderen Anordnungen (Flach/Schale) verwendet werden.
Bildanleitung
Die HIFU-Therapie erfordert eine sorgfältige Überwachung und wird daher normalerweise in Verbindung mit anderen bildgebenden Verfahren durchgeführt.
Präoperative Bildgebung, zum Beispiel CT und MRT , werden normalerweise verwendet, um allgemeine Parameter der Zielanatomie zu identifizieren. Andererseits ist eine Echtzeit-Bildgebung für eine sichere und genaue nichtinvasive Zielerfassung und Therapieüberwachung erforderlich. Sowohl die MRT als auch die medizinische Ultraschallbildgebung wurden zur Anleitung bei der FUS-Behandlung verwendet. Diese Techniken sind als magnetresonanzgesteuerte fokussierte Ultraschallchirurgie (MRgFUS) bzw. Ultraschallgesteuerte fokussierte Ultraschallchirurgie (USgFUS) bekannt. MRgFUS ist ein 3D-Bildgebungsverfahren, das einen hohen Weichteilkontrast aufweist und Informationen über die Temperatur liefert und so die Überwachung der Ablation ermöglicht. Eine niedrige Bildfrequenz führt jedoch dazu, dass diese Technik bei der Echtzeit-Bildgebung schlecht funktioniert, und hohe Kosten stellen eine erhebliche Einschränkung ihrer Verwendung dar. USgFUS, unterschiedlich, ist eine 2D - Bildgebungstechnik , bei der, auch wenn kein System quantitative Informationen über Temperatur bisher kommerziell entwickelt bereitzustellen, werden mehrere Vorteile ausgenutzt, wie eine hohe Bildrate (bis zu 1000 Bilder pro Sekunde), gering Kosten und minimale gesundheitliche Beeinträchtigungen. Ein weiterer Grund, warum Ultraschall ideal für die Bildführung ist, ist, dass es das akustische Fenster in Echtzeit überprüft, da es sich um dieselbe Modalität wie die Therapie handelt. Daraus folgt, dass es unwahrscheinlich ist, dass die HIFU-Therapie in dieser spezifischen Region wirksam ist, wenn die Zielregion nicht durch Ultraschallbildgebung vor und während der HIFU-Therapie sichtbar gemacht wird. Darüber hinaus können Behandlungsergebnisse in Echtzeit durch visuelle Inspektion von echoreichen Veränderungen in Standard-B-Bild-Bildern geschätzt werden.
Verweise
Externe Links
- Therapeutischer Ultraschall bei Curlie
- Trotz Zweifel zieht Krebstherapie Patienten aus der New York Times am 18.