Tyrosinhydroxylase - Tyrosine hydroxylase
Tyrosin-Hydroxylase oder Tyrosin-3-Monooxygenase ist das Enzym, das für die Katalyse der Umwandlung der Aminosäure L- Tyrosin in L- 3,4-Dihydroxyphenylalanin ( L- DOPA) verantwortlich ist. Dabei werden molekularer Sauerstoff (O 2 ) sowie Eisen (Fe 2+ ) und Tetrahydrobiopterin als Cofaktoren verwendet . L- DOPA ist eine Vorstufe für Dopamin , welches wiederum eine Vorstufe für die wichtigen Neurotransmitter Noradrenalin (Noradrenalin) und Epinephrin (Adrenalin) ist. Tyrosin-Hydroxylase katalysiert den geschwindigkeitsbestimmenden Schritt bei dieser Synthese von Katecholaminen . Beim Menschen wird Tyrosinhydroxylase vom TH- Gen kodiert , und das Enzym ist im Zentralnervensystem (ZNS), in peripheren sympathischen Neuronen und im Nebennierenmark vorhanden . Tyrosinhydroxylase, Phenylalaninhydroxylase und Tryptophanhydroxylase bilden zusammen die Familie der aromatischen Aminosäurehydroxylasen (AAAHs).
Reaktion
| Tyrosin-3-Monooxygenase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
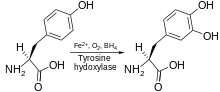 Tyrosinhydroxylase katalysiert die Umwandlung von Tyrosin in L -DOPA unter Verwendung von Fe 2+ , O 2 und BH 4
| |||||||||
| Bezeichner | |||||||||
| EG-Nr. | 1.14.16.2 | ||||||||
| CAS-Nr. | 9036-22-0 | ||||||||
| Datenbanken | |||||||||
| IntEnz | IntEnz-Ansicht | ||||||||
| BRENDA | BRENDA-Eintrag | ||||||||
| ExPASy | NiceZyme-Ansicht | ||||||||
| KEGG | KEGG-Eintrag | ||||||||
| MetaCyc | Stoffwechselweg | ||||||||
| PRIAM | Profil | ||||||||
| PDB- Strukturen | RCSB PDB PDBe PDBsum | ||||||||
| Gen-Ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Tyrosinhydroxylase katalysiert die Reaktion, bei der L- Tyrosin in der meta- Position hydroxyliert wird , um L- 3,4-Dihydroxyphenylalanin ( L- DOPA) zu erhalten. Das Enzym ist eine Oxygenase, was bedeutet, dass es molekularen Sauerstoff verwendet, um seine Substrate zu hydroxylieren. Eines der Sauerstoffatome in O 2 wird verwendet, um das Tyrosinmolekül zu hydroxylieren, um L- DOPA zu erhalten, und das andere wird verwendet, um den Cofaktor zu hydroxylieren. Wie die anderen aromatischen Aminosäurehydroxylasen (AAAHs) verwendet Tyrosinhydroxylase unter normalen Bedingungen den Cofaktor Tetrahydrobiopterin (BH 4 ), obwohl andere ähnliche Moleküle auch als Cofaktor für Tyrosinhydroxylase wirken können.
Die AAAHs wandeln den Cofaktor 5,6,7,8-Tetrahydrobiopterin (BH 4 ) in Tetrahydrobiopterin-4a-Carbinolamin (4a-BH 4 ) um. Unter physiologischen Bedingungen, 4a-BH 4 ist dehydriert chinoide-Dihydrobiopterin (Q-BH 2 ) durch das Enzym Pterin-4a-Carbinolamin Dehydrase (PCD) und ein Wassermolekül wird in dieser Reaktion freigesetzt. Dann wandelt das NAD(P)H-abhängige Enzym Dihydropteridin-Reduktase (DHPR) q-BH 2 zurück in BH 4 um . Jede der vier Untereinheiten der Tyrosinhydroxylase ist mit einem Eisen (II)-Atom im aktiven Zentrum koordiniert . Die Oxidationsstufe dieses Eisenatoms ist für den katalytischen Umsatz bei der enzymatischen Reaktion wichtig. Wird das Eisen zu Fe(III) oxidiert, wird das Enzym inaktiviert.
Das Produkt der enzymatischen Reaktion, L- DOPA, kann durch das Enzym DOPA-Decarboxylase in Dopamin umgewandelt werden . Dopamin kann durch das Enzym Dopamin-β-Hydroxylase in Noradrenalin umgewandelt werden , das durch das Enzym Phenylethanol-N-Methyltransferase weiter modifiziert werden kann, um Adrenalin zu erhalten. Da L- DOPA die Vorstufe der Neurotransmitter Dopamin, Noradrenalin und Adrenalin ist, findet sich Tyrosinhydroxylase daher im Zytosol aller Zellen, die diese Katecholamine enthalten . Es hat sich gezeigt, dass diese durch Tyrosinhydroxylase katalysierte Anfangsreaktion der geschwindigkeitsbegrenzende Schritt bei der Herstellung von Katecholaminen ist.
Das Enzym ist hochspezifisch und akzeptiert keine Indolderivate - was ungewöhnlich ist, wie es viele andere Enzyme tun, die an der Produktion von Katecholaminen beteiligt sind. Tryptophan ist ein schlechtes Substrat für Tyrosin - Hydroxylase, aber es hydroxylieren kann L - Phenylalanin zu bilden L - Tyrosin und geringe Mengen an 3-Hydroxyphenylalanin. Das Enzym kann dann weiter katalysieren L - tyrosin bilden L -DOPA. Tyrosinhydroxylase kann auch an anderen Reaktionen beteiligt sein, wie beispielsweise der Oxidation von L- DOPA, um 5-S-Cysteinyl-DOPA oder andere L -DOPA- Derivate zu bilden.
Struktur
Tyrosinhydroxylase ist ein Tetramer aus vier identischen Untereinheiten ( Homotetramer ). Jede Untereinheit besteht aus drei Domänen . Am Carboxyl-Ende der Peptidkette befindet sich eine kurze Alpha-Helix- Domäne, die eine Tetramerisierung ermöglicht. Die zentralen ~300 Aminosäuren bilden einen katalytischen Kern, in dem sich alle für die Katalyse notwendigen Reste zusammen mit einem nicht kovalent gebundenen Eisenatom befinden. Das Eisen wird von zwei Histidinresten und einem Glutamatrest an Ort und Stelle gehalten , was es zu einem Nicht-Häm-, Nicht-Eisen-Schwefel-Eisen-haltigen Enzym macht. Die aminoterminalen ~150 Aminosäuren bilden eine regulatorische Domäne, von der angenommen wird, dass sie den Zugang von Substraten zum aktiven Zentrum kontrolliert . Beim Menschen gibt es vermutlich vier verschiedene Versionen dieser regulatorischen Domäne und somit vier Versionen des Enzyms, abhängig vom alternativen Spleißen , obwohl noch keine ihrer Strukturen richtig bestimmt wurde. Es wurde vorgeschlagen, dass diese Domäne ein intrinsisch unstrukturiertes Protein sein könnte , das keine klar definierte Tertiärstruktur hat , aber bisher wurden keine Beweise vorgelegt, die diese Behauptung stützen. Es hat sich jedoch gezeigt, dass die Domäne ein geringes Vorkommen an Sekundärstrukturen aufweist , was den Verdacht einer ungeordneten Gesamtstruktur nicht abschwächt. Was die Tetramerisierungs- und katalytischen Domänen betrifft, wurde ihre Struktur mit Ratten-Tyrosinhydroxylase unter Verwendung von Röntgenkristallographie gefunden . Dies hat gezeigt, dass seine Struktur der von Phenylalanin-Hydroxylase und Tryptophan-Hydroxylase sehr ähnlich ist ; zusammen bilden die drei eine Familie von homologen aromatischen Aminosäure-Hydroxylasen .
Verordnung

Durch Phosphorylierung wird die Tyrosin-Hydroxylase-Aktivität kurzfristig erhöht . Die regulatorische Domäne der Tyrosinhydroxylase enthält mehrere Serin (Ser)-Reste, einschließlich Ser8, Ser19, Ser31 und Ser40, die von einer Vielzahl von Proteinkinasen phosphoryliert werden . Ser40 wird durch die cAMP-abhängige Proteinkinase phosphoryliert . Ser19 (und in geringerem Maße Ser40) wird durch die Calcium-Calmodulin-abhängige Proteinkinase phosphoryliert . MAPKAPK2 (Mitogen-activated-protein kinase-activating protein kinase) bevorzugt Ser40, phosphoryliert aber auch Ser19 etwa halb so schnell wie Ser40. Ser31 wird von ERK1 und ERK2 ( extrazellulär regulierte Kinasen 1&2) phosphoryliert und erhöht die Enzymaktivität in geringerem Maße als die Ser40-Phosphorylierung. Die Phosphorylierung an Ser19 und Ser8 hat keinen direkten Einfluss auf die Tyrosin-Hydroxylase-Aktivität. Die Phosphorylierung bei Ser19 erhöht jedoch die Phosphorylierungsrate bei Ser40, was zu einer Erhöhung der Enzymaktivität führt. Die Phosphorylierung an Ser19 verursacht eine zweifache Aktivitätssteigerung durch einen Mechanismus, der die 14-3-3-Proteine erfordert . Die Phosphorylierung an Ser31 bewirkt eine leichte Aktivitätssteigerung, wobei der Mechanismus hier unbekannt ist. Tyrosinhydroxylase wird etwas gegen Hitzeinaktivierung stabilisiert, wenn die regulatorischen Serine phosphoryliert werden.
Tyrosin-Hydroxylase kommt hauptsächlich im Zytosol vor, obwohl sie in gewissem Umfang auch in der Plasmamembran gefunden wird. Die Membranassoziation kann mit der Katecholaminpackung in Vesikeln und dem Export durch die synaptische Membran zusammenhängen. Die Bindung von Tyrosinhydroxylase an Membranen umfasst die N-terminale Region des Enzyms und kann durch eine Dreiwege-Wechselwirkung zwischen 14-3-3-Proteinen, der N-terminalen Region der Tyrosinhydroxylase und negativ geladenen Membranen reguliert werden.
Tyrosinhydroxylase kann auch durch Hemmung reguliert werden. Die Phosphorylierung bei Ser40 lindert die Rückkopplungshemmung durch die Katecholamine Dopamin, Adrenalin und Noradrenalin. Die Katecholamine fangen das Eisen im aktiven Zentrum im Fe(III)-Zustand ein und hemmen das Enzym.
Es wurde gezeigt, dass die Expression von Tyrosinhydroxylase durch die Expression von SRY beeinflusst werden kann . Die Herunterregulierung des SRY-Gens in der Substantia nigra kann zu einer Abnahme der Tyrosinhydroxylase-Expression führen.
Die Langzeitregulation der Tyrosinhydroxylase kann auch durch Phosphorylierungsmechanismen vermittelt werden. Hormone (zB Glukokortikoide ), Medikamente (zB Kokain ) oder sekundäre Botenstoffe wie cAMP erhöhen die Tyrosin-Hydroxylase- Transkription . Die Erhöhung der Tyrosinhydroxylase-Aktivität aufgrund der Phosphorylierung kann durch Nikotin bis zu 48 Stunden lang aufrechterhalten werden . Die Aktivität der Tyrosinhydroxylase wird chronisch (Tage) durch die Proteinsynthese reguliert .
Klinische Bedeutung
Ein Tyrosin-Hydroxylase-Mangel führt zu einer gestörten Synthese von Dopamin sowie von Adrenalin und Noradrenalin . Es wird durch eine progressive Enzephalopathie und eine schlechte Prognose dargestellt. Klinische Merkmale sind Dystonie , die minimal oder nicht auf Levodopa anspricht , extrapyramidale Symptome, Ptosis , Miosis und posturale Hypotonie . Dies ist eine fortschreitende und oft tödliche Erkrankung, die durch Levodopa verbessert, aber nicht geheilt werden kann. Das Ansprechen auf die Behandlung ist variabel und das langfristige und funktionelle Ergebnis ist unbekannt. Um eine Grundlage für ein besseres Verständnis der Epidemiologie, der Genotyp/Phänotyp-Korrelation und des Outcomes dieser Erkrankungen und ihres Einflusses auf die Lebensqualität der Patienten zu schaffen und um diagnostische und therapeutische Strategien zu bewerten, wurde von der nichtkommerziellen Internationalen Arbeitsgruppe ein Patientenregister eingerichtet Neurotransmitter-bezogene Störungen (iNTD). Außerdem können Veränderungen der Tyrosin-Hydroxylase-Enzymaktivität an Erkrankungen wie der Segawa-Dystonie , der Parkinson-Krankheit und der Schizophrenie beteiligt sein . Tyrosinhydroxylase wird durch phosphorylierungsabhängige Bindung an 14-3-3 Proteine aktiviert. Da die 14-3-3-Proteine wahrscheinlich auch mit neurodegenerativen Erkrankungen wie der Alzheimer-Krankheit , der Parkinson-Krankheit und der Huntington-Krankheit in Verbindung gebracht werden , stellt dies eine indirekte Verbindung zwischen der Tyrosinhydroxylase und diesen Erkrankungen her. Die Aktivität der Tyrosin-Hydroxylase im Gehirn von Patienten mit Alzheimer-Krankheit ist im Vergleich zu gesunden Personen deutlich reduziert. Tyrosinhydroxylase ist auch ein Autoantigen in Polyendokrine Autoimmunerkrankungen (APS) Typ I .
Eine konsistente Anomalie bei der Parkinson-Krankheit ist die Degeneration von dopaminergen Neuronen in der Substantia nigra , was zu einer Verringerung der striatalen Dopaminspiegel führt. Da Tyrosinhydroxylase die Bildung von L-DOPA katalysiert, dem geschwindigkeitsbestimmenden Schritt in der Biosynthese von Dopamin , verursacht ein Tyrosinhydroxylase-Mangel keine Parkinson-Krankheit, sondern führt typischerweise zu infantilem Parkinsonismus, obwohl das Spektrum sich auf einen Zustand ausdehnt, der Dopamin ähnelt. reaktionsfähige Dystonie . Eine direkte pathogenetische Rolle der Tyrosinhydroxylase wurde ebenfalls vorgeschlagen, da das Enzym eine Quelle für H 2 O 2 und andere reaktive Sauerstoffspezies (ROS) und ein Ziel für radikalvermittelte Schäden ist. Es wurde gezeigt, dass L- DOPA durch Tyrosinhydroxylase von Säugetieren effektiv oxidiert wird, was möglicherweise zu den zytotoxischen Wirkungen von L- DOPA beiträgt. Wie andere zelluläre Proteine ist auch die Tyrosinhydroxylase ein mögliches Ziel für schädliche Veränderungen, die durch ROS induziert werden. Dies legt nahe, dass ein Teil der oxidativen Schäden an Tyrosinhydroxylase durch das Tyrosinhydroxylasesystem selbst erzeugt werden könnte.
Tyrosinhydroxylase kann durch den Wirkstoff α-Methyl-para-Tyrosin ( Metirosin ) gehemmt werden . Diese Hemmung kann aufgrund des Fehlens der Vorstufe L- Dopa ( L- 3,4-Dyhydroxyphenylalanin), die von Tyrosinhydroxylase synthetisiert wird, zu einer Erschöpfung von Dopamin und Noradrenalin im Gehirn führen . Dieses Medikament wird selten verwendet und kann Depressionen verursachen, aber es ist nützlich bei der Behandlung von Phäochromozytomen und auch resistenter Hypertonie . Ältere Beispiele für in der Literatur erwähnte Inhibitoren umfassen Oudenon und Aquayamycin .
Verweise
Weiterlesen
- Masserano JM, Weiner N. (1983). „Tyrosin-Hydroxylase-Regulierung im Zentralnervensystem“. Molekulare und zelluläre Biochemie . 53–54 (1–2): 129–52. doi : 10.1007/BF00225250 . PMID 6137760 . S2CID 19361815 .
- Meloni R, Biguet NF, Mallet J (2002). „Postgenomische Ära und Genentdeckung für psychiatrische Erkrankungen: Gibt es eine neue Kunst des Handels? Das Beispiel des Mikrosatelliten HUMTH01 im Tyrosin-Hydroxylase-Gen“. Molekulare Neurobiologie . 26 (2–3): 389–403. doi : 10.1385/MN:26:2-3:389 . PMID 12428766 . S2CID 8814324 .
- Joh TH, Park DH, Reis DJ (Okt. 1978). "Direkte Phosphorylierung von Gehirn-Tyrosin-Hydroxylase durch zyklische AMP-abhängige Proteinkinase: Mechanismus der Enzymaktivierung" . Proceedings of the National Academy of Sciences of the United States of America . 75 (10): 4744–8. Bibcode : 1978PNAS...75.4744J . doi : 10.1073/pnas.75.10.4744 . PMC 336196 . PMID 33381 .
- Haycock JW, Ahn NG, Cobb MH, Krebs EG (März 1992). „ERK1 und ERK2, zwei Mikrotubuli-assoziierte Protein-2-Kinasen, vermitteln die Phosphorylierung von Tyrosinhydroxylase an Serin-31 in situ“ . Proceedings of the National Academy of Sciences of the United States of America . 89 (6): 2365–9. Bibcode : 1992PNAS...89.2365H . doi : 10.1073/pnas.89.6.2365 . PMC 48658 . PMID 1347949 .
- Haycock JW (Juli 1990). "Phosphorylierung von Tyrosinhydroxylase in situ an Serin 8, 19, 31 und 40" . Die Zeitschrift für biologische Chemie . 265 (20): 11682–91. doi : 10.1016/S0021-9258(19)38451-0 . PMID 1973163 .
- Craig SP, Buckle VJ, Lamouroux A, Mallet J, Craig I (1986). „Lokalisierung des menschlichen Tyrosin-Hydroxylase-Gens zu 11p15: Genduplikation und Evolution von Stoffwechselwegen“. Zytogenetik und Zellgenetik . 42 (1–2): 29–32. doi : 10.1159/000132246 . PMID 2872999 .
- Grima B, Lamouroux A, Boni C, Julien JF, Javoy-Agid F, Mallet J (1987). „Ein einzelnes menschliches Gen, das für mehrere Tyrosinhydroxylasen mit unterschiedlichen vorhergesagten funktionellen Eigenschaften kodiert“. Natur . 326 (6114): 707–11. Bibcode : 1987Natur.326..707G . doi : 10.1038/326707a0 . PMID 2882428 . S2CID 4314044 .
- N. Kaneda, K. Kobayashi, H. Ichinose, F. Kishi, A. Nakazawa, Y. Kurosawa, K. Fujita, T. Nagatsu (Aug. 1987). „Isolierung eines neuartigen cDNA-Klons für humane Tyrosinhydroxylase: Alternatives RNA-Spleißen produziert vier Arten von mRNA aus einem einzigen Gen“. Biochemische und biophysikalische Forschungskommunikation . 146 (3): 971–5. doi : 10.1016/0006-291X(87)90742-X . PMID 2887169 .
- K. Kobayashi, N. Kaneda, H. Ichinose, F. Kishi, A. Nakazawa, Y. Kurosawa, K. Fujita, T. Nagatsu (August 1987). "Isolierung eines cDNA-Klons voller Länge, der für humane Tyrosinhydroxylase Typ 3 kodiert" . Nukleinsäureforschung . 15 (16): 6733. doi : 10.1093/nar/15.16.6733 . PMC 306135 . PMID 2888085 .
- O'Malley KL, Anhalt MJ, Martin BM, Kelsoe JR, Winfield SL, Ginns EI (Nov. 1987). „Isolierung und Charakterisierung des menschlichen Tyrosin-Hydroxylase-Gens: Identifizierung von 5' alternativen Spleißstellen, die für mehrere mRNAs verantwortlich sind“. Biochemie . 26 (22): 6910–4. doi : 10.1021/bi00396a007 . PMID 2892528 .
- Le Bourdellès B, Boularand S, Boni C, Horellou P, Dumas S, Grima B, Mallet J (März 1988). „Analyse der 5'-Region des menschlichen Tyrosin-Hydroxylase-Gens: kombinatorische Muster des Exon-Spleißens erzeugen mehrere regulierte Tyrosin-Hydroxylase-Isoformen“. Zeitschrift für Neurochemie . 50 (3): 988–91. doi : 10.1111/j.1471-4159.1988.tb03009.x . PMID 2892893 . S2CID 44602622 .
- Ginns EI, Rehavi M, Martin BM, Weller M, O'Malley KL, LaMarca ME, McAllister CG, Paul SM (Mai 1988). "Expression von Human-Tyrosin-Hydroxylase-cDNA in wirbellosen Zellen unter Verwendung eines Baculovirus-Vektors" . Die Zeitschrift für biologische Chemie . 263 (15): 7406–10. doi : 10.1016/S0021-9258(18)68656-9 . PMID 2896667 .
- K. Kobayashi, N. Kaneda, H. Ichinose, F. Kishi, A. Nakazawa, Y. Kurosawa, K. Fujita, T. Nagatsu (Juni 1988). „Struktur des menschlichen Tyrosin-Hydroxylase-Gens: alternatives Spleißen von einem einzigen Gen macht die Erzeugung von vier mRNA-Typen aus“. Zeitschrift für Biochemie . 103 (6): 907–12. doi : 10.1093/oxfordjournals.jbchem.a122386 . PMID 2902075 .
- Coker GT, Vinnedge L, O'Malley KL (Dezember 1988). „Charakterisierung von Ratten- und Human-Tyrosin-Hydroxylase-Genen: funktionelle Expression beider Promotoren in neuronalen und nicht-neuronalen Zelltypen“. Biochemische und biophysikalische Forschungskommunikation . 157 (3): 1341-7. doi : 10.1016/S0006-291X(88)81022-2 . PMID 2905129 .
- Vulliet PR, Woodgett JR, Cohen P (Nov. 1984). "Phosphorylierung von Tyrosinhydroxylase durch Calmodulin-abhängige Multiproteinkinase" . Die Zeitschrift für biologische Chemie . 259 (22): 13680–3. doi : 10.1016/S0021-9258(18)89798-8 . PMID 6150037 .
- Zhou QY, Quaife CJ, Palmiter RD (Apr 1995). "Gezielte Zerstörung des Tyrosin-Hydroxylase-Gens zeigt, dass Katecholamine für die Entwicklung des Mausfötus erforderlich sind". Natur . 374 (6523): 640–3. Bibcode : 1995Natur.374..640Z . doi : 10.1038/374640a0 . PMID 7715703 . S2CID 4259663 .
- Lüdecke B, Bartholomé K (Juni 1995). „Häufige Sequenzvariante im menschlichen Tyrosinhydroxylase-Gen“. Humangenetik . 95 (6): 716. doi : 10.1007/BF00209496 . PMID 7789962 . S2CID 1057532 .
- Lüdecke B, Dworniczak B, Bartholomé K (Jan 1995). „Eine Punktmutation im Tyrosinhydroxylase-Gen im Zusammenhang mit dem Segawa-Syndrom“. Humangenetik . 95 (1): 123–5. doi : 10.1007/BF00225091 . PMID 7814018 . S2CID 26870241 .
- Knappskog PM, Flatmark T, Mallet J, Lüdecke B, Bartholomé K (Juli 1995). „Rezessiv vererbte L-DOPA-responsive Dystonie, verursacht durch eine Punktmutation (Q381K) im Tyrosin-Hydroxylase-Gen“. Humane molekulare Genetik . 4 (7): 1209–12. doi : 10.1093/hmg/4.7.1209 . PMID 8528210 .