HPV-positiver Oropharynxkarzinom - HPV-positive oropharyngeal cancer
| Humanes Papillomavirus - positiver oropharyngealer Krebs | |
|---|---|
| Andere Namen | HPV16+ Oropharynxkarzinom, HPV16+OPC |
 | |
| Mikroskopbild eines Tumors , der HPV-Positivität durch in-situ-Hybridisierung zeigt | |
| Spezialität |
Onkologie |
| Symptome | Wunde oder Blasen im hinteren Teil des Mundes, Schwierigkeiten beim Sprechen, Schlucken oder Atmen, Schwellung im Nacken, Appetitlosigkeit, Gewichtsverlust und Schwäche |
| Ursachen | Humanes Papillomavirus |
| Risikofaktoren | oraler sexueller Kontakt |
| Diagnosemethode | Endoskopie , Biopsie , Färbung für p16 , CT-Scan , |
| Differenzialdiagnose | Tabak assoziiert Oropharynxkarzinom |
| Verhütung | Impfung |
| Behandlung | Operation , Bestrahlung , Chemotherapie |
| Frequenz | 22.000 Fälle weltweit (2008) |
Humanes Papillomavirus-positives Oropharynxkarzinom ( HPV-positive OPC oder HPV+OPC ) ist eine Krebserkrankung ( Plattenepithelkarzinom ) des Rachens, die durch das humane Papillomavirus Typ 16 Virus (HPV16) verursacht wird. In der Vergangenheit wurde Krebs des Oropharynx (Hals) mit dem Konsum von Alkohol oder Tabak oder beidem in Verbindung gebracht, aber die meisten Fälle werden jetzt mit dem HPV- Virus in Verbindung gebracht , das durch oralen Kontakt mit den Genitalien erworben wurde ( oral-genitaler Sex ). einer Person, die eine genitale HPV-Infektion hat. Zu den Risikofaktoren gehören eine große Anzahl von Sexualpartnern, eine Vorgeschichte von oral-genitalem oder anal-oralem Sex , eine Partnerin mit einer Vorgeschichte von entweder einem abnormalen Pap-Abstrich oder einer zervikalen Dysplasie , chronischer Parodontitis und bei Männern jüngeres Alter beim ersten Geschlechtsverkehr und eine Vorgeschichte von Genitalwarzen . HPV-positiver OPC wird als eine vom HPV-negativen Oropharynxkarzinom (auch HPV-negative-OPC und HPV-OPC genannt) getrennte Krankheit angesehen .
HPV-positives OPC präsentiert sich auf eine von vier Arten: als asymptomatische Anomalie im Mund, die vom Patienten oder einem Angehörigen der Gesundheitsberufe wie einem Zahnarzt festgestellt wird; mit lokalen Symptomen wie Schmerzen oder Infektionen an der Tumorstelle; mit Schwierigkeiten beim Sprechen, Schlucken und/oder Atmen; oder als Schwellung im Nacken, wenn sich der Krebs auf lokale Lymphknoten ausgebreitet hat. Der Nachweis eines Tumorsuppressorproteins , bekannt als p16 , wird üblicherweise verwendet, um ein HPV-assoziiertes OPC zu diagnostizieren. Das Ausmaß der Erkrankung wird im Standard-Krebs- Staging-System unter Verwendung des AJCC- TNM- Systems beschrieben, basierend auf dem T-Stadium (Größe und Ausmaß des Tumors), N-Stadium (Ausmaß der Beteiligung regionaler Lymphknoten ) und M-Stadium (ob es Ausbreitung der Krankheit außerhalb der Region oder nicht) und zu einem Gesamtstadium von I–IV zusammengefasst. Im Jahr 2016 wurde für HPV+OPC ein separates Staging-System entwickelt, das sich von HPV-OPC unterscheidet.
Während die meisten Kopf-Hals-Krebserkrankungen zurückgegangen sind, da die Raucherquoten zurückgegangen sind, hat HPV-positives OPC zugenommen. Im Vergleich zu HPV-OPC-Patienten sind HPV-positive Patienten tendenziell jünger, haben einen höheren sozioökonomischen Status und rauchen seltener. Außerdem neigen sie zu kleineren Tumoren, sind aber eher mit einer Beteiligung der Halslymphknoten verbunden. In den Vereinigten Staaten und anderen Ländern hat die Zahl der Fälle von Oropharynxkarzinom stetig zugenommen, wobei die Inzidenz von HPV-positivem OPC schneller zunimmt als der Rückgang von HPV-negativem OPC. Der Anstieg ist insbesondere bei jungen Männern in den Industrieländern zu beobachten, und HPV-positive OPC machen mittlerweile den Großteil aller OPC-Fälle aus. Es werden Anstrengungen unternommen, um die Inzidenz von HPV-positivem OPC zu reduzieren, indem vor der Exposition mit dem Virus eine Impfung eingeführt wird , die die HPV-Typen 16 und 18 einschließt, die bei 95 % dieser Krebsarten gefunden werden. Erste Daten deuten auf eine Verringerung der Infektionsraten hin.
In der Vergangenheit war die Behandlung von OPC eine radikale Operation mit Zugang durch den Hals und Spaltung des Kieferknochens , was zu Morbidität und schlechten Überlebensraten führte. Später stellte die Strahlentherapie mit oder ohne Chemotherapie eine weniger entstellende Alternative dar, jedoch mit vergleichbar schlechten Ergebnissen. Jetzt haben neuere minimal-invasive chirurgische Techniken durch den Mund verbesserte Ergebnisse; in Fällen mit hohem Risiko folgt dieser Operation oft eine Bestrahlung und/oder Chemotherapie. In Ermangelung hochwertiger Evidenz darüber, welche Behandlung die besten Ergebnisse liefert, basieren Managemententscheidungen häufig auf einem oder mehreren der folgenden Faktoren: technische Faktoren, wahrscheinlicher Funktionsverlust und Patientenpräferenz. Das Vorhandensein von HPV im Tumor ist unabhängig von den verwendeten Behandlungsmethoden mit einem besseren Ansprechen auf die Behandlung und einem besseren Ergebnis sowie einem um fast 60 % verringerten Risiko, an der Krebserkrankung zu sterben, verbunden. Die meisten Rezidive treten lokal und innerhalb des ersten Jahres nach der Behandlung auf. Der Konsum von Tabak verringert die Überlebenschancen.
Anzeichen und Symptome
HPV+OPC präsentiert sich auf eine von vier Arten: als asymptomatische Anomalie im Mund, die vom Patienten oder einem Angehörigen der Gesundheitsberufe wie einem Zahnarzt festgestellt wird; mit lokalen Symptomen wie Schmerzen oder Infektionen an der Tumorstelle; mit Schwierigkeiten beim Sprechen, Schlucken und/oder Atmen; oder als Schwellung im Nacken (wenn sich der Krebs auf Lymphknoten ausgebreitet hat). Diese können von allgemeineren Symptomen wie Appetitlosigkeit, Gewichtsverlust und Schwäche begleitet sein.
Ursache

Die meisten Plattenepithelkarzinome der Schleimhaut im Kopf- und Halsbereich , einschließlich Oropharynxkarzinom (OPC), wurden in der Vergangenheit auf Tabak- und Alkoholkonsum zurückgeführt. Dieses Muster hat sich jedoch seit den 1980er Jahren stark verändert. Es wurde erkannt, dass einige Krebsarten ohne diese Risikofaktoren auftreten und ein Zusammenhang zwischen dem humanen Papillomavirus (HPV) und verschiedenen Plattenepithelkarzinomen, einschließlich OPC, erstmals 1983 beschrieben wurde. Seitdem häufen sich sowohl molekulare als auch epidemiologische Beweise, mit der Internationalen Agentur für Krebsforschung (IARC), die 1995 feststellte, dass die Hochrisiko-HPV-Typen 16 und 18 beim Menschen krebserregend sind, und 2007, dass HPV eine Ursache für Mundkrebs war. Die Inzidenz von humanem Papillomavirus (HPV)-positivem Krebs (HPV+OPC) nimmt zu, während die Inzidenz von HPV-negativen (HPV-OPC) zurückgeht, ein Trend, der in den kommenden Jahren voraussichtlich weiter zunehmen wird. Da es in Bezug auf den HPV-Status deutliche Unterschiede in der klinischen Präsentation und Behandlung gibt , wird HPV+OPC heute als eigenständiger biologischer und klinischer Zustand angesehen.
Humanes HPV wird seit langem mit der Pathogenese mehrerer anogenitaler Krebsarten in Verbindung gebracht, einschließlich jener des Anus , der Vulva , der Vagina , des Gebärmutterhalses und des Penis . Im Jahr 2007 wurde es auch durch molekulare und epidemiologische Beweise bei Krebserkrankungen, die außerhalb des Anogenitaltrakts auftreten, nämlich Mundkrebs, in Verbindung gebracht. Eine HPV-Infektion ist bei gesunden Personen weit verbreitet und wird durch Oralverkehr erworben . Obwohl weniger Daten verfügbar sind, ist die Prävalenz der HPV-Infektion bei Männern mindestens genauso häufig wie bei Frauen, wobei Schätzungen für 2004 bei US-amerikanischen Frauen im Alter von 14 bis 59 Jahren auf etwa 27 % lagen.
Die orale HPV-Infektion geht der Entwicklung von HPV+OPC voraus. Leichte Verletzungen der Schleimhaut dienen als Eintrittspforte für HPV, das so in die Basalschicht des Epithels einwirkt . Personen, die positiv auf eine orale Infektion mit dem HPV-Typ 16-Virus (HPV16) getestet wurden, haben ein 14-fach erhöhtes Risiko, HPV+OPC zu entwickeln. Immunsuppression scheint ein erhöhter Risikofaktor für HPV+OPC zu sein. Personen mit genetischen Variationen von TGF-β1 , insbesondere T869C, haben eher HPV16+OPC. TGF-β1 spielt eine wichtige Rolle bei der Kontrolle des Immunsystems. 1993 wurde festgestellt, dass Patienten mit humanen Papillomavirus (HPV)-assoziierten anogenitalen Karzinomen ein 4-fach erhöhtes Risiko für Tonsillen-Plattenepithelkarzinome aufwiesen. Obwohl Beweise darauf hindeuten, dass HPV16 die Hauptursache für OPC bei Menschen ist, die nicht dem Rauchen und Alkohol ausgesetzt sind, war nicht immer klar, inwieweit Tabak- und/oder Alkoholkonsum das Risiko von HPV+OPC erhöhen kann, aber es scheint, dass beides Rauchen und HPV-Infektion sind unabhängige und additive Risikofaktoren für die Entwicklung von OPC. Der Zusammenhang zwischen HPV-Infektion und Oropharynxkarzinom ist in Regionen des lymphoepithelialen Gewebes (Zungengrund und Gaumenmandeln) stärker als in Regionen mit geschichtetem Plattenepithel (weicher Gaumen und Zäpfchen). Eine Infektion mit dem humanen Herpesvirus-8 kann die Auswirkungen von HPV-16 verstärken.
Risikofaktoren
Zu den Risikofaktoren gehören eine hohe Anzahl von Sexualpartnern (25 % Zunahme >= 6 Partner), eine Vorgeschichte von oral-genitalem Geschlechtsverkehr (125% >= 4 Partner) oder Anal-Oralverkehr , eine Partnerin mit einer Vorgeschichte von entweder abnormer Pap-Abstrich oder zervikale Dysplasie , chronische Parodontitis und bei Männern abnehmendes Alter beim ersten Geschlechtsverkehr und Vorgeschichte von Genitalwarzen .
Pathologie

Karzinome des Mund - Rachenraum entstehen in erster Linie in lingual und Gaumenmandel lymphoide Gewebe , die durch respiratorische ausgekleidet ist Plattenepithelkarzinom Schleimhautepithel, die sein können stülpt im Lymphgewebe. Daher entsteht der Tumor zuerst in versteckten Krypten. OPC wird nach dem Grad der Plattenepithel- und Keratindifferenzierung in gut, mäßig oder schlecht (hoch) differenziert eingestuft. Andere pathologische Merkmale sind das Vorhandensein einer fingerartigen Invasion, einer perineuralen Invasion , der Invasionstiefe und der Entfernung des Tumors von den Resektionsrändern. Phänotypische Varianten umfassen basaloides Plattenepithelkarzinom , eine hochgradige Form ( siehe Chung Abb. 35-3(C) und Abbildung hier). Sie sind am häufigsten nicht keratinisierend. HPV+OPC unterscheidet sich von HPV-OPC auch dadurch, dass es eher fokal als multifokal ist und nicht mit einer prämalignen Dysplasie assoziiert ist . HPV+OPC-Patienten haben daher ein geringeres Risiko, andere Malignome im Kopf-Hals-Bereich zu entwickeln, im Gegensatz zu anderen Kopf-Hals-Primärtumoren, die assoziierte zweite Neoplasien aufweisen können, die gleichzeitig (synchron) oder zu einem entfernten Zeitpunkt (metachron) auftreten können ), sowohl im Kopf-Hals-Bereich als auch weiter entfernt. Dies deutet darauf hin, dass die durch das Virus erzeugten onkogenen Veränderungen räumlich begrenzt sind und nicht mit einem Felddefekt zusammenhängen.
Anatomie
Der Oropharynx , im hinteren Teil des Mundes , bildet einen Kreis und umfasst den Zungengrund (hinteres Drittel) unten, die Mandeln auf jeder Seite und den weichen Gaumen oben zusammen mit den Wänden des Pharynx , einschließlich der vorderen Epiglottis , epiglottische Valleculae und Kiemenspalte an seiner Basis. Der Oropharynx ist eine von drei Unterteilungen des Inneren des Pharynx, basierend auf ihrer Beziehung zu benachbarten Strukturen (Nasen-Rachen ( Nasopharynx ), Mund-Rachen (Oropharynx) und Kehlkopf-Rachen ( Laryngopharynx - auch Hypopharynx genannt), von oben nach unten ). Der Pharynx ist ein halbkreisförmiger fibromuskulärer Schlauch, der die Nasenhöhlen oben mit dem Kehlkopf (Sprachbox) und der Speiseröhre (Speiseröhre) verbindet, wo sich der Kehlkopf vor der Speiseröhre befindet.
Der Oropharynx liegt zwischen dem Mund (Mundhöhle) vorne und dem Laryngopharynx unten, der ihn vom Kehlkopf trennt. Die Obergrenze des Oropharynx wird durch den weichen Gaumen, die Untergrenze durch die Epiglottis und die Zungenwurzel markiert. Der Oropharynx kommuniziert mit dem Mund, vorne durch den sogenannten oropharyngealen Isthmus oder Isthmus der Fauces . Der Isthmus (dh die Verbindung) wird oben vom weichen Gaumen, unten vom hinteren Drittel der Zunge und seitlich von den Palatoglossusbögen gebildet . Die hinteren Drittel der Zunge oder der Zungengrundes enthalten zahlreiche Follikeln von lymphatischem Gewebe , die die Form Zungengrundtonsillen . Angrenzend an den Zungengrund ist die nach vorne gebogene Zungenfläche der Epiglottis durch mediane und laterale glossoepiglottische Falten mit der Zunge verbunden . Die Falten bilden kleine Mulden, die als epiglottische Valleculae bekannt sind. Die Seitenwände werden durch zwei vertikale Säulen auf jeder Seite markiert, die Säulen der Fauces oder Palatoglossalbögen. Genauer gesagt werden sie separat als Palatoglossusbogen anterior und als Palatopharyngealbogen posterior bezeichnet. Der vordere Bogen ist nach dem Palatoglossus-Muskel im Inneren benannt, der vom weichen Gaumen zur Zunge verläuft ( glossus ), während der hintere Bogen ebenfalls den Palato-Pharyngeus- Muskel enthält, der vom weichen Gaumen zum seitlichen Pharynx verläuft. Zwischen den Bögen liegt ein dreieckiger Raum, die Tonsillengrube, in der die Gaumenmandel liegt , ein weiteres lymphoides Organ.
Die äußeren Rachenwände, die aus den vier Konstriktoren bestehen, sind Teil des Schluckmechanismus . Die mikroskopische Anatomie besteht aus vier Schichten, nämlich vom Lumen nach außen, der Schleimhaut , der Submukosa , den Muskeln und der Fibrosa oder Faserschicht. Die Schleimhaut besteht aus geschichtetem Plattenepithel, das im Allgemeinen nicht keratinisiert ist, außer wenn es chronischen Reizstoffen wie Tabakrauch ausgesetzt ist. Die Submukosa enthält Aggregate von lymphoidem Gewebe.
Ausbreitungsmuster
Krebserkrankungen, die in der Tonsillengrube entstehen, breiten sich auf die zervikalen Lymphknoten aus , hauptsächlich die subdigastrischen (oberen Jugular-) Lymphknoten (Stufe II), mit sekundärer Beteiligung der mittleren (Stufe III) und unteren (Stufe IV) Jugularknoten und manchmal der hinteren Halswirbelsäule Knoten (Stufe V). Zungengrundkrebs, der sich auf die subdigastrischen und mittleren Jugularknoten ausbreitet, und gelegentlich hintere Halsknoten, die jedoch näher an der Mittellinie liegen, haben eher eine bilaterale Lymphknotenerkrankung. Tonsillenkarzinome breiten sich selten auf die kontralaterale Seite aus, es sei denn, sie betreffen die Mittellinie.
Mechanismus
Virologie
HPV-assoziierte Krebserkrankungen werden durch Hochrisiko-HPV-Stämme verursacht, hauptsächlich HPV-16 und HPV-18. HPV ist ein kleines unbehülltes DNA-Virus aus der Familie der Papillomaviren . Sein Genom kodiert für die frühen (E) Onkoproteine E5, E6 und E7 und die späten (L) Kapsidproteine L1 und L2. Durch Mikroläsionen gelangt das Virus in die Schleimhaut und infiziert dort die basale Zellschicht , die sich noch vermehren kann. Während sich das Virus in diesen Zellen nicht repliziert, stimuliert die Expression seiner frühen Gene die Proliferation und laterale Expansion der Basalzellen. Da die Viruspartikel dadurch in die darüber liegenden suprabasalen Schichten bewegt werden, kommt es zu einer späten viralen Genexpression, die die Replikation des zirkulären viralen Genoms ( siehe Abbildung) und der Strukturproteine ermöglicht. Da diese in die oberflächlichsten Schleimhautschichten geschoben werden, werden vollständige Viruspartikel zusammengesetzt und freigesetzt.
Onkogenese
Ein erhöhtes Risiko für HPV+OPC wird mehr als 15 Jahre nach HPV-Exposition beobachtet, was auf eine langsame Entwicklung der Krankheit hinweist, ähnlich wie bei Gebärmutterhalskrebs. Im Vergleich zu HPV-OPC ist die onkogene molekulare Progression von HPV+OPC kaum bekannt. Die beiden wichtigsten viralen Onkoproteine der Hochrisiko-HPV-Typen sind E6 und E7. Diese werden durchweg in malignen Zelllinien exprimiert, und wenn ihre Expression gehemmt wird, wird der maligne Phänotyp der Krebszellen blockiert. Jedes dieser Onkoproteine kann Zelllinien immortalisieren , ist jedoch effizienter, wenn beide exprimiert werden, da ihre separaten molekularen Rollen synergistisch sind . Die Onkogene E6 und E7 werden in die DNA der Wirtszelle integriert, und die von ihnen exprimierten Onkoproteine stören eine Vielzahl von vorwiegend antiproliferativen zellulären Regulationsmechanismen . Sie binden und inaktivieren den bekanntesten dieser Mechanismen, die Tumorsuppressorproteine p53 und das Retinoblastomprotein pRB (pRb), was zu genomischer Instabilität und anschließender Deregulierung des Zellzyklus führt ( siehe Chung et al., 2016 Abb. 35.2). Darüber hinaus sind Mechanismen für die letzten Schritte der malignen Transformation von HPV-infizierten Zellen erforderlich, die noch hervorgebracht werden müssen .
HPV- und HPV+OPC sind auf molekularer Ebene unterscheidbar. Das natürlich vorkommende ( Wildtyp ) p53 ist in zellulären Prozessen , einschließlich Autophagie , Reaktion auf DNA-Schäden, Zellzyklusregulation und Seneszenz , Apoptose und der Bildung von Adenosintriphosphat (ATP) durch oxidative Phosphorylierung, stark beteiligt . Das p53 kodierende Gen wird durch E6 auf Proteinebene inaktiviert und wird als Wildtyp in HPV+OPC gefunden, jedoch in HPV-OPC mutiert. Bei HPV+OPC erfährt das p53- Protein einen beschleunigten Abbau durch E6, wodurch seine Spiegel drastisch reduziert werden, während es bei HPV-OPC eine genetische Mutation durchmacht , die zur Synthese eines abnormalen p53-Proteins führen kann, das nicht nur als Tumorsuppressor inaktiv sein kann, sondern kann auch jedes nicht mutierte Wildtyp-p53 binden und inaktivieren, mit einer Erhöhung der onkogenen Aktivität. Obwohl p53-Mutationen bei HPV+OPC auftreten, sind sie weitaus seltener als bei HPV-OPC (26% vs. 48%) und scheinen das klinische Ergebnis nicht zu beeinflussen.
Das pRb-Protein wird in HPV+OPC durch E7 inaktiviert, aber in HPV-OPC ist es der p16-Tumorsuppressorteil des pRb-Tumorsuppressornetzwerks, der inaktiviert wird. Auch der pRb-Weg wird durch E7 anstelle von Cyclin D1- Amplifikation inaktiviert . CDKN2A ist ein Tumorsuppressorgen, das für ein Tumorsuppressorprotein p16 (Cyclin-abhängiger Kinase-Inhibitor 2A) kodiert und die Kinaseaktivität der Cyclin-abhängigen Kinasen CDK4 und CDK6 hemmt , die wiederum einen Zellzyklusarrest induzieren. Die p16-Expression ist zellzyklusabhängig und wird nur in etwa 5–10% des normalen Plattenepithels fokal exprimiert. Wie die meisten HPV+-Krebsformen exprimieren HPV+OPC p16, aber letzteres wirkt nicht als Tumorsuppressor, da der Mechanismus, durch den dies erreicht wird, pRb, durch E7 inaktiviert wurde. p16 wird aufgrund des E7-bedingten Verlusts von pRB mit reduzierter negativer Rückkopplung hochreguliert ( überexprimiert ), während es in bis zu 90 % der HPV-OPC herunterreguliert wird. Diese diffuse Überexpression in den Tumorzellen liefert einen diagnostischen Marker für eine HPV-Beteiligung. Obwohl HPV E6 und E7 die Tumorsuppressoraktivität reduzieren, tun sie dies weniger als genetische und epigenetische Prozesse bei HPV-OPC.
Die Tonsillen Epithelien ( Palatin und lingual ) teilen ähnliche nonkeratinization Eigenschaften mit dem Gebärmutterhals , wo HPV - Infektion die Hauptrolle in Fällen spielt Gebärmutterhalskrebs . Auch E6 und E7 können HPV+OPC immunogener machen als HPV-OPC, da bei diesen Patienten Anti-E6- und E7- Antikörper nachgewiesen werden können. Dies wiederum könnte das maligne Verhalten von HPV+OPC einschränken, und das Vorhandensein von Antikörpern wurde mit einer besseren Prognose in Verbindung gebracht, während die Behandlung die Immunogenität des Tumors und damit das Ansprechen verbessern kann, wobei jedoch nicht klar ist, in welchem Ausmaß. Die Ergebnisse sind auch mit einer verbesserten adaptiven Immunität verbunden .
Diagnose

Biopsie
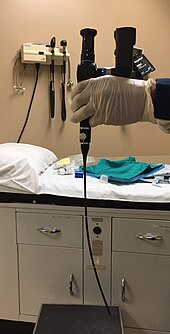
Die Erstdiagnose erfordert die Visualisierung des Tumors entweder durch den Mund oder endoskopisch durch die Nase mit einem Rhinoskop , wie rechts abgebildet, gefolgt von einer Biopsie .
Unterscheidung von HPV+OPC von HPV-OPC
HPV+OPC wird in der Regel in einem fortgeschritteneren Stadium diagnostiziert als HPV-OPC, wobei 75–90% regionale Lymphknoten befallen. Darüber hinaus ist das nicht keratinisierende Plattenepithelkarzinom stark mit HPV-OPC assoziiert.
Genetische Signaturen von HPV+ und HPV-OPC sind unterschiedlich. HPV + OPC ist mit dem Expressionsniveau der E6/E7-mRNAs und von p16 verbunden . HPV16 E6/E7-positive Fälle sind histopathologisch durch ihre verruköse oder papilläre ( nippelartige ) Struktur und Koilocytose der angrenzenden Schleimhaut gekennzeichnet. Ungefähr 15 % der HNSCCs werden durch eine HPV16-Infektion und die anschließende konstitutive Expression von E6 und E7 verursacht, und einige HPV-initiierte Tumoren können während der Tumorprogression ihre ursprünglichen Eigenschaften verlieren . Hochrisiko-HPV-Typen können durch eine Dysregulation der Zellzykluskontrolle mit einem oralen Karzinom in Verbindung gebracht werden , was zur oralen Karzinogenese und der Überexpression von mdm2, p27 und Cathepsin B beiträgt.
HPV+OPC ist nicht nur durch die Anwesenheit von HPV-16 gekennzeichnet: Allein die Expression viraler Onkogene innerhalb der Tumorzellen sowie die Serum-Präsenz von E6- oder E7-Antikörpern ist eindeutig schlüssig für HPV+OPC.
Es gibt keine Standard-HPV-Testmethode bei Kopf-Hals-Karzinomen, sowohl in-situ-Hybridisierung (ISH) als auch Polymerase-Kettenreaktion (PCR) werden häufig verwendet. Beide Methoden haben eine vergleichbare Leistung für den HPV-Nachweis, es ist jedoch wichtig, geeignete Sensitivitätskontrollen zu verwenden. Immunhistochemische (IHC) -Färbung des Gewebes für p16 wird häufig als kostengünstiger Ersatz für HPV bei OPC im Vergleich zu ISH oder PCR verwendet, aber es gibt eine geringe Inzidenz von HPV-negativen p16-positiven Erkrankungen, die etwa 5 % von HPV ausmachen -OPC.
Inszenierung
Das Staging erfolgt in der Regel nach dem UICC / AJCC TNM- System (Tumor, Knoten, Metastasen). Das Staging basiert auf der klinischen Untersuchung , der diagnostischen Bildgebung und der Pathologie. In der Bildgebung können betroffene Lymphknoten zystisch erscheinen , ein Merkmal von HPV+OPC.
HPV+OPC wurde ähnlich behandelt wie stadienangepasstes und ortsangepasstes HPV-unabhängiges OPC, aber seine einzigartigen Merkmale, die raucherbedingten HPV-OPC-Kopf-Hals-Karzinomen gegenüberstehen, bei denen die Demografie der Patienten, Komorbiditäten, Risikofaktoren und Karzinogenese unterscheiden sich deutlich, legen nahe, dass ein eigenes Staging-System entwickelt wird, um den Schweregrad der Erkrankung und ihre Prognose angemessener darzustellen. Standardmäßiges AJCC TNM-Staging, wie die siebte Ausgabe (2009) obwohl es für HPV-OPC prädiktiv ist, hat keinen prognostischen Wert bei HPV+OPC. Die 8. Ausgabe des AJCC TNM Staging Manual (2016) enthält diese spezifische Staging für HPV+OPC. Ab 2018 Behandlungsleitlinien entwickeln sich zur Verantwortung für die unterschiedlichen Ergebnisse bei HPV + OPC beobachtet. Folglich wird eine weniger intensive (De-Intensivierung) von Strahlen- oder Chemotherapie sowie eine spezifische Therapie untersucht, wobei HPV + OPC in klinische Studien aufgenommen werden , um die Krankheitskontrolle zu erhalten und die Morbidität in ausgewählten Gruppen basierend auf modifiziertem TNM-Staging und Raucherstatus zu minimieren .
HPV+-Krebs des Oropharynx werden wie folgt eingestuft (AJCC 8. Aufl. 2016): Tumorstadium
- T0 keine primäre identifiziert
- T1 2 cm oder weniger in größter Abmessung
- T2 2–4 cm
- T3 >4 cm oder Verlängerung zur lingualen Oberfläche der Epiglottis
- T4 mäßig fortgeschrittene lokale Erkrankung, eindringender Kehlkopf, äußerer Zungenmuskel, medialer Pterygoideus, harter Gaumen oder Unterkiefer oder darüber hinaus
Knotenstadium
- Nx regionale Lymphknoten können nicht beurteilt werden
- N0 keine regionalen Lymphknoten beteiligt
- N1 ein oder mehrere ipsilaterale Knoten betroffen, weniger als 6 cm
- N2 kontralaterale oder bilaterale Lymphknoten, weniger als 6 cm
- N3-Lymphknoten größer als 6 cm
Klinisches Stadium
- Stufe I: T0N1, T1–2N0–1
- Stufe II: T0N2, T1–3N2, T3N0–2
- Stufe III: T0-3N3, T4N0-3
- Stadium IV: alle Metastasen (M1)
Die veröffentlichte Literatur und laufende klinische Studien verwenden jedoch die ältere siebte Auflage, die nicht zwischen HPV+OPC und HPV-OPC unterscheidet – siehe Oropharynxkarzinom – Stadien . Die T-Stufen sind zwischen AJCC 7 und AJCC 8 im Wesentlichen ähnlich, mit zwei Ausnahmen. Tis ( Carcinoma in situ ) wurde eliminiert und die Unterteilung von T4 in Unterstadien (zB T4a) aufgehoben. Die wichtigsten Veränderungen liegen in den N-Stadien und damit im gesamten klinischen Stadium. N0 bleibt gleich, aber wie bei der T-Stufe wurden Unterstufen wie N2a eliminiert. Die extrakapsuläre Extension (ECE), auch als extranodale Extension (ENE) bezeichnet, also das Eindringen des Tumors über die Lymphknotenkapsel hinaus, wurde als Staging-Kriterium eliminiert.
Dies führt dazu, dass ein HPV+OPC-Tumor ein niedrigeres Stadium erhält, als wenn es HPV-OPC wäre. Zum Beispiel würde ein 5 cm großer Tumor mit einem beteiligten ipsilateralen Knoten, der 5 cm groß ist, aber eine ECE aufweist, als T3N3bM0-Stadium IVB bei HPV-, aber als T3N1M0-Stadium II bei HPV+ angesehen.
Verhütung

Exposition vermeiden
Die Prävention von HPV+OPC beinhaltet die Vermeidung oder Reduzierung der Exposition gegenüber Risikofaktoren, wo dies möglich ist.
Impfung
Etwa 90 % der HPV+OPC tragen HPV 16 und weitere 5 % Typ 18. Diese beiden Typen sind beide Ziele der verfügbaren Impfstoffe. HPV-Impfstoffe, die vor der Exposition verabreicht werden, können eine anhaltende Genitalinfektion und die daraus resultierende Präkanzerose verhindern. Daher haben sie ein theoretisches Potenzial, eine orale HPV-Infektion zu verhindern. Eine Überprüfungsstudie aus dem Jahr 2010 hat ergeben, dass eine orale HPV16-Infektion bei den 3.977 analysierten gesunden Probanden selten war (1,3%).
Behandlung
Die Ziele der Behandlung sind die Optimierung des Überlebens und der lokoregionären Krankheitskontrolle und die Verhinderung einer Ausbreitung in entfernte Körperregionen ( Metastasierung ) bei gleichzeitiger Minimierung der kurz- und langfristigen Morbidität . Es gibt keine qualitativ hochwertigen Evidenz der Stufe I aus prospektiven klinischen Studien zu HPV+OPC, daher müssen sich Behandlungsrichtlinien auf Daten aus der Behandlung von OPC im Allgemeinen und aus einigen retrospektiven ungeplanten Untergruppen dieser Studien zusammen mit Daten zu Kopf-Hals-Krebs im Allgemeinen stützen . Die Behandlung von OPC beruhte traditionell auf Strahlentherapie , Chemotherapie und/oder anderen systemischen Behandlungen und chirurgischer Resektion. Abhängig vom Stadium und anderen Faktoren kann die Behandlung eine Kombination von Modalitäten umfassen . Das Standbein war in den meisten Fällen die Strahlentherapie. eine gepoolte Analyse veröffentlichter Studien deutete auf eine vergleichbare Krankheitskontrolle zwischen Bestrahlung und Operation hin, jedoch auf höhere Komplikationsraten bei Operation +/- Bestrahlung. Idealerweise wird ein Single-Modality-Ansatz bevorzugt, da die Triple-Modalität mit viel mehr Toxizität verbunden ist und ein multidisziplinäres Team in einem großen Zentrum mit hohem Patientenaufkommen empfohlen wird.
Unterschiede in der Reaktion auf die Behandlung zwischen HPV-OPC und HPV+OPC können Unterschiede im Ausmaß und in der Art und Weise umfassen, in der zelluläre Wachstumsregulationswege in den beiden Formen von OPC verändert werden. Bei HPV+OPC beispielsweise lassen die HPV-E6- und E7-Onkogene lediglich die p53- und pRb-Wege inaktiv, wodurch die Möglichkeit einer Reaktivierung dieser Wege durch Herunterregulieren (Reduzieren) der Expression der Onkogene offen bleibt. Dies steht im Gegensatz zu der mutierten Form von p53, die in HPV-OPC gefunden wird und mit einer Behandlungsresistenz verbunden ist. Darüber hinaus wird vermutet, dass die Wirkungen von E6 und E7 auf diese Stoffwechselwege den Tumor strahlenempfindlicher machen, möglicherweise durch Interferenz mit Mechanismen wie DNA-Reparatur , Repopulationssignalisierung und Zellzyklus-Umverteilung. Die Mikroumgebung ist ebenfalls wichtig, da die Strahlung die Immunantwort des Wirts auf virale Antigene erhöht, die auf dem Tumor exprimiert werden. Außerdem besteht ein Zusammenhang zwischen einer Zunahme tumorinfiltrierender Lymphozyten und zirkulierender weißer Blutkörperchen bei HPV+OPC-Patienten und einer besseren Prognose. Dies impliziert eine Rolle für ein adaptives Immunsystem bei der Unterdrückung der Tumorprogression .
Operation
Historisch gesehen war die Operation der einzige Zugang zu Kopf-Hals-Krebs. Chirurgische Behandlung von OPC durch signifikante Morbidität mit einem transzervikaler (durch den Hals) Ansatz, oft Einbeziehung mandibulotomy, in denen die Kieferknochen ( Mandibula ) geteilt werden. Dies wird als offene Operationstechnik bezeichnet. Folglich gingen chirurgische Ansätze zugunsten der Bestrahlung zurück. In den Vereinigten Staaten ging der Einsatz von chirurgischen Eingriffen von 41% der Fälle im Jahr 1998 auf 30% im Jahr 2009 zurück, dem Jahr, in dem die Food and Drug Administration den Einsatz der neueren Techniken genehmigte.
Diese Verbesserungen der chirurgischen Techniken haben es ermöglicht, dass viele Tumore durch transorale (durch den Mund) chirurgische Ansätze (TOS) unter Verwendung der transoralen endoskopischen Kopf-Hals-Chirurgie (HNS) reseziert (entfernt) werden . Folglich wurde die Chirurgie immer häufiger eingesetzt und stieg bis 2012 auf 35 % der Fälle. Dieser Ansatz hat sich als sicher , wirksam und verträglich erwiesen und umfasst zwei hauptsächliche minimalinvasive Techniken, die transorale Roboterchirurgie (TORS) und die transorale Lasermikrochirurgie (TLM). Es wurden keine direkten Vergleiche dieser beiden Techniken durchgeführt, und klinische Studien bei Kopf-Hals-Tumoren wie ECOG 3311 erlauben beides. Sie sind mit einer erheblichen postoperativen Morbidität verbunden, abhängig vom Ausmaß der Resektion, aber im Vergleich zu älteren Techniken haben sie einen kürzeren Krankenhausaufenthalt, eine schnellere Genesung, weniger Schmerzen und eine geringere Notwendigkeit einer Gastrostomie oder Tracheostomie und weniger Langzeitwirkungen, die bei Abwesenheit minimal sind postoperativer Bestrahlung (RT) oder Chemoradiation (CRT). TORS hat den praktischen Vorteil, dass abgewinkelte Teleskope und rotierende Roboterarme für eine bessere Sichtlinie sorgen. Auch die Ergebnisse minimal-invasiver Verfahren sind im Vergleich zu invasiveren Verfahren günstig. Im Frühstadium der Erkrankung, einschließlich der Beteiligung von Halsknoten, führt TORS zu einer 2-Jahres-Überlebensrate von 80–90%. Ebenso wird für TLM eine 5-Jahres-Überlebensrate von 78 % und eine lokale Kontrollrate von 85–97 % angegeben. Zusätzlich zur frühen Erkrankung wurde in fortgeschrittenen Fällen minimal-invasive Chirurgie mit bis zu 90 % lokaler Kontrolle und krankheitsspezifischem Überleben eingesetzt. Postoperatives Schlucken war in 87% ausgezeichnet, aber langfristige Dysphagie war mit größeren (T4) Krebsarten verbunden, insbesondere wenn der Zungengrund betroffen war.
Die Einzelheiten des chirurgischen Vorgehens hängen von der Lage und Größe des Primärtumors und seinem N-Stadium ab. Eine Neck dissection zur Untersuchung der abfließenden Lymphknoten kann gleichzeitig oder als zweites Staging-Verfahren durchgeführt werden. Bei Tumoren der Tonsillen und der lateralen Rachenwand und klinisch nodal-negativer (N0)-Krankheit umfasst die Dissektion des Halses typischerweise die Level 2–4 ( siehe Diagramm in Dubner 2017 ) ipsilateral . Wenn Knoten klinisch beteiligt sind, hängt die Dissektion von der Lage und Größe des Knotens oder der Knoten ab. Bei Zungengrundprimärn nahe der Mittellinie wird eine beidseitige Präparation empfohlen.
Pathologisches Staging
Ein Vorteil eines primären chirurgischen Zugangs ist die Menge der verfügbaren pathologischen Informationen, einschließlich Grad, Randstatus und Grad der Lymphknotenbeteiligung. Dies kann das Staging ändern, da bis zu 40% der Patienten ein anderes postoperatives pathologisches Stadium aufweisen können als ihr präoperatives klinisches Stadium. In einer Studie wurde bei 24 % das Stadium reduziert (downstage), was sich auf die spätere Entscheidungsfindung auswirken kann, einschließlich einer Verringerung der Intensität und der Morbidität. Im Vereinigten Königreich hat das Royal College of Pathologists (1998) die Berichterstattung über Operationsränder mit zwei Kategorien, "schleimhaut" und "tief", standardisiert und für jede Gruppe auf der Grundlage des mikroskopischen Abstands vom invasiven Krebs zum Rand erstellt. wie folgt: mehr als 5 mm (klar), 1–5 mm (nah) und weniger als 1 mm (beteiligt).
Adjuvante postoperative Therapie
Die Daten zum Einsatz der postoperativen Strahlentherapie (PORT) beschränken sich weitgehend auf historische oder retrospektive Studien und nicht auf hochwertige randomisierte klinische Studien und basieren auf der Gesamtpopulation von Patienten mit Kopf-Hals-Tumoren und nicht auf spezifischen Studien zu HPV+OPC. die nur einen sehr kleinen Teil der untersuchten Bevölkerung ausmachte. Trotz operativer Exzision kommt es in den fortgeschritteneren Fällen häufig zu einem lokalen und regionalen Rezidiv des Krebses, verbunden mit einer Ausbreitung außerhalb des Kopf-Hals-Bereichs ( Metastasen ). Das Risiko eines späteren Rezidivs wurde bei Tumoren am höchsten eingeschätzt, bei denen die Pathologie einen Tumor an den Rändern der Resektion (positive Ränder), mehrere befallene regionale Lymphknoten und eine Ausdehnung des Tumors außerhalb der Lymphknotenkapsel (extrakapsuläre Ausdehnung) zeigt ), basierend auf historischen Erfahrungen mit Kopf-Hals-Krebs. PORT wurde in den 1950er Jahren eingeführt, um Behandlungsversagen allein durch chirurgische Eingriffe zu reduzieren. Obwohl es nie in einer kontrollierten Umgebung getestet wurde, wurde PORT für diesen Zweck weit verbreitet. In einer Analyse des Versagens der chirurgischen Behandlung am Memorial Sloan-Kettering Cancer Center wiesen Patienten, die zwischen 1960 und 1970 allein operiert wurden, Versagensraten von 39 bzw. 73% bei Patienten mit negativem bzw. positivem chirurgischen Rand auf. Diese wurden mit denen verglichen, die von 1975 bis 1980 PORT (mit oder ohne Chemotherapie) erhielten. Die letztere Gruppe hatte niedrigere Ausfallraten von 2% bzw. 11%. Darüber hinaus verglich eine randomisierte Studie aus den 1970er Jahren (RTOG 73-03) die präoperative Bestrahlung mit der PORT und fand bei letzterer geringere Versagensraten.
Die Hinzufügung einer weiteren Behandlungsmodalität wird als adjuvante (wörtlich helfende) Therapie bezeichnet, im Vergleich zu ihrer Anwendung als initiale (primäre) Therapie, auch als Radikaltherapie bezeichnet. Folglich wurden viele dieser Patienten mit adjuvanter Bestrahlung mit oder ohne Chemotherapie behandelt. In der obigen Serie von Berichten über minimal-invasive Chirurgie erhielten viele (30–80 %) Patienten eine adjuvante Bestrahlung. Die funktionellen Ergebnisse waren jedoch schlechter, wenn die Operation zusätzlich bestrahlt wurde, und am schlechtesten, wenn sowohl Bestrahlung als auch Chemotherapie verwendet wurden. Die Strahlendosis folgte in dieser Situation weitgehend der für alle Kopf-Hals-Karzinome abgeleiteten Dosis, basierend auf dem Risiko. In der Vergangenheit hat sich nur eine randomisierte klinische Studie mit der optimalen Dosierung befasst, Patienten wurden zwei Dosierungsstufen zugeordnet, stratifiziert nach Risiko, zeigte jedoch keinen Unterschied in der Krebskontrolle zwischen den niedrigen und hohen Dosen (63 und 68,4 Gy), aber eine höhere Inzidenz von Komplikationen bei der höhere Dosen. Folglich wurde die niedrigere Dosis von 57,6 Gy empfohlen. Da die Autoren ein Fraktionierungsschema von 1,8 Gy pro Behandlung verwendeten, wurde diese Dosierung nicht weit verbreitet Behandlungen). 57,6 Gy in 1,8 Gy-Fraktionen entsprechen jedoch (isoeffektive Dosis) nur 56 Gy in 2 Gy-Fraktionen. 60 Gy entsprechen den 63 Gy, die als niedrige Dosis in der Hochrisikogruppe verwendet wurden. 60 Gy war auch die Dosis, die in RTOG 73-03 verwendet wurde. In der Folge wurde die Behandlung von Kopf-Hals-Tumoren tendenziell intensiviert, und einige Zentren nahmen eine Dosis von 66 Gy an, zumindest für Patienten mit unerwünschten Tumormerkmalen. Die Wirksamkeit von PORT bei HPV+OPC wird durch eine Kohortenstudie (Stufe 2b) unterstützt, obwohl die Zahl der Patienten gering war und die Zahl der Ereignisse (rezidivierende Erkrankung oder Tod) nur 7 % betrug. Eine weitere retrospektive Studie auf Populationsebene (Level 4) der SEER- Datenbank (1998–2011) kam zu dem Schluss, dass es bei 410 Patienten mit einem einzelnen Lymphknotenbefall ein Gesamtüberleben, aber keinen krankheitsspezifischen Überlebenseffekt der Bestrahlung gab, jedoch nur univariate statistische verwendet Analyse und enthielt keine Informationen zum HPV-Status. Eine nachfolgende viel größere Studie an einer ähnlichen Population in der National Cancer Database (2004–2013) mit über 9.000 Patienten fand einen Überlebensvorteil, jedoch nur bei HPV-OPC, nicht bei 410 HPV+OPC-Patienten, und eine anschließende Studie mit 2.500 HPV+OPC-Patienten mit niedrigem und mittlerem Risiko zeigten ein ähnliches Gesamtüberleben, unabhängig davon, ob PORT gegeben wurde oder nicht.
Deintensivierung
Obwohl weniger Studien zur Deinensibilisierung (Deeskalation) in diesem Umfeld abgeschlossen wurden als zur primären Radikalbestrahlung für diesen Krebs (siehe unten), ist dies ein Bereich, in dem aktive Untersuchungen durchgeführt werden. In einer einzigen institutionellen Studie wurde entschieden, die Strahlendosis bei Hochrisikopatienten mit HPV+OPC von 66 auf 60 Gy zu reduzieren, entsprechend der tatsächlichen Evidenz, und die Nachbeobachtung hat keine Verringerung der Krebskontrolle gezeigt. Aktuelle Studien sowohl in Nordamerika als auch in Europa (wie ECOG 3311 und PATHOS) verwenden 50 Gy als Vergleichsarm. Der Komparator von 50 Gy wurde aufgrund (i) der hervorragenden Empfindlichkeit von HPV+OPC gegenüber Strahlung sowohl in vitro als auch in vivo ausgewählt ; ECOG 1308 zeigt eine ausgezeichnete Krankheitskontrolle bei 54 Gy; und Daten, die nahelegen, dass 50 Gy in 1,43 Gy (isoeffektive Dosis 43 Gy in 2,0 Gy) ausreichten, um den Hals elektiv zu behandeln. Andere Studien wie MC1273 und DART-HPV haben Dosen von nur 30–36 Gy bewertet. Die Senkung der Strahlendosis auf 54 Gy wurde von der American Society of Clinical Oncology unter dem Leitthema "Weniger ist mehr: Erhaltung der Lebensqualität mit weniger Behandlung" als einer der wichtigsten klinischen Krebsfortschritte des Jahres 2018 identifiziert . Chemotherapie wurde in dieser Situation gleichzeitig mit Bestrahlung eingesetzt, ebenso wie bei der primären Behandlung mit radikaler Bestrahlung, insbesondere wenn pathologische Merkmale ein höheres Risiko für ein Wiederauftreten von Krebs anzeigten. Eine Reihe von Studien hat gezeigt, dass dies die lokale Kontrolle nicht verbessert, obwohl die Toxizität erhöht wird.
Strahlentherapie
Bedenken hinsichtlich der mit der traditionellen offenen chirurgischen En-bloc-Resektion verbundenen Morbidität führten zur Erforschung alternativer Ansätze mit Bestrahlung. Die intensitätsmodulierte Strahlentherapie ( IMRT ) kann eine gute Kontrolle von Primärtumoren bieten und gleichzeitig hervorragende Kontrollraten bei geringerer Toxizität für Speichel- und Rachenstrukturen im Vergleich zu früheren Technologien beibehalten. HPV+OPC hat im Vergleich zu HPV-OPC eine erhöhte Strahlenempfindlichkeit mit schnellerer Regression gezeigt. Im Allgemeinen kann die Bestrahlung der betroffenen Seite allein (ipsilateral) sicher erfolgen, da die Rezidivrate auf der gegenüberliegenden Seite (kontralateral) gering ist und die Toxizität im Vergleich zur bilateralen Behandlung deutlich geringer ist. IMRT hat ein zweijähriges krankheitsfreies Überleben zwischen 82 und 90 % und ein zweijähriges krankheitsspezifisches Überleben von bis zu 97 % für die Stadien I und II.
Gemeldete Toxizitäten umfassen Mundtrockenheit ( Xerostomie ) aufgrund von Speicheldrüsenschäden , 18% (Grad 2); Schluckbeschwerden ( Dysphagie ) aufgrund einer Schädigung der Konstrictormuskulatur, des Kehlkopfes und des Ösophagussphinkters, 15 % (Grad 2); subklinische Aspiration bis zu 50% (gemeldete Inzidenz von Aspirationspneumonie ca. 14%); Hypothyreose 28-38% auf drei Jahren (bis zu 55% sein , je nach Menge der Schilddrüse auf über 45 ausgesetzt Gland Gy Strahlung; Ösophagusstenose 5%; Osteonekrose des Unterkiefers 2,5% und Bedarf für ein Gastrostomie Rohr platziert wird zu einem bestimmten Zeitpunkt während oder bis zu einem Jahr nach der Behandlung 4 % (bis zu 16 % bei längerer Nachbeobachtung) Es wurden Bedenken hinsichtlich übermäßiger kurz- und langfristiger Toxizität, insbesondere Dysphagie und Xerostomie, geäußert, und daher, ob Standarddosen Patienten exponieren mit besseren Prognosen sind Übertherapie und unnötigen Nebenwirkungen ausgesetzt.
Dosimetrie
Die Wahrscheinlichkeit einer Xerostomie nach einem Jahr steigt um 5 % für jede Dosiserhöhung der Ohrspeicheldrüse um 1 Gy . Dosen über 25–30 Gy sind mit mittelschwerer bis schwerer Xerostomie verbunden. Ähnliche Überlegungen gelten sowohl Submandibularis , aber Xerostomie ist weniger häufig , wenn nur eine Drüse parotid in dem abgestrahlten Feld enthalten ist und der kontralateralen Submandibularis wird geschont (weniger als 39 Gy) In der gleichen Weise, Strahlendosis für die Schlund Konstriktor Muskeln , Kehlkopf und krikopharyngealer Einlass bestimmen das Risiko einer Dysphagie (und damit die Abhängigkeit von Gastrostomiesondenernährung ). Der Schwellenwert für diese Toxizität ist volumenabhängig bei 55–60 Gy, mit mäßiger bis schwerer Beeinträchtigung des Schluckens, einschließlich Aspiration, Striktur und Ernährungssondenabhängigkeit über einer mittleren Dosis von 47 Gy, mit einer empfohlenen Dosis von weniger als 41 Gy. Die Dosis-Toxizitäts-Beziehungen für die oberen und mittleren Konstriktoren sind steil, mit einer um 20 % erhöhten Wahrscheinlichkeit einer Dysphagie pro 10 Gy. Für späte Dysphagie betrug die Schwelle der mittleren Gesamtkonstriktordosen, um Raten von größer oder gleich Grad 2 und 3 unter 5 % zu begrenzen, 58 bzw. 61 Gy. Bei Dysphagie Grad 2 stieg die Rate um 3,4% pro Gy. Dosen über 30 Gy an der Schilddrüse sind mit einer mittelschweren bis schweren Hypothyreose verbunden. Subjektive, von Patienten berichtete Ergebnisse der Lebensqualität korrelieren auch mit der erhaltenen Strahlendosis.
Veränderte Fraktionierungsschemata wie RTOG 9003 und RTOG 0129 haben keinen zusätzlichen Nutzen gebracht. Die Strahlendosisempfehlungen wurden größtenteils empirisch in klinischen Studien mit wenigen HPV+OPC-Patienten ermittelt und sind seit einem halben Jahrhundert unverändert geblieben, was die Bestimmung der optimalen Dosis für diese Untergruppe erschwert. Ein üblicher Ansatz verwendet 70 Gy bilateral und anterior, wie RTOG 9003 (1991–1997) und RTOG 0129 (2002–2005). Bei lateralisiertem Tonsillenkarzinom wird normalerweise eine einseitige Bestrahlung des Halses verschrieben, aber bei Primären des Zungengrundes ist eine bilaterale Bestrahlung des Halses häufiger, aber bei lateralisierten Läsionen des Zungengrundes kann eine einseitige Bestrahlung verwendet werden.
Deintensivierung
Es wurden Bedenken hinsichtlich einer übermäßigen Kurz- und Langzeittoxizität, insbesondere Dysphagie und Xerostomie, geäußert und daher, ob Standarddosen Patienten mit besserer Prognose einer Überbehandlung und unnötigen Nebenwirkungen aussetzen. Aktuelle Toxizitäten wurden als "nicht tolerierbar" beschrieben und daher ein starkes Interesse an einer Deeskalation.
Während der Vergleich mit historischen Kontrollen im Vergleich zu randomisierten klinischen Studien ( Phase III ) nur begrenzt aussagekräftig ist , wurden Phase-II- Studien mit reduzierten Strahlendosen im Vergleich zum historischen Standard von 70 Gy durchgeführt. Eine Studie mit 54–60 Gy (eine 15–20%ige Reduktion, stratifiziert nach Ansprechen auf die initiale Induktionschemotherapie) zeigte ein vergleichbares Niveau der Krankheitskontrolle mit viel geringeren Komplikationsraten im Vergleich zu ähnlichen Studien mit 70 Gy, wie ECOG 2399. Der Prozentsatz der Patienten, die nach 2 Jahren noch am Leben waren, betrug 95 % bei der höheren Dosis und 98 % bei der niedrigeren Dosis. Ähnliches gilt für den krankheitsfreien Prozentsatz (86 und 92 %). Die Toxizitäten wurden von einer Inzidenz von Dysphagie und Mukositis Grad 3 oder höher von 54 bzw. 53 % auf 9 % stark reduziert. Eine geringere Inzidenz und Schwere der Dysphagie bedeutet auch, dass weniger Patienten eine Gastrostomie-Ernährung benötigen. Ein ähnlicher Vergleich lässt sich mit den gepoolten Daten aus zwei RTOG-Studien mit 70 Gy (0129 und 0522) anstellen.
Außerhalb klinischer Studien wurden noch keine neuen Leitlinien speziell für HPV+OPC entwickelt. Indirekte Daten deuten auf die Wirksamkeit einer weniger intensiven Behandlung hin. Eine retrospektive Analyse von fortgeschrittenem (N+) HPV+OPC ergab eine lokale Kontrolle von 96 % über 5 Jahre mit de-intensivierter Bestrahlung von 54 Gy und gleichzeitiger Cisplatin- basierter Chemotherapie. Die Schlussfolgerungen des oben genannten Paares ähnlicher Phase-II-Studien wurden durch mehrere andere Phase-II-Studien gestützt. Eine prospektive Studie ( ECOG 1308) zeigte eine ähnliche lokoregionäre Kontrolle mit 54 Gy und eine weitere Studie eine hohe pathologische komplette Ansprechrate bei 60 Gy. Die Quarterback-Studie zeigte vergleichbare Ergebnisse zwischen 56 und 70 Gy. gefolgt von Quarterback 2 mit einem Vergleich von 50 bis 56 Gy. Ebenso zeigte die Optima-Studie eine gute Krankheitskontrolle mit Dosen zwischen 45 und 50 Gy. Laufende Studien, die den Erfahrungen der Mayo Clinic- Studie (MC1273) folgen, wie beispielsweise das Memorial Sloan Kettering Cancer Center, untersuchen Dosen von nur 30 Gy. Diese Studien verwendeten alle deutlich unter der vorherigen Standarddosis von 70 Gy. Da die Langzeittoxizität mit der Strahlendosis verbunden ist, hat die Bestimmung der Wirksamkeit niedrigerer und damit weniger morbider Strahlendosen Priorität, da bei vielen HPV+-Patienten ein Langzeitüberleben erwartet werden kann.
Bestrahlung wird häufig in Kombination mit Chemotherapie eingesetzt, kann aber auch als einzelne Modalität verwendet werden, insbesondere in früheren Stadien, z. B. T1-T2, N0-1, und ihr Einsatz in späteren Stadien wird in klinischen Studien wie RTOG 1333 untersucht vergleicht Bestrahlung allein mit Bestrahlung mit reduzierter Chemotherapie bei Nichtrauchern oder leichten Rauchern.
Chemotherapie
Wie bei den Strahlentherapiedaten stammen die meisten verfügbaren Erkenntnisse zur Wirksamkeit der Chemotherapie eher aus der Behandlung von fortgeschrittenem Kopf-Hals-Karzinom als aus spezifischen Studien zu HPV+OPC. Seit 1976 haben viele klinische Studien die CRT mit der alleinigen RT bei der primären Behandlung von lokal fortgeschrittenen Kopf-Hals-Karzinomen verglichen und einen Vorteil der CRT sowohl beim Überleben als auch bei der lokoregionären Kontrolle gezeigt. Cisplatin gilt als Standardwirkstoff, und ein Überlebensvorteil wurde bei den Patienten festgestellt, die gleichzeitig mit Cisplatin bestrahlt wurden. Trotzdem wurden in diesem Zusammenhang keine Studien durchgeführt, in denen Cisplatin direkt mit anderen Wirkstoffen verglichen wurde. Der andere weit verbreitete Wirkstoff ist Cetuximab , ein monoklonaler Antikörper, der gegen den epidermalen Wachstumsfaktorrezeptor (EGFR) gerichtet ist. Ein Überlebensvorteil von 10 % nach drei Jahren wurde festgestellt, wenn Cetuximab gleichzeitig mit einer Bestrahlung (Biostrahlung) verabreicht wurde. Cetuximab-Studien wurden vor Kenntnis des HPV-Status abgeschlossen. Labor- und klinische Studien zum Nutzen von Cetuximab in diesem Zusammenhang sind widersprüchlich. Die Haupttoxizität ist ein akneiformer Hautausschlag, der jedoch nicht direkt mit Cisplatin bei HPV+OPC verglichen wurde, bis RTOG 1016 ( siehe Talk ) diese Frage beantwortete. Die Analyse der Ergebnisse drei Jahre nach Abschluss der Studie zeigt, dass Cetuximab Cisplatin unterlegen ist. Die gleichzeitige Chemotherapie ist auch der alleinigen Chemotherapie ( Induktionschemotherapie ) mit anschließender Bestrahlung überlegen . Cetuximab zeigt keinen Vorteil, wenn es zu Cisplatin in Kombination mit Bestrahlung gegeben wird. Obwohl die Radiochemotherapie basierend auf klinischen Studien und insbesondere Metaanalysen zu einem Behandlungsstandard wurde , zeigte eine anschließende populationsbasierte Studie von Patienten mit OPC keinen Vorteil der zusätzlichen Chemotherapie zur Bestrahlung bei HPV+OPC oder HPV-OPC und war signifikant Bedenken hinsichtlich zusätzlicher Toxizität.
Auch im postoperativen Setting (adjuvante Therapie) spielt die Chemotherapie in Kombination mit der Bestrahlung eine Rolle. Im Allgemeinen wird es verwendet, wenn die Pathologie der resezierten Probe auf Merkmale hinweist, die mit einem hohen Risiko eines lokoregionalen Rezidivs verbunden sind (z. B. extrakapsuläre Ausdehnung durch befallene Lymphknoten oder sehr enge Ränder). Es hat in zwei sehr ähnlichen klinischen Studien bei solchen Hochrisikopatienten, EORTC 22931 (1994–2000) und RTOG 9501 (1995–2000) , ein verbessertes krankheitsfreies Überleben und eine verbesserte lokoregionale Kontrolle gezeigt . Bei HPV+OPC-Patienten scheint eine solche extrakapsuläre Ausbreitung jedoch kein nachteiliger Faktor zu sein, und die zusätzliche Chemotherapie zur Bestrahlung brachte in dieser Gruppe keinen weiteren Vorteil. Da die Stichprobengröße zum Nachweis eines Überlebensvorteils groß ist, waren diese Studien angesichts der geringen Anzahl von Ereignissen in dieser Gruppe möglicherweise unterbewertet, und die Frage des Nutzens einer zusätzlichen Chemotherapie wird in einer randomisierten klinischen Studie (ADEPT) mit zwei Jahr lokoregionäre Kontrolle und krankheitsfreies Überleben als Endpunkt. Die Zugabe einer Chemotherapie zur Bestrahlung erhöht die akute und späte Toxizität. In der GORTEC-Studie führte die Chemotherapie mit Docetaxel zu einer verbesserten Überlebensrate und lokoregionalen Kontrolle bei lokal fortgeschrittenem OPC, war jedoch mit einer erhöhten Mukositis und der Notwendigkeit einer Nahrungsaufnahme durch Gastrostomie verbunden. Chemotherapie und Bestrahlung sind dabei mit einem Sterberisiko von 3–4 % verbunden. Es ist unklar, ob die zusätzliche Toxizität der Chemotherapie zur Bestrahlung durch einen signifikanten klinischen Nutzen bei der Krankheitskontrolle und dem Überleben ausgeglichen wird.
Es wird angenommen, dass HPV+OPC-Patienten von einer Strahlentherapie und gleichzeitiger Behandlung mit Cetuximab besser profitieren als HPV-OPC-Patienten, die dieselbe Behandlung erhalten, und dass Bestrahlung und Cisplatin eine Immunantwort gegen einen antigenen Tumor induzieren , die ihre Wirkung auf die Krebszellen verstärkt. Obwohl die Inzidenz von HPV-Positivität gering ist (10–20%), wurde in Studien mit Cetuximab und Panitumumab , einem ähnlichen Anti-EGFR-Wirkstoff , ein Vorteil für HPV+OPC beobachtet , jedoch keine konsistente Wechselwirkung mit der Behandlung, obwohl HPV+OPC scheint nicht in gleichem Maße zu profitieren wie HPV-OPC gegenüber der Zweitlinien-Anti-EGFR-Therapie, möglicherweise aufgrund der geringeren EGFR-Expression bei HPV+OPC.
Wahl des Behandlungsansatzes
In Ermangelung hochwertiger Evidenz, die einen primären chirurgischen Ansatz mit anderen Modalitäten vergleicht, basieren die Entscheidungen auf der Berücksichtigung von Faktoren wie einer angemessenen chirurgischen Exposition und anatomisch günstigen Merkmalen für eine angemessene Resektion, Nachbehandlungsfunktion und Lebensqualität . Eine solche Patientenauswahl kann es ihnen ermöglichen, die Morbidität einer zusätzlichen adjuvanten Behandlung zu vermeiden. In Ermangelung günstiger chirurgischer Merkmale bleibt die Bestrahlung mit oder ohne Chemotherapie die primäre Therapie der Wahl. Tumormerkmale, die einen nicht-chirurgischen Zugang begünstigen, umfassen eine Invasion des Zungengrundes, die eine Resektion von 50 % oder mehr der Zunge erfordert , Beteiligung des Pterygoidmuskels, Ausdehnung in das parapharyngeale Fett, das an die Halsschlagader angrenzt , Beteiligung des Unterkiefers oder Maxilla oder Invasion des prävertebralen Raums .
Die Angemessenheit der chirurgischen Resektion ist ein wichtiger Faktor bei der Bestimmung der Rolle der postoperativen adjuvanten Therapie. Bei Vorliegen einer positiven Marge bei der pathologischen Untersuchung empfehlen die meisten Radioonkologen eine Bestrahlung der primären Lokalisation und eine gleichzeitige Chemotherapie. Eine negative Marge wird eher mit niedrigeren Dosen und einem kleineren Behandlungsvolumen behandelt. Auch die Entfernung eines voluminösen Tumors kann eine reduzierte Dosis für benachbarte unbeteiligte Rachenstrukturen und somit eine geringere Wirkung auf das normale Schlucken ermöglichen .
Die Krebsergebnisse (lokale Kontrolle, regionale Kontrolle und Überleben) für die transorale Resektion gefolgt von einer adjuvanten Therapie sind vergleichbar mit der primären Radiochemotherapie, so dass die Behandlungsentscheidungen stärker von der behandlungsbedingten Morbidität, dem funktionellen Ergebnis und der Lebensqualität abhängen. Patientenfaktoren müssen ebenfalls berücksichtigt werden, darunter allgemeine Ausgangsfunktion, Raucheranamnese, Anästhesierisiko, oropharyngeale Funktion, Schluck- und Atemwegsschutz sowie Rehabilitationspotenzial. Ebenso wichtig ist die Patientenpräferenz. Viele klinische Studien sind im Gange , auf deintensification Fokussierung, oft mit Risiko Schichtung , zB niedrige, mittlere und hohe Risiko ( siehe Fundakowski und Lango, Tabelle I ).
Klinische Entscheidungen berücksichtigen auch Morbiditäten, insbesondere wenn die Krebsergebnisse vergleichbar sind, beispielsweise ist eine Operation mit einem Blutungsrisiko zwischen 5–10% und einem 0,3%-Risiko für tödliche postoperative Blutungen verbunden. Die Operation kann auch durch Dysphagie kompliziert werden , und während die meisten Patienten eine Diät am ersten postoperativen Tag tolerieren können, wurde über eine Langzeitanwendung einer Ernährungssonde von bis zu 10 % berichtet. Patienten mit größeren Tumoren, Zungengrundbeteiligung und postoperativer adjuvanter Therapie benötigen eher eine langfristige Ernährungssonde. Insgesamt scheinen Funktion und Lebensqualität zwischen einer Operation mit postoperativer Bestrahlung und einer primären Chemoradiation relativ ähnlich zu sein, aber HPV+OPC-Patienten haben zum Zeitpunkt der Diagnose tendenziell eine bessere Lebensqualität als HPV-OPC, können aber nach der Behandlung größere Verluste erleiden.
Anatomische Überlegungen können auch die Präferenz für chirurgische oder nicht-chirurgische Ansätze diktieren. Zum Beispiel wären Trismus , eine sperrige Zunge, eine begrenzte Verlängerung des Halses, vorstehende Zähne, ein Torus mandibularis (ein knöchernes Wachstum am Unterkiefer) oder eine begrenzte Breite des Unterkiefers alle relative Kontraindikationen für eine Operation. Tumorbezogene Überlegungen umfassen eine Invasion des Unterkiefers, der Schädelbasis und eine ausgedehnte Beteiligung des Kehlkopfes oder von mehr als der Hälfte des Zungengrundes. Zu den technischen Überlegungen beim Anbieten einer Operation als primäre Modalität gehören die mutmaßliche Fähigkeit, angemessene Ränder in der resezierten Probe zu erzielen, und das Ausmaß des resultierenden Defekts, da enge oder positive Ränder wahrscheinlich zu einer anschließenden adjuvanten Therapie führen, um die Krankheitskontrolle zu erreichen, mit der daraus resultierenden erhöhten Morbidität . Die Kosten sind schwer abzuschätzen, aber eine US-Studie, basierend auf Schätzungen von 25 % aller OPC-Patienten, die nur eine Operation erhielten, und 75 % einer Operation gefolgt von einer adjuvanten Therapie, ergab unter Verwendung der Kriterien des NCCN , dass dieser Ansatz weniger kostspielig war als eine primäre Radiochemotherapie.
Die Erkrankung im Frühstadium ist mit einem relativ günstigen Ausgang verbunden, für den eine Therapie mit einer einzigen Modalität empfohlen wird, wobei die Wahl von der Tumorlokalisation und der Zugänglichkeit abhängt. Beispielsweise werden einseitige Tonsillen- oder Zungengrundtumore im Allgemeinen mit einer transoralen Resektion und einer selektiven ipsilateralen Neck Dissection behandelt. Auf der anderen Seite würde eine große Zungenläsion in der Mittellinie eine bilaterale Halsdissektion erfordern, aber in Ermangelung einer als nachteilig angesehenen Pathologie (positive Ränder, extrakapsuläre Ausdehnung) wird sie wahrscheinlich nur durch eine Operation oder Bestrahlung einschließlich ipsilateraler oder bilateraler Bestrahlungsfelder des Halses behandelt. mit einer Operation für die Fälle, in denen die Wahrscheinlichkeit einer adjuvanten Therapie gering ist.
Viele HPV+OPC präsentieren sich jedoch mit Beteiligung der Lymphknoten im Nacken und damit in einem höheren Krankheitsstadium, das im Allgemeinen als lokal fortgeschrittene Erkrankung bezeichnet wird. Diese Gruppe wird hauptsächlich mit multimodaler Therapie behandelt, mit Ausnahme einer der günstigeren Untergruppen mit kleinen Primärtumoren und Lymphknotenbefall, die auf einen einzigen Knoten mit einer Größe von nicht mehr als 3 cm beschränkt sind und wie erwähnt als Frühstadium der Erkrankung gelten. Die drei Hauptoptionen für lokal fortgeschrittene, aber operable Erkrankungen sind Resektion, Neck Dissection und adjuvante Therapie; Radiochemotherapie (mit möglicher Rettungsoperation ); Induktionschemotherapie gefolgt von Bestrahlung oder Radiochemotherapie. Die letzte Option wurde jedoch in klinischen Studien, in denen sie getestet wurde, nicht unterstützt. Die primäre Überlegung bei der Operation bei lokal fortgeschrittener Erkrankung besteht darin, angemessene negative Ränder zu erhalten und dem Patienten eine postoperative Radiochemotherapie zu ersparen. Dies muss jedoch gegen die Morbidität und den Funktionsverlust durch ausgedehnte Resektion, insbesondere bei Beteiligung des Zungengrundes, abgewogen werden. Um eine solche Morbidität zu vermeiden, wird eine primäre Radiochemotherapie bevorzugt. Die Behandlung von Erkrankungen innerhalb der zervikalen Lymphknoten muss bei der Behandlung lokal fortgeschrittener Erkrankungen berücksichtigt werden. Richtlinien für alle OPC schreiben vor, dass eine postoperative Radiochemotherapie der ektrakapsulären Extension verabreicht wird. Wenn eine schwere Halserkrankung offensichtlich ist, wird zunächst in der Regel eine primäre Radiochemotherapie verabreicht.
Patientenpräferenzen
Aktuelle Leitlinien basieren auf Daten für OPC insgesamt, so dass Patienten grundsätzlich unabhängig vom HPV-Status behandelt werden, dennoch erwägen viele Kliniker und Forscher eine Deinensibilisierung. Es ist wahrscheinlich, dass sich die Behandlung dieser Erkrankung in Richtung Deinentensivierung weiterentwickeln wird, um den Funktionsverlust zu minimieren, aber die Krankheitskontrolle aufrechtzuerhalten. In Ermangelung spezifischer klinischer Studien und Leitlinien müssen die Patientenpräferenzen berücksichtigt werden, um die kurz- und langfristige Toxizität und den Funktionsverlust zu minimieren und die Lebensqualität angesichts der häufig beobachteten Verlängerung des Überlebens zu optimieren. Dies kann das Erkunden der Werte der Patienten hinsichtlich des Kompromisses der Krankheitskontrolle gegenüber den Nebenwirkungen der Behandlung beinhalten. Patienten, die CRT als primäre Behandlung für OPC erhalten haben, legen großen Wert auf das Überleben, und obwohl sie der Aussage zustimmen, dass eine Deinensibilisierung wünschenswert ist, zögerten sie, einen großen Überlebensvorteil gegen eine geringere Toxizität einzutauschen, obwohl sie eher auf eine Chemotherapie verzichten würden, als eine reduzierte Bestrahlung zu akzeptieren.
Karzinom unbekannter primärer
In einigen Situationen kann HPV+OPC mit zervikalen Lymphknoten, aber ohne erkennbare Erkrankung eines Primärtumors (T0 N1-3) auftreten und wird daher als Plattenepithelkarzinom unbekannter primärer Herkunft klassifiziert . Das tritt bei 2-4% der Patienten mit metastasierendem Krebs in den Halsknoten auf. Die Inzidenz von HPV-Positivität nimmt ähnlich schnell zu wie bei OPC. In solchen Situationen kann die Resektion der Zungen- und Gaumenmandeln zusammen mit einer Neck dissection diagnostisch sein und eine ausreichende Intervention darstellen, da die Rezidivraten gering sind.
Prognose
Das Vorhandensein von HPV im Tumor wurde seit den 1990er Jahren als wichtiger Faktor für die Vorhersage des Überlebens erkannt.
Vergleich mit HPV-negativem Oropharynxkarzinom
Der HPV-Status des Tumors ist unabhängig von der gewählten Behandlungsmethode und sogar nach Anpassung an das Stadium stark mit einem positiven therapeutischen Ansprechen und Überleben im Vergleich zu HPV-negativem Krebs verbunden. Obwohl HPV+OPC-Patienten im Vergleich zu HPV-OPC-Patienten eine Reihe günstiger demografischer Merkmale aufweisen, machen diese Unterschiede nur etwa zehn Prozent der Überlebensdifferenz zwischen den beiden Gruppen aus. Ansprechraten von über 80 % werden bei HPV+-Krebs berichtet, und das progressionsfreie Drei-Jahres-Überleben wurde mit 75–82 % bzw. 45–57 % für HPV+- und HPV-Krebs berichtet und verbessert sich mit zunehmender Zeit. Es ist wahrscheinlich, dass HPV+OPC von Natur aus weniger bösartig ist als HPV-OPC, da Patienten, die allein durch eine Operation behandelt werden, nach Anpassung an das Stadium ein besseres Überleben haben.
Determinanten des Überlebens
In der klinischen RTOG- Studie 0129, in der alle Patienten mit fortgeschrittener Erkrankung eine Strahlen- und Chemotherapie erhielten, identifizierte eine retrospektive Analyse ( rekursive Partitionierungsanalyse oder RPA) nach drei Jahren drei Risikogruppen für das Überleben (niedrig, mittel und hoch) basierend auf HPV Status, Rauchen, T-Stadium und N-Stadium ( siehe Ang et al., Abb. 2). Der HPV-Status war die wichtigste Determinante für das Überleben, gefolgt von der Raucheranamnese und dem Stadium. 64 % waren HPV+ und alle gehörten zur Gruppe mit niedrigem und mittlerem Risiko, wobei alle nicht rauchenden HPV+-Patienten zur Gruppe mit niedrigem Risiko gehörten. 82 % der HPV+-Patienten waren nach drei Jahren noch am Leben, verglichen mit 57 % der HPV-Patienten, was eine 58-prozentige Verringerung des Sterberisikos bedeutet. Auch das lokoregionäre Versagen ist bei HPV+ geringer und beträgt 14 % im Vergleich zu 35 % bei HPV-.
Determinanten des Krankheitsverlaufs
HPV-Positivität führt zu einem 50–60% geringeren Risiko für Krankheitsprogression und Tod, aber der Konsum von Tabak ist ein unabhängiger negativer Prognosefaktor. Eine gepoolte Analyse von HPV+OPC- und HPV-OPC-Patienten mit Krankheitsprogression in den RTOG-Studien 0129 und 0522 zeigte, dass, obwohl bei weniger HPV+OPC eine Krankheitsprogression auftrat (23 vs. 40 %), die mediane Zeit bis zur Krankheitsprogression nach der Behandlung ähnlich war ( 8 Monate). Die Mehrheit (65 %) der Rezidive trat in beiden Gruppen innerhalb des ersten Jahres nach der Behandlung auf und war lokoregionär. Obwohl die Versagensrate im gegenüberliegenden Hals nach Behandlung nur einer Seite 2,4% beträgt, beträgt die Rate eines isolierten Rezidivs im gegenüberliegenden Hals 1,7%, und zwar hauptsächlich dort, wo der Primärtumor die Mittellinie betraf. Allerdings ist die Versagensrate im kontralateralen Hals auch bei HPV+ höher. Von denen, die an dieser Stelle wiederkehren, wurden fast alle erfolgreich behandelt (gerettet) durch weitere lokale Behandlung am gegenüberliegenden Hals.
Determinanten der Metastasierungsrate
HPV+ reduzierte nicht die Metastasierungsrate (bei etwa 45 % der Patienten mit Progression), die überwiegend in die Lunge gelangt (70 %), obwohl einige Studien von einer niedrigeren Rate berichtet haben. mit 3-Jahres-Fernrezidivraten von etwa 10 % bei Patienten, die mit Primärbestrahlung oder Chemoradiotherapie behandelt wurden. Auch wenn ein Rezidiv oder Metastasen auftreten, bietet die HPV-Positivität immer noch einen Vorteil. Im Gegensatz dazu ist der Tabakkonsum ein unabhängiger negativer prognostischer Faktor mit vermindertem Ansprechen auf die Therapie, erhöhten Krankheitsrezidivraten und verringertem Überleben. Die negativen Auswirkungen des Rauchens nehmen mit der gerauchten Menge zu, insbesondere wenn sie länger als 10 Packungsjahre sind .
Vorhersagen des Überlebens
Nach Radiochemotherapie
Für Patienten, die mit RTOG 0129 mit primärer Radiochemotherapie behandelt wurden, wurden aus diesem Datensatz in Kombination mit RTOG 0522 detaillierte Nomogramme abgeleitet , die eine Vorhersage des Ergebnisses basierend auf einer großen Anzahl von Variablen ermöglichen . Zum Beispiel würde ein 71-jähriger verheirateter, nicht rauchender High-School-Absolvent mit einem Leistungsstatus (PS) von 0, ohne Gewichtsverlust oder Anämie und einem T3N1-HPV+OPC ein progressionsfreies Überleben von 92 % bei 2 . erwarten Jahren und 88% nach 5 Jahren. Ein 60-jähriger, unverheirateter, nicht rauchender Abiturient mit einem PS von 1, Gewichtsverlust und Anämie und einem T4N2-HPV+OPC würde ein Überleben von 70 % nach zwei Jahren und 48 % nach fünf Jahren erwarten.
Nach der Operation
Weniger detaillierte Informationen sind für diejenigen verfügbar, die hauptsächlich chirurgisch behandelt werden, für die weniger Patienten verfügbar sind, sowie niedrige Rezidivraten (7-10%), aber Merkmale, die traditionell bei der Vorhersage der Prognose bei anderen Kopf-Hals-Karzinomen nützlich waren, scheinen in HPV+OPC weniger nützlich zu sein. Diese Patienten werden häufig in drei Risikogruppen stratifiziert:
- Geringes Risiko: Keine nachteiligen pathologischen Merkmale
- Mittleres Risiko: T3–T4 primäre, perineurale oder lymphovaskuläre Invasion, N2 (AJCC 7)
- Hohes Risiko: Positive Margen, ECE
Entwicklung anderer Krebsarten
HPV+OPC-Patienten entwickeln im Vergleich zu anderen Kopf-Hals-Krebspatienten seltener andere Krebsarten. Eine mögliche Erklärung für die günstigen Auswirkungen von HPV+ ist „die geringere Wahrscheinlichkeit des Auftretens einer 11q13-Genamplifikation, die als ein Faktor angesehen wird, der einem schnelleren und häufigeren Wiederauftreten der Krankheit zugrunde liegt“ Vorhandensein von TP53-Mutationen, einem Marker für HPV-OPC, ist mit einer schlechteren Prognose verbunden. Es wird angenommen, dass eine hochgradige p16-Färbung bei der Vorhersage des Strahlentherapieansprechens besser ist als die HPV-PCR-Analyse.
Regionalrezidive nach Operation
Das Rezidivrisiko für ein regionales Karzinom nach einer Neck dissection wird oft aus einer großen Serie von allen Plattenepithelkarzinomen der oberen Aerodigestive abgeschätzt. In dieser Serie waren die Gesamtrisiken nach drei Jahren nach pathologischem Stadium (AJCC 7):
- pN0 4,7 %
- pN1 4,9 %
- pN2 12,1%
Epidemiologie
Im Jahr 2015 war Plattenepithelkarzinom der Kopf-Hals-Region die fünfthäufigste Krebsart neben Hautkrebs weltweit mit einer jährlichen Inzidenz von 600.000 Fällen und etwa 60.000 Fällen jährlich in den Vereinigten Staaten und Europa. Die weltweite Inzidenz von Rachenkrebs im Jahr 2013 wurde auf 136.000 Fälle geschätzt. Für 2008 wird die globale Krankheitslast für OPC im Jahr 2008 auf 85.000 Fälle geschätzt, von denen 22.000 auf HPV zurückzuführen waren, ein Bevölkerungsanteil (PAF) von 26%. Davon waren 17.000 Männer und 4.400 Frauen, 13.000 (60 %) waren zwischen 50 und 69 Jahre alt, und die meisten Fälle (15.000) befanden sich in entwickelten Regionen im Vergleich zu Entwicklungsregionen (6.400). Die altersstandardisierten Inzidenzraten (ASR) unterscheiden sich je nach Region und Land erheblich ( vgl. de Martel et al., 2017 Abb. 2b). ASRs für 2012 waren in Europa (Ungarn 3,0) und Nordamerika (USA 1,7) am höchsten, aber in Afrika (≤ 0,3), Asien (≤ 0,6), Lateinamerika (≤ 0,4) und Ozeanien (≤ 0,2) (außer Australasien , Australien 0,9). Die geschätzten durchschnittlichen Fallzahlen und ASR für die USA im Zeitraum 2008–2012 betrugen 15.738 bzw. 4,5. HPV+OPC war bei Männern viel häufiger als bei Frauen (12.638, 7,6 und 3.100, 1,7). Die Altersgruppe mit der höchsten Inzidenz lag zwischen 60 und 69 Jahren und war bei Kaukasiern höher als bei anderen Rassen.
HPV+OPC-Patienten sind im Allgemeinen jünger als HPV-Patienten. Auch das klinische Erscheinungsbild ändert sich gegenüber dem „typischen“ Kopf-Hals-Krebspatienten mit fortgeschrittenem Alter und starkem Substanzkonsum . Im Gegensatz dazu sind Patienten mit HPV+-Krebs jünger (4.–6. Dekade), männlich (Verhältnis 8:1) ohne oder nur minimal geraucht, in der Regel kaukasisch, haben ein höheres Bildungsniveau erreicht, sind verheiratet und haben ein höheres Einkommen. Die Risikofaktoren für HPV-OPC und HPV+OPC sind tendenziell unabhängig, mit Ausnahme des Rauchens, das sich auf beide negativ auswirkt. Die Präsentationsfunktionen unterscheiden sich auch zwischen HPV+ und HPV-OPC. HPV+-Tumoren haben kleinere primäre Läsionen (weniger als 4 cm), aber eine fortgeschrittenere Lymphknotenerkrankung, die zu einem höheren TNM-Staging führt. Dies wiederum kann die Schwere des Krankheitsstatus überschätzen.
Trends
Vor allem in Nordamerika und Nordeuropa gab es einen weltweiten Trend zur Zunahme der OPC-Inzidenz, aber selbst in Taiwan, das eine sehr hohe Rate für alle Krebsarten im Kopf-Hals-Bereich aufweist, stiegen die OPC-Raten zwischen 1995 und 2009 schneller als jede andere Krebsstelle. Die globale Belastung durch HPV+OPC stieg von 22.000 im Jahr 2008 auf 29.000 im Jahr 2012 und die PAF von 26% auf 31% und gilt als Epidemie . In den Vereinigten Staaten betrug die geschätzte Zahl der Fälle im Jahr 2008 12.410, 13.930 im Jahr 2013 und 17.000 im Jahr 2017. Von diesen Fällen hat HPV+-Krebs im Vergleich zu HPV-Krebs zugenommen, aber der Anstieg von HPV+OPC übersteigt den Rückgang von HPV-. OPC führt zu einer Gesamterhöhung von OPC. Dem Anstieg der Rachenkrebsinzidenz steht ein geringfügiger Rückgang bei anderen Kopf-Hals-Tumoren gegenüber. Infolgedessen hat sich der häufigste Kopf-Hals-Krebs vom Kehlkopf zum Oropharynx verlagert . Eine Umfrage in 23 Ländern zwischen 1983 und 2002 zeigte eine Zunahme von Plattenepithelkarzinomen des Oropharynx, die sich insbesondere bei jungen Männern in wirtschaftlich entwickelten Ländern bemerkbar machte . Im Vereinigten Königreich stieg die Inzidenz von Mund- und Oropharynxkarzinomen bei Männern zwischen 1989 und 2006 um 51 % von 7/100.000 auf 11/100.000. In den USA gibt es eine steigende Inzidenz von HPV-assoziierten Oropharynxkarzinomen für nur 7,5% der Fälle in den USA, aber bis 2016 waren es 70%, möglicherweise aufgrund von verändertem Sexualverhalten, geringerer Popularität von Tonsillektomien, verbesserter radiologischer und pathologischer Bewertung und Änderungen in der Klassifikation. Tonsillen- und Oropharynxkarzinome nahmen zwischen 1975 und 2004 bei männlicher Dominanz zu, trotz des Rückgangs des Rauchens. HPV-OPC sank mit sinkenden Raucherquoten von 1988 bis 2004, während HPV+OPC um fast 7,5% pro Jahr von etwa 16% aller OPC-Fälle in den frühen 1980er Jahren auf fast 70% im Jahr 2004 anstieg mit dem abnehmenden Anteil HPV-negativer Krebsarten verbunden, während sich Veränderungen der sexuellen Aktivität in einem steigenden Anteil HPV-positiver Krebsarten widerspiegeln können. Kürzlich machten HPV-assoziierte OPC in den USA etwa 60 % der OPC-Fälle aus, verglichen mit 40 % in den letzten zehn Jahren. Bis 2007 betrug die Inzidenz von allgemeinem OPC, einschließlich nicht-HPV-assoziierter, in den USA 3,2 Fälle pro 100.000 Männer/Jahr und 1,9 pro 100.000 alle Geschlechter/Jahr. Damit ist HPV+OPC eine von nur fünf Krebsarten, deren Inzidenz in den USA seit 1975 zugenommen hat. Den größten Anstieg der Inzidenz gab es bei Patienten unter 50 Jahren.
Die Zunahme der HPV-assoziierten OPC ist auch in anderen Ländern wie Schweden mit einer Inzidenz von über 80 % für Mandelkrebs im Jahr 2007, Finnland und der Tschechischen Republik zu beobachten . Partner von Patienten mit HPV-positivem Oropharynxkarzinom scheinen im Vergleich zur Allgemeinbevölkerung keine erhöhte orale HPV-Infektion zu haben. In Australien lag die Inzidenz von HPV-assoziierten OPC bei 1,56 Fällen pro 100.000 Männer/Jahr (2001–2005) und stieg von 19% (1987–90) auf 47% (2001–05) bzw. 63,5% (2006–2010). In Kanada stieg der Anteil der HPV-bedingten OPC-Fälle von 47 % im Jahr 2000 auf 74 % im Jahr 2012.
Siehe auch
Anmerkungen
Verweise
Literaturverzeichnis
- "Common Terminology Criteria for Adverse Events (CTCAE) Version 4.0 Veröffentlicht: 28. Mai 2009 (v4.03)" (PDF) . CTCAE . Nationales Krebsinstitut . 14. Juni 2010. Archiviert vom Original (PDF) am 30. August 2017 . Abgerufen am 3. August 2017 .
Artikel
- Fachry, Carole; Gillison, Maura L. (10. Juni 2006). „Klinische Auswirkungen des Humanen Papillomavirus bei Kopf-Hals-Krebs“ . Zeitschrift für klinische Onkologie (Rezension). 24 (17): 2606–2611. doi : 10.1200/JCO.2006.06.1291 . PMC 4696042 . PMID 16763272 .
- Lindberg, Robert (Juni 1972). „Verteilung von zervikalen Lymphknotenmetastasen aus Plattenepithelkarzinomen der oberen Atemwege und des Verdauungstraktes“. Krebs . 29 (6): 1446–1449. doi : 10.1002/1097-0142(197206)29:6<1446::AID-CNCR2820290604>3.0.CO;2-C . PMID 5031238 .
- Mehanna, H.; Jones, TM; Gregor, V.; Ang, KK (24. April 2010). „Oropharyngeales Karzinom im Zusammenhang mit humanem Papillomavirus“. BMJ (Redaktion). 340 (7752): 879–880. doi : 10.1136/bmj.c1439 . JSTOR 40701677 . PMID 20339160 . S2CID 27997605 .
- Nguyen, NP; Chi, A.; Nguyen, LM; Ly, BH; Karlsson, U.; Vinh-Hung, V. (2009). "Humanes Papillomavirus-assoziierter oropharyngealer Krebs: eine neue klinische Entität" . QJM (Rezension). 103 (4): 229–236. doi : 10.1093/qjmed/hcp176 . PMID 20015950 .
- Psyrri, A.; Gouveri, P.; Vermorken, JB (2009). „Humane Papillomavirus-bedingte Kopf-Hals-Tumoren: klinische und Forschungsimplikationen“. Aktuelle Meinung in der Onkologie (Rezension). 21 (3): 201–205. doi : 10.1097/CCO.0b013e328329ab64 . PMID 19370803 . S2CID 35188456 .
- Ramqvist, Torbjörn; Dalianis, Tina (November 2010). "Oropharyngeal Cancer Epidemic and Human Papillomavirus" . Neu auftretende Infektionskrankheiten (Rückblick). 16 (11): 1671-1677. doi : 10.3201/eid1611.100452 . PMC 3294514 . PMID 21029523 .
- Westra, WH (2009). „Das sich verändernde Gesicht von Kopf-Hals-Krebs im 21. Jahrhundert: Der Einfluss von HPV auf die Epidemiologie und Pathologie von Mundkrebs“ . Kopf- und Halspathologie (Rezension). 3 (1): 78–81. doi : 10.1007/s12105-009-0100-y . PMC 2807531 . PMID 20596995 .
Humanes Papillomavirus (HPV) und Molekularbiologie
- Adelstein, DJ; Rodriguez, Cristina P. (3. Februar 2010). „Humanes Papillomavirus: Paradigmenwechsel bei Oropharynxkarzinom“. Aktuelle onkologische Berichte . 12 (2): 115–120. doi : 10.1007/s11912-010-0084-5 . PMID 20425596 . S2CID 11091993 .
- Agoston, E. .; Robinson, S. .; Mehra, K. .; et al. (2010). "Polymerase-Kettenreaktionsnachweis von HPV in Plattenepithelkarzinomen des Oropharynx" . Amerikanisches Journal für Klinische Pathologie . 134 (1): 36–41. doi : 10.1309/AJCP1AAWXE5JJCLZ . PMID 20551264 .
- Ault, KA (2006). "Epidemiologie und Naturgeschichte von Infektionen des menschlichen Papillomavirus im weiblichen Genitaltrakt" . Infektionskrankheiten in der Geburtshilfe und Gynäkologie . 2006 : 1–5. doi : 10.1155/IDOG/2006/40470 . PMC 1581465 . PMID 16967912 .
- Chung, CH; Gillison, ML (27. Oktober 2009). „Humanes Papillomavirus bei Kopf-Hals-Krebs: Seine Rolle bei der Pathogenese und klinischen Implikationen“ . Klinische Krebsforschung . 15 (22): 6758–6762. doi : 10.1158/1078-0432.CCR-09-0784 . PMID 19861444 .
- Cristina Mazon, Renata; Rovigatti Gerbelli, Thais; Benatti Neto, Carlos; et al. (Februar 2011). „Abnormale Zellzyklus-Expression der Proteine p27, mdm2 und Cathepsin B in oralen Plattenepithelkarzinomen, die mit humanem Papillomavirus infiziert sind“. Acta Histochemica . 113 (2): 109–116. doi : 10.1016/j.acthis.2009.08.008 . PMID 19811804 .
- D'Souza, Gypsyamber; Gross, Neil D.; Pai, Sara I.; Haddad, Robert; Anderson, Karen S.; Rajan, Shirani; Gerber, Jennifer; Gilison, Maura L.; Posner, Marshall R. (10. August 2014). "Orale Humane Papillomavirus (HPV)-Infektion bei HPV-positiven Patienten mit Oropharynx-Krebs und ihren Partnern" . Zeitschrift für klinische Onkologie . 32 (23): 2408–2415. doi : 10.1200/JCO.2014.55.1341 . PMC 4263818 . PMID 24778397 .
- Elmofty, S.; Patil, S. (2006). „Humanes Papillomavirus (HPV)-verwandtes oropharyngeales nicht keratinisierendes Plattenepithelkarzinom: Charakterisierung eines bestimmten Phänotyps“. Oralchirurgie, Oralmedizin, Oralpathologie, Oralradiologie und Endodontologie . 101 (3): 339–345. doi : 10.1016/j.tripleo.2005.08.001 . PMID 16504868 .
- Frisch, M.; Biggar, R. (1999). "Ätiologische Parallele zwischen Tonsillen- und anogenitalen Plattenepithelkarzinomen" . The Lancet (Eingereichtes Manuskript). 354 (9188): 1442–1443. doi : 10.1016/S0140-6736(99)92824-6 . PMID 10543674 . S2CID 33391604 .
- Gilison, ML; Koch, WM; Capone, RB; et al. (Mai 2000). „Beweise für einen kausalen Zusammenhang zwischen humanen Papillomaviren und einer Untergruppe von Kopf-Hals-Karzinomen“ . Zeitschrift des Nationalen Krebsinstituts . 92 (9): 709–720. doi : 10.1093/jnci/92.9.709 . ISSN 0027-8874 . PMID 10793107 .
- Guan, X.; Sturgis, E.; Lei, D.; Liu, Z.; Dahlström, K.; Wei, Q.; Li, G. (2010). „Assoziation von TGF-beta1-Genvarianten mit HPV16-positivem Oropharynxkarzinom“ . Klinische Krebsforschung . 16 (5): 1416–1422. doi : 10.1158/1078-0432.CCR-09-2877 . PMC 2831118 . PMID 20179236 .
- Ha, Patrick K; Califano, Joseph A. (Januar 2006). „Promoter Methylierung und Inaktivierung von Tumorsuppressorgenen in oralen Plattenepithelkarzinomen“. Die Lancet-Onkologie . 7 (1): 77–82. doi : 10.1016/S1470-2045(05)70540-4 . PMID 16389187 .
- Haeggblom, Linnea; Ramqvist, Torbjörn; Tommasino, Massimo; Dalianis, Tina; Näsman, Anders (Dezember 2017). "Zeit, die Perspektiven zu HPV bei Oropharynxkarzinom zu ändern. Eine systematische Überprüfung der HPV-Prävalenz pro oropharyngealer Unterstelle in den letzten 3 Jahren" . Papillomavirus-Forschung . 4 : 1–11. doi : 10.1016/j.pvr.2017.05.002 . PMC 5883233 . PMID 29179862 .
- Hong, Angela; Zhang, Xiaoying; Jones, Deanna; Veillard, Anne-Sophie; Zhang, Mei; Martin, Andreas; Lyons, J. Guy; Lee, C. Bald; Rose, Barbara (Februar 2016a). „Beziehungen zwischen p53-Mutation, HPV-Status und Ergebnis bei oropharyngealen Plattenepithelkarzinomen“. Strahlentherapie und Onkologie . 118 (2): 342–349. doi : 10.1016/j.radonc.2016.02.009 . PMID 26952933 .
- Howard, Jason D.; Chung, Christine H. (Juli 2012). „Biologie des humanen Papillomavirus-Related Oropharyngeal Cancer“ . Seminare in Radioonkologie . 22 (3): 187–193. doi : 10.1016/j.semradonc.2012.03.002 . PMC 3715056 . PMID 22687942 .
- Jung, A.; Briolat, J.; Millon, R.; De Reyniès, A.; Rickman, D.; Thomas, E.; Abecassis, J.; Clavel, C.; Wasylyk, B. (2009). „Biologische und klinische Relevanz der transkriptionell aktiven humanen Papillomavirus (HPV)-Infektion bei Plattenepithelkarzinomen des Oropharynx“. Internationale Zeitschrift für Krebs . 126 (8): 1882–1894. doi : 10.1002/ijc.24911 . PMID 19795456 . S2CID 3441257 .
- Klussmann, J.; Mooren, J.; Lehnen, M.; et al. (März 2009). „Genetische Signaturen von HPV-bezogenen und nicht verwandten oropharyngealen Karzinomen und ihre prognostischen Auswirkungen“ . Klinische Krebsforschung . 15 (5): 1779–1786. doi : 10.1158/1078-0432.CCR-08-1463 . ISSN 1078-0432 . PMID 19223504 .
- Kreimer, Aimée R.; Bhatia, Rohini K.; Messeguer, Andrea L.; González, Paula; Herrero, Rolando; Giuliano, Anna R. (Januar 2010). "Oral Human Papillomavirus in gesunden Personen: Eine systematische Überprüfung der Literatur" . Sexuell übertragbare Krankheiten . 37 (6): 386–91. doi : 10.1097/OLQ.0b013e3181c94a3b . PMID 20081557 . S2CID 32378293 .
- Lajer, CB; Buchwald, Lebenslauf (2010). „Die Rolle des humanen Papillomavirus bei Kopf-Hals-Krebs“ . APMIS . 118 (6–7): 510–519. doi : 10.1111/j.1600-0463.2010.02624.x . PMID 20553531 . S2CID 7199240 .
- Lassen, P. (2010). „Die Rolle des Humanen Papillomavirus bei Kopf-Hals-Krebs und die Auswirkungen auf das Ergebnis der Strahlentherapie“. Strahlentherapie und Onkologie . 95 (3): 371–380. doi : 10.1016/j.radonc.2010.04.022 . PMID 20493569 .
- Lawrence MS, Sougnez C, Lichtenstein L, et al. (28. Januar 2015). "Umfassende genomische Charakterisierung von Plattenepithelkarzinomen im Kopf-Hals-Bereich" . Natur . 517 (7536): 576–582. Bibcode : 2015Natur.517..576T . doi : 10.1038/nature14129 . PMC 4311405 . PMID 25631445 .
- Lohavanichbutr, P.; Houck, J.; Ventilator, W.; et al. (Februar 2009). „Genomweite Genexpressionsprofile von HPV-positivem und HPV-negativem Oropharynxkarzinom: mögliche Auswirkungen auf die Behandlungsoptionen“ . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 135 (2): 180–188. doi : 10.1001/archoto.2008.540 . ISSN 0886-4470 . PMC 2761829 . PMID 19221247 .
- Mannarini, L.; Kratochvil, V.; Calabrese, L.; Gomes Silva, L.; Morbini, P.; Betka, J.; Benazzo, M. (2009). "Humanes Papillomavirus (HPV) im Kopf-Hals-Bereich: Literaturübersicht" . Acta Otorhinolaryngologica Italica . 29 (3): 119–126. PMC 2.815.356 . PMID 20140157 .
- Martinez, I.; Wang, J.; Hobson, K.; Ferris, R.; Khan, S. (Januar 2007). "Identifizierung von unterschiedlich exprimierten Genen in HPV-positiven und HPV-negativen oropharyngealen Plattenepithelkarzinomen" . Europäische Zeitschrift für Krebs . 43 (2): 415–432. doi : 10.1016/j.ejca.2006.09.001 . ISSN 0959-8049 . PMC 1847595 . PMID 17079134 .
- Maslon, Magda M.; Hupp, Ted R. (September 2010). „Arzneimittelentdeckung und mutantes p53“. Trends in der Zellbiologie . 20 (9): 542–555. doi : 10.1016/j.tcb.2010.06.005 . PMID 20656489 .
- Michl, P; Pazdera, J; Prochazka, M; Rosa, R; Stosova, T (2010). "Humanes Papillomavirus in der Ätiologie von Kopf-Hals-Karzinomen" (PDF) . Biomedizinische Arbeiten der Medizinischen Fakultät der Universität Palacky, Olomouc, Tschechoslowakei . 154 (1): 9–12. doi : 10.5507/bp.2010.004 . PMID 20445705 .
- Robinson, M.; Sloan, P.; Shaw, R. (2010). „Verfeinerung der Diagnose von oropharyngealen Plattenepithelkarzinomen mit humanen Papillomavirus-Tests“. Orale Onkologie . 46 (7): 492–496. doi : 10.1016/j.oraloncology.2010.02.013 . PMID 20227331 .
- Schlecht, N.; Burk, R.; Adrien, L.; et al. (November 2007). „Genexpressionsprofile bei HPV-infiziertem Kopf- und Halskrebs“. Die Zeitschrift für Pathologie . 213 (3): 283–293. doi : 10.1002/Pfad.2227 . ISSN 0022-3417 . PMID 17893858 . S2CID 11205618 .
- Seiwert, Tanguy Y. (10. Dezember 2014). „Bindungen: p16 als prognostischer Biomarker und die Notwendigkeit hochpräziser humaner Papillomavirus-Tests“. Zeitschrift für klinische Onkologie . 32 (35): 3914–3916. doi : 10.1200/JCO.2014.57.9268 . PMID 25366683 .
- Smeets, S.; Van Der Plas, M.; Schaaij-Visser, T.; Van Veen, E.; Van Meerloo, J.; Braakhuis, B.; Steenbergen, R.; Brakenhoff, R. (2010). "Immortalisierung von oralen Keratinozyten durch funktionelle Inaktivierung der p53- und pRb-Wege" . Internationale Zeitschrift für Krebs . 128 (7): 1596–605. doi : 10.1002/ijc.25474 . PMID 20499310 . S2CID 21846809 .
- Syrjänen, S. (2004). "HPV-Infektionen und Tonsillenkarzinom" . Zeitschrift für Klinische Pathologie . 57 (5): 449–455. doi : 10.1136/jcp.2003.008656 . PMC 1770289 . PMID 15113849 .
- Syrjänen, Kari; Syrjänen, Stina; Lamberg, Matti; Pyrhönen, Seppo; Nuutinen, Juhant (Dezember 1983). „Morphologische und immunhistochemische Beweise, die auf eine Beteiligung des humanen Papillomavirus (HPV) an der oralen Plattenepithelkarzinomentstehung hindeuten“. Internationale Zeitschrift für Oralchirurgie . 12 (6): 418–424. doi : 10.1016/S0300-9785(83)80033-7 . PMID 6325356 .
- Unterbrink, M.; Hoskins, S.; Pou, A.; Albrecht, T. (2008). „Virale Interaktion: ein möglicher Faktor bei der Progression von Kopf-Hals-Krebs“. Acta Oto-Laryngologica . 128 (12): 1361-1369. doi : 10.1080/00016480801965001 . PMID 18607925 . S2CID 205395382 .
- Vidal, L.; Gillison, M. (2008). „Humanes Papillomavirus in HNSCC: Erkennung eines bestimmten Krankheitstyps“. Hämatologische Onkologie-Kliniken in Nordamerika . 22 (6): 1125–1142, vii. doi : 10.1016/j.hoc.2008.08.06 . PMID 19010263 .
- Vokes, EE; Agrawal, N; Seiwert, TY (Dezember 2015). "HPV-assoziierter Kopf-Hals-Krebs" . Zeitschrift des Nationalen Krebsinstituts . 107 (12): djv344. doi : 10.1093/jnci/djv344 . PMID 26656751 .
- Weinberger, P.; Yu, Z.; Kountourakis, P.; Sasaki, C.; Haffty, B.; Kowalski, D.; Merkley, M.; Rand, D.; Camp, R.; Psyrri, A. (September 2009). „Definition molekularer Phänotypen des humanen Papillomavirus-assoziierten oropharyngealen Plattenepithelkarzinoms: Validierung der Drei-Klassen-Hypothese“. HNO-Chirurgie – Kopf-Hals-Chirurgie . 141 (3): 382–389.e1. doi : 10.1016/j.otohns.2009.04.014 . ISSN 0194-5998 . PMID 19716018 . S2CID 207300943 .
- Yamakawa-Kakuta, Y; Kawamata, H; Doi, Y; Fujimori, T; Imai, Y (15. September 2009). "Hängt die Expression von HPV16/18 E6/E7 in Plattenepithelkarzinomen des Kopfes und Halses mit ihren klinisch-pathologischen Eigenschaften zusammen?" . Internationale Zeitschrift für Onkologie . 35 (5): 983–988. doi : 10.3892/ijo_00000412 . PMID 19787251 .
- zur Hausen, Harald (1. Mai 2002). „Papillomaviren und Krebs: Von der Grundlagenstudie zur klinischen Anwendung“. Natur Bewertungen Krebs . 2 (5): 342-350. doi : 10.1038/nrc798 . PMID 12044010 . S2CID 4991177 .
Diagnose und Staging
- Chenevert, J; Seethala, RR; Barnes, EL; Chiosea, SI (April 2012). „Plattenepithelkarzinom, das von einem unbekannten Primärtumor in den Hals metastasiert: der potenzielle Einfluss moderner pathologischer Untersuchungen auf die wahrgenommene Inzidenz von humanem Papillomavirus-positivem Oropharynxkarzinom vor 1970“. Das Laryngoskop . 122 (4): 793–796. doi : 10.1002/lary.21899 . PMID 22252715 . S2CID 25749527 .
- Goldenberg, David; Begum, Shahnaz; Westra, William H.; Khan, Zubair; Sciubba, James; Pai, Sara I.; Califano, Joseph A.; Tufano, Ralph P.; Koch, Wayne M. (Juli 2008). "Zystische Lymphknotenmetastasen bei Patienten mit Kopf-Hals-Krebs: Ein HPV-assoziiertes Phänomen" (PDF) . Kopf & Hals . 30 (7): 898–903. doi : 10.1002/hed.20796 . PMID 18383529 . S2CID 32614424 .
- Huang, Shao Hui; Xu, Wei; Waldron, John; et al. (10. März 2015). „Refining American Joint Committee on Cancer/Union for International Cancer Control TNM Stage and Prognostic Groups for Human Papillomavirus-Related Oropharyngeal Carcinomas“. Zeitschrift für klinische Onkologie . 33 (8): 836–845. doi : 10.1200/JCO.2014.58.6412 . PMID 25667292 .
- Keane, Florence K.; Chen, Yui-Hui; Neville, Bridget A.; Tischler, Roy B.; Schönfeld, Jonathan D.; Catalano, Paul J.; Margalit, Danielle N. (1. August 2015). „Ändern der prognostischen Bedeutung des Tumorstadiums und des Knotenstadiums bei Patienten mit Plattenepithelkarzinom des Oropharynx in der Ära des humanen Papillomavirus“. Krebs . 121 (15): 2594–2602. doi : 10.1002/cncr.29402 . PMID 25873094 . S2CID 205670627 .
- Lydiatt, William M.; Patel, Snehal G.; O'Sullivan, Brian; Brandwein, Margaret S.; Ridge, John A.; Migliacci, Jocelyn C.; Loomis, Ashley M.; Shah, Jatin P. (März 2017). „Kopf-Hals-Krebs – wichtige Änderungen im American Joint Committee on Cancer, 8. Auflage des Handbuchs zur Krebs-Inszenierung“ . CA: Ein Krebsjournal für Kliniker . 67 (2): 122–137. doi : 10.3322/caac.21389 . PMID 28128848 .
- O'Sullivan, Brian; Huang, Shao Hui; Su, Jie; et al. (April 2016). „Entwicklung und Validierung eines Staging-Systems für HPV-assoziierten Oropharynxkarzinom durch das International Collaboration on Oropharyngeal Cancer Network for Staging (ICON-S): eine multizentrische Kohortenstudie“. Die Lancet-Onkologie . 17 (4): 440–451. doi : 10.1016/S1470-2045(15)00560-4 . PMID 26936027 .
- Porceddu, Sandro V (April 2016). „Eine TNM-Klassifizierung für HPV+ Oropharynxkarzinom“. The Lancet Oncology (Editorial). 17 (4): 403–404. doi : 10.1016/S1470-2045(15)00611-7 . PMID 26936026 .
Behandlung
- Brockstein, Bruce E.; Vokes, Everett E. (Februar 2011). „Kopf-Hals-Krebs im Jahr 2010: Maximierung des Überlebens und Minimierung der Toxizität“. Nature Bewertungen Klinische Onkologie . 8 (2): 72–74. doi : 10.1038/nrclinonc.2010.226 . PMID 21278773 . S2CID 1347226 .
- Corry, Juni; Peters, Lester J.; Rischin, Danny (10. Januar 2015). „Auswirkungen der Größe und Erfahrung des Zentrums auf die Ergebnisse bei Kopf-Hals-Krebs“. Zeitschrift für klinische Onkologie . 33 (2): 138–140. doi : 10.1200/JCO.2014.58.2239 . PMID 25488964 .
- Fachry, C.; Westra, W.; Li, S.; Cmelak, A.; Ridge, J.; Pinto, H.; Forastiere, A.; Gillison, M. (Februar 2008). „Verbessertes Überleben von Patienten mit humanem Papillomavirus-positivem Plattenepithelkarzinom im Kopf-Hals-Bereich in einer prospektiven klinischen Studie“ . Zeitschrift des Nationalen Krebsinstituts . 100 (4): 261–269. doi : 10.1093/jnci/djn011 . ISSN 0027-8874 . PMID 18270337 .
- Fachry, Carole; Zhang, Qiang; Nguyen-Tan, Phuc Felix; et al. (20. Oktober 2014). "Humanes Papillomavirus und Gesamtüberleben nach Progression des oropharyngealen Plattenepithelkarzinoms" . Zeitschrift für klinische Onkologie . 32 (30): 3365–3373. doi : 10.1200/JCO.2014.55.1937 . PMC 4195851 . PMID 24958820 .
- Fundakowski, Christopher E.; Lango, Miriam (11. Juli 2016). „Überlegungen bei der chirurgischen versus nicht-chirurgischen Behandlung von HPV-positivem Oropharynxkarzinom“ . Krebserkrankungen des Kopfes und des Halses (Rezension). 1 (1): 6. doi : 10.1186/s41199-016-0007-8 . PMC 6457136 . PMID 31093336 .
- Galloway, TJ; Ridge, JA (10. Oktober 2015). „Management von Plattenepithelkarzinomen, die zu zervikalen Knoten mit einer unbekannten primären Stelle metastasieren“. Zeitschrift für klinische Onkologie (Rezension). 33 (29): 3328–3337. CiteSeerX 10.1.1.1029.7347 . doi : 10.1200/JCO.2015.61.0063 . PMID 26351351 .
- Maxwell, Jessica H.; Mehta, Vikas; Wang, Hong; Cunningham, Diana; Duvvuri, Umamaheswar; Kim, Seungwon; Johnson, Jonas; Ferris, Robert L. (Juli 2014). "Lebensqualität bei Kopf-Hals-Krebspatienten: Auswirkungen von HPV und primäre Behandlungsmodalität". Das Laryngoskop . 124 (7): 1592–1597. doi : 10.1002/lary.24508 . PMID 24353066 . S2CID 8040452 .
- Mehanna, H; Evans, M; Beasley, M; Chatterjee, S; Dilkes, M; Homer, J; O'Hara, J; Robinson, M; Shaw, R; Sloan, P (12. Mai 2016). "Oropharyngealkarzinom: Nationale multidisziplinäre Leitlinien des Vereinigten Königreichs" . Die Zeitschrift für Laryngologie und Otologie . 130 (S2): S90–S96. doi : 10.1017/S0022215116000505 . PMC 4873902 . PMID 27841123 .
- Mehr, Yogesh I.; Tsue, Terance T.; Girod, Douglas A.; Harbison, John; Sykes, Kevin J.; Williams, Carson; Shnayder, Yelizaveta (1. Januar 2013). „Funktionale Schluckergebnisse nach transoraler Roboterchirurgie vs. primärer Radiochemotherapie bei Patienten mit fortgeschrittenem Oropharynx- und Supraglottis-Krebs“ . JAMA HNO-Chirurgie – Kopf-Hals-Chirurgie . 139 (1): 43–48. doi : 10.1001/jamaoto.2013.1074 . PMID 23247974 .
- Sharma, Arun; Méndez, Eduardo; Yueh, Bevan; Lohavanichbutr, Pawadee; Houck, John; Doody, David R.; Futran, Neal D.; Upton, Melissa P.; Schwartz, Stephen M.; Chen, Chu (24. Januar 2012). "Patienten mit humanem Papillomavirus-positivem Mundhöhlen- und Oropharynxkarzinom haben keine bessere Lebensqualität" . HNO-Chirurgie – Kopf-Hals-Chirurgie . 146 (5): 739–745. doi : 10.1177/0194599811434707 . PMC 3535430 . PMID 22275190 .
- Spanos, William C.; Nowicki, Paul; Lee, Dong Wook; Hoover, Andrew; Geisel, Bruce; Gupta, Anjali; Anderson, Mary E.; Lee, John H. (1. November 2009). „Immunantwort während der Therapie mit Cisplatin oder Bestrahlung bei humanem Papillomavirus-bedingtem Kopf-Hals-Krebs“ . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 135 (11): 1137–46. doi : 10.1001 / archoto.2009.159 . PMID 19917928 .
- Wansom, Derrick; Licht, Emily; Worden, Frank; et al. (20. Dezember 2010). „Korrelation der zellulären Immunität mit dem Status und Ergebnis des humanen Papillomavirus 16 bei Patienten mit fortgeschrittenem Oropharynxkarzinom“ . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 136 (12): 1267–73. doi : 10.1001/archoto.2010.211 . PMC 3342998 . PMID 21173378 .
Operation
- Adelstein, David J.; Ridge, John A.; Brizel, David M.; et al. (Dezember 2012). "Transorale Resektion von Rachenkrebs: Zusammenfassung eines Klinischen Studienplanungstreffens des Lenkungsausschusses für Kopf- und Halskrebs des National Cancer Institute, 6.-7. November 2011, Arlington, Virginia" . Kopf & Hals . 34 (12): 1681–1703. doi : 10.1002/hed.23136 . hdl : 2027.42/94490 . PMC 7721598 . PMID 23015475 . S2CID 542440 .
- de Almeida, John R.; Byrd, James K.; Wu, Rebecca; Stucken, Chaz L.; Duvvuri, Uma; Goldstein, David P.; Miles, Brett A.; Teng, Marita S.; Gupta, Vishal; Genden, Eric M. (September 2014). „Eine systematische Überprüfung der transoralen Roboterchirurgie und Strahlentherapie für Oropharynx-Krebs im Frühstadium: Eine systematische Überprüfung“. Das Laryngoskop . 124 (9): 2096–2102. doi : 10.1002/lary.24712 . PMID 24729006 . S2CID 20283441 .
- Ambrosch, Petra; Kron, Martina; Pradier, O.; Steiner, W. (2001). „Wirksamkeit der selektiven Halsdissektion: Eine Überprüfung von 503 Fällen von elektiver und therapeutischer Behandlung des Halses bei Plattenepithelkarzinomen des oberen Aerodigestivtrakts“. HNO-Chirurgie – Kopf-Hals-Chirurgie . 124 (2): 180–187. doi : 10.1067/mhn.2001.111598 . PMID 11226954 . S2CID 25298496 .
- Canis, Martin; Martin, Alexios; Kron, Martina; Konstantinou, Alexandra; Ihler, Friedrich; Wolff, Hendrik A.; Matthias, Christoph; Steiner, Wolfgang (29. Dezember 2012). "Ergebnisse der transoralen Lasermikrochirurgie bei 102 Patienten mit Plattenepithelkarzinom der Mandel" . Europäisches Archiv für Hals-Nasen-Ohren-Heilkunde . 270 (8): 2299–2306. doi : 10.1007/s00405-012-2335-6 . PMC 3699702 . PMID 23274878 .
- Chen, AllenM.; Daly, Megan E.; Luu, Quang; Donald, Paul J.; Abschied, D. Gregory (März 2015). „Vergleich der funktionellen Ergebnisse und der Lebensqualität zwischen transoraler Chirurgie und definitiver Radiochemotherapie bei Oropharynxkarzinom“. Kopf & Hals . 37 (3): 381–385. doi : 10.1002/hed.23610 . PMID 24431059 . S2CID 28264800 .
- Chia, Stanley H.; Gross, Neil D.; Richmon, Jeremy D. (Dezember 2013). „Chirurg Erfahrung und Komplikationen mit Transoral Robotic Surgery (TORS)“. HNO-Chirurgie – Kopf-Hals-Chirurgie . 149 (6): 885–892. doi : 10.1177/0194599813503446 . PMID 24013139 . S2CID 3339804 .
- Choby, Garret W.; Kim, Jeehong; Ling, Diane C.; Abberbock, Shira; Mandal, Rajarsi; Kim, Seungwon; Ferris, Robert L.; Duvvuri, Umamaheswar (1. Juni 2015). „Transorale Roboterchirurgie allein für Oropharynxkarzinom“ . JAMA HNO-Chirurgie – Kopf-Hals-Chirurgie . 141 (6): 499–504. doi : 10.1001/jamaoto.2015.0347 . PMID 25834991 .
- Cohen, Marc A.; Weinstein, Gregory S.; O'Malley, Bert W.; Feldmann, Michael; Quon, Harry (April 2011). „Transorale Roboterchirurgie und Status des humanen Papillomavirus: Onkologische Ergebnisse“. Kopf & Hals . 33 (4): 573–580. doi : 10.1002/hed.21500 . PMID 21425382 . S2CID 24704123 .
- Durmus, K; Rangarajan, SV; Alt, MO; Agrawal, A; Teknos, TN; Ozer, E (Juni 2014). "Transoraler robotischer Zugang zum Karzinom unbekannter primärer" . Kopf & Hals . 36 (6): 848–52. doi : 10.1002/hed.23385 . PMC 4266274 . PMID 23720223 .
- Dziegielewski, Peter T.; Teknos, Theodoros N.; Durmus, Kasim; Alt, Matthäus; Agrawal, Amit; Kakarala, Kiran; Marcinow, Anna; Ozer, Enver (1. November 2013). „Transorale Roboterchirurgie für Oropharynxkarzinom“ . JAMA HNO-Chirurgie – Kopf-Hals-Chirurgie . 139 (11): 1099–108. doi : 10.1001/jamaoto.2013.2747 . PMC 4274181 . PMID 23576186 .
- Dowthwaite, Samuel A.; Franklin, Jason H.; Palma, David A.; Fung, Kevin; Jo, John; Nichols, Anthony C. (2012). „Die Rolle der transoralen Roboterchirurgie bei der Behandlung von Oropharynxkarzinom: Ein Überblick über die Literatur“ . ISRN Onkologie . 2012 : 945162. doi : 10.5402/2012/945162 . PMC 3347745 . PMID 22606380 .
- Genden, Eric M.; Kötz, Tamar; Tong, Charles CL; Smith, Claris; Sikora, Andrew G.; Teng, Marita S.; Packer, Stuart H.; Lawson, William L.; Kao, Johnny (August 2011). „Transorale Roboterresektion und Rekonstruktion bei Kopf-Hals-Krebs“. Das Laryngoskop . 121 (8): 1668–1674. doi : 10.1002/lary.21845 . PMID 21792953 . S2CID 25175486 .
- Graboyes, EM; Sinha, P; Thorstad, WL; Reich, JT; Haughey, BH (November 2015). „Management von humanen Papillomavirus-bezogenen unbekannten Primären des Kopfes und des Halses mit einem transoralen chirurgischen Ansatz“. Kopf & Hals . 37 (11): 1603–11. doi : 10.1002/hed.23800 . PMID 24931847 . S2CID 33000811 .
- Haughey, Bruce H.; Hinni, Michael L.; Salassa, John R.; Hayden, Richard E.; Grant, David G.; Rich, Jason T.; Milov, Simon; Lewis, James S.; Krishna, Murli (Dezember 2011). „Transorale Lasermikrochirurgie als Primärbehandlung für Oropharynxkarzinom im fortgeschrittenen Stadium: Eine multizentrische Studie der Vereinigten Staaten“. Kopf & Hals . 33 (12): 1683–1694. doi : 10.1002/hed.21669 . PMID 21284056 . S2CID 10611085 .
- Mehta, V; Johnson, P; Tassler, A; Kim, S; Ferris, RL; Nance, M; Johnson, JT; Duvvuri, U (Januar 2013). „Ein neues Paradigma für die Diagnose und Behandlung unbekannter Primärtumoren des Kopf-Hals-Bereichs: eine Rolle für die transorale Roboterchirurgie“ . Das Laryngoskop . 123 (1): 146–151. doi : 10.1002/lary.23562 . PMID 23154813 . S2CID 321364 .
- Moore, Eric J.; Hinni, Michael L.; Olsen, Kerry D.; Preis, Daniel L.; Laborde, Rebecca R.; Inman, Jared C. (Juni 2012). „Kostenüberlegungen bei der Behandlung von oropharyngealen Plattenepithelkarzinomen“. HNO-Chirurgie – Kopf-Hals-Chirurgie . 146 (6): 946–951. doi : 10.1177/0194599812437534 . PMID 22344182 . S2CID 40004254 .
- Moore, Eric J.; Henstrom, Doug K.; Olsen, Kerry D.; Kasperbauer, Jan L.; McGree, Michaela E. (März 2009). „Transorale Resektion von Plattenepithelkarzinomen der Tonsillen“. Das Laryngoskop . 119 (3): 508–515. doi : 10.1002/lary.20124 . PMID 19235742 . S2CID 26256802 .
- Moore, Eric J.; Olsen, Kerry D.; Kasperbauer, Jan L. (November 2009). „Transorale Roboterchirurgie für oropharyngeale Plattenepithelkarzinome: Eine prospektive Studie zur Durchführbarkeit und funktionellen Ergebnisse“. Das Laryngoskop . 119 (11): 2156–2164. doi : 10.1002/lary.20647 . PMID 19824067 . S2CID 20097467 .
- Moore, Eric J.; Olsen, Steven M.; Laborde, Rebecca R.; Garcia, Joaquín J.; Walsh, Francis J.; Preis, Daniel L.; Janus, Jeffrey R.; Kasperbauer, Jan L.; Olsen, Kerry D. (März 2012). "Langfristige funktionelle und onkologische Ergebnisse der transoralen Roboterchirurgie für oropharyngeale Plattenepithelkarzinome" . Verfahren der Mayo-Klinik . 87 (3): 219–225. doi : 10.1016/j.mayocp.2011.10.007 . PMC 3538408 . PMID 22386176 .
- Moore, Eric J.; Hinni, Michael L. (April 2013). „Kritische Überprüfung: Transorale Laser-Mikrochirurgie und robotergestützte Chirurgie für Oropharynx-Krebs, einschließlich Krebs im Zusammenhang mit dem humanen Papillomavirus“. International Journal of Radiation Oncology, Biologie, Physik (Rezension). 85 (5): 1163-1167. doi : 10.1016/j.ijrobp.2012.08.033 . PMID 23182390 .
- Patel, SA; Magnuson, JS; Holsinger, FC; et al. (November 2013). "Roboterchirurgie für primäres Plattenepithelkarzinom des Kopfes und Halses unbekannter Lokalisation" . JAMA HNO-Chirurgie – Kopf-Hals-Chirurgie . 139 (11): 1203-1211. doi : 10.1001 / Jamaoto.2013.5189 . PMID 24136446 .
- Pollei, Taylor R.; Hinni, Michael L.; Moore, Eric J.; Hayden, Richard E.; Olsen, Kerry D.; Casler, John D.; Walter, Logan C. (1. November 2013). „Analyse von postoperativen Blutungen und Risikofaktoren in der transoralen Chirurgie des Oropharynx“ . JAMA HNO-Chirurgie – Kopf-Hals-Chirurgie . 139 (11): 1212–8. doi : 10.1001/jamaoto.2013.5097 . PMID 24113922 .
- Rinaldi, V.; Pagani, D; Torretta, S; Pignataro, L (26. September 2013). "Transorale Roboterchirurgie in der Behandlung von Kopf-Hals-Tumoren" . E-Krebsmedizin . 7 : 359. doi : 10.3332/ecancer.2013.359 . PMC 3782590 . PMID 24073017 .
- Sinclair, CF; McColloch, NL; Carroll, WR; Rosenthal, EL; Desmond, RA; Magnuson, JS (November 2011). „Vom Patienten wahrgenommene und objektive funktionelle Ergebnisse nach transoraler Roboterchirurgie für frühes Oropharynxkarzinom“ . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 137 (11): 1112–6. doi : 10.1001 / archoto.2011.172 . PMID 22106235 .
- Steiner, Wolfgang; Fierek, Oliver; Ambrosch, Petra; Hommerich, Christian P.; Kron, Martina (1. Januar 2003). "Transorale Laser-Mikrochirurgie für Plattenepithelkarzinom der Zungenbasis" . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 129 (1): 36–43. doi : 10.1001 / archotol.129.1.36 . PMID 12525192 .
- Walvekar, Rohan R.; Li, RyanJ.; Gooding, William E.; Gibson, Michael K.; Reiher, Dwight; Johnson, Jonas T.; Ferris, Robert L. (Dezember 2008). „Rolle der Chirurgie bei begrenzten (T1-2, N0-1) Krebserkrankungen des Oropharynx“. Das Laryngoskop . 118 (12): 2129–2134. doi : 10.1097/MLG.0b013e3181857950 . PMID 18948826 . S2CID 8072424 .
- Weinstein, Gregory S.; O'Malley, Bert W.; Magnuson, J. Scott; Carroll, William R.; Olsen, Kerry D.; Daio, Lixia; Moore, Eric J.; Holsinger, F. Christopher (August 2012). „Transorale Roboterchirurgie: Eine multizentrische Studie zur Bewertung von Durchführbarkeit, Sicherheit und chirurgischen Rändern“. Das Laryngoskop . 122 (8): 1701–1707. doi : 10.1002/lary.23294 . PMID 22752997 . S2CID 30048884 .
- Weiß, Hilliary N.; Moore, Eric J.; Rosenthal, Eben L.; Carroll, William R.; Olsen, Kerry D.; Desmond, Reneé A.; Magnuson, J. Scott (20. Dezember 2010). „Transorale roboterassistierte Chirurgie für Kopf- und Hals-Plattenepithelkarzinom“ . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 136 (12): 1248–52. doi : 10.1001 / archoto.200.216 . PMID 21173375 .
- Woolgar, JuliaAnne; Triantafyllou, Asterios (November 2005). „Eine histopathologische Bewertung der chirurgischen Ränder in oralen und oropharyngealen Krebsresektionsproben“. Orale Onkologie . 41 (10): 1034–1043. doi : 10.1016/j.oraloncology.2005.06.008 . PMID 16129652 .
Strahlung
- Adelstein, David J.; Li, Yi; Adams, George L.; Wagner, Heinrich; Kisch, Julie A.; Ensley, John F.; Schuller, David E.; Forastiere, Arlene A. (Januar 2003). „Ein Intergruppen-Phase-III-Vergleich der Standard-Strahlentherapie und zwei Zeitpläne der gleichzeitigen Radiochemotherapie bei Patienten mit inoperablem Plattenepithel-Kopf-Hals-Karzinom“. Zeitschrift für klinische Onkologie . 21 (1): 92–98. doi : 10.1200/JCO.2003.01.008 . PMID 12506176 .
- Al-Mamgani, Abrahim; van Rooij, Peter; Verduijn, Gerda M.; Mehilal, Robert; Kerrebijn, Jeroen D.; Levendag, Peter C. (Februar 2013). „Der Einfluss der Behandlungsmodalität und Bestrahlungstechnik auf Ergebnisse und Toxizität von Patienten mit lokal fortgeschrittenem Oropharynxkarzinom“. Das Laryngoskop . 123 (2): 386–393. doi : 10.1002/lary.23699 . PMID 23404489 . S2CID 37351159 .
- Bedi, Meena; Firat, Selim; Semenenko, Wladimir A.; Schultz, Christopher; Tripp, Patrick; Byhardt, Roger; Wang, Dian (Mai 2012). "Elektive Lymphknotenbestrahlung mit intensitätsmodulierter Strahlentherapie: Ist eine konventionelle Dosisfraktionierung notwendig?". Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 83 (1): e87–e92. doi : 10.1016/j.ijrobp.2011.12.016 . PMID 22516389 .
- Beitler, Jonathan J.; Zhang, Qiang; Fu, Karen K.; Trotti, Andy; Spencer, Sharon A.; Jones, Christopher U.; Garten, Adam S.; Shenouda, George; Harris, Jonathan; Ang, Kian K. (Mai 2014). „Endergebnisse der lokal-regionalen Kontrolle und der späten Toxizität von RTOG 9003: Eine randomisierte Studie mit veränderter Fraktionierungsstrahlung bei lokal fortgeschrittenem Kopf- und Halskrebs“ . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 89 (1): 13–20. doi : 10.1016/j.ijrobp.2013.12.027 . PMC 4664465 . PMID 24613816 .
- Bourhis, Jean; Overgaard, Jens; Audry, Helene; et al. (September 2006). „Hyperfraktionierte oder beschleunigte Strahlentherapie bei Kopf-Hals-Krebs: eine Meta-Analyse“. Die Lanzette . 368 (9538): 843–854. doi : 10.1016/S0140-6736(06)69121-6 . PMID 16950362 . S2CID 20670949 .
- Caudell, Jimmy J.; Schaner, Philip E.; Desmond, Renee A.; Meredith, Ruby F.; Spencer, Sharon A.; Bonner, James A. (Februar 2010). „Dosimetrische Faktoren im Zusammenhang mit langfristiger Dysphagie nach definitiver Strahlentherapie für Plattenepithelkarzinom des Kopfes und Halses“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 76 (2): 403–409. doi : 10.1016/j.ijrobp.2009.02.017 . PMID 19467801 .
- Chen, AllenM.; Li, Judy; Beckett, Laurel A. ; Zhara, Talia; Lebe wohl, Gregory; Lau, Derick H.; Gandour-Edwards, Regina; Vaughan, Andrew T.; Purdy, James A. (Januar 2013). „Unterschiedliche Ansprechraten auf Bestrahlung bei Patienten mit humanem Papillomavirus positivem und negativem Oropharynxkarzinom“. Das Laryngoskop . 123 (1): 152–157. doi : 10.1002/lary.23570 . PMID 23008061 . S2CID 5106261 .
- Kinn, Re-I; Spencer, Christopher R.; DeWees, Todd; et al. (November 2016). „Neubewertung der postoperativen Strahlendosis bei der Behandlung von humanem Papillomavirus-positivem Oropharynxkarzinom“. Kopf & Hals . 38 (11): 1643–1649. doi : 10.1002/hed.24486 . PMID 27152851 . S2CID 3577182 .
- Cramer, John David; Ferris, Robert L.; Duvvuri, Umamaheswar (20. Mai 2018). „Behandlungsdeintensivierung auf Chirurgie nur für humanes Papillomavirus-assoziiertes Oropharynxkarzinom im Stadium I“. Zeitschrift für klinische Onkologie . 36 (15 Nachtrag): 6003. doi : 10.1200/JCO.2018.36.15_suppl.6003 .
- Daly, Megan E.; Le, Quynh-Do; Maxim, Peter G.; Klo, Billy W.; Kaplan, Michael J.; Fischbein, Nancy J.; Pinto, Harlan; Chang, Daniel T. (April 2010). „Intensity-Modulated Radiotherapy in the Treatment of Oropharyngeal Cancer: Clinical Outcomes and Patterns of Failure“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 76 (5): 1339–1346. doi : 10.1016/j.ijrobp.2009.04.06 . PMID 19540068 .
- Deasy, Joseph O.; Moiseenko, Vitali; Marken, Lawrence; Chao, KS Clifford; Nam, Jiho; Eisbruch, Avraham (März 2010). „Strahlentherapie-Dosis-Volumen-Auswirkungen auf die Funktion der Speicheldrüsen“ . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 76 (3): S58–S63. doi : 10.1016/j.ijrobp.2009.06.090 . PMC 4041494 . PMID 20171519 .
- Dok, Rüveyda; Kalev, Peter; Van Limbergen, Evert Jan; Asbagh, Layka Abbasi; Vázquez, Iria; Hauben, Esther; Sablina, Anna; Nuyts, Sandra (15. März 2014). „p16INK4a beeinträchtigt die homologe Rekombination–vermittelte DNA-Reparatur in humanen Papillomavirus–positiven Kopf-Hals-Tumoren“ . Krebsforschung . 74 (6): 1739–1751. doi : 10.1158/0008-5472.CAN-13-2479 . PMID 24473065 .
- Feng, Felix Y.; Kim, HyungjinM.; Lyden, Teresa H.; Haxer, Marc J.; Feng, Maria; Worden, Frank P.; Chepeha, Douglas B.; Eisbruch, Avraham (August 2007). „Intensitätsmodulierte Strahlentherapie von Kopf-Hals-Tumoren mit dem Ziel, Dysphagie zu reduzieren: Frühe Dosis-Wirkungs-Beziehungen für die Schluckstrukturen“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 68 (5): 1289–1298. doi : 10.1016/j.ijrobp.2007.02.049 . PMID 17560051 .
- Forastiere, Arlene A.; Zhang, Qiang; Weber, RandalS.; et al. (März 2013). "Langzeitergebnisse von RTOG 91-11: Ein Vergleich von drei nicht-chirurgischen Behandlungsstrategien zur Erhaltung des Kehlkopfes bei Patienten mit lokal fortgeschrittenem Kehlkopfkrebs" . Zeitschrift für klinische Onkologie . 31 (7): 845–852. doi : 10.1200/JCO.2012.43.6097 . PMC 3577950 . PMID 23182993 .
- Fu, Karen K.; Pajak, Thomas F.; Trotti, Andy; Jones, Christopher U.; Spencer, Sharon A.; Phillips, Theodore L.; Garten, Adam S.; Ridge, John A.; Cooper, Jay S.; Ang, K. Kian (August 2000). "Eine randomisierte Phase-III-Studie der Strahlentherapie-Onkologie-Gruppe (RTOG) zum Vergleich der Hyperfraktionierung und zweier Varianten der beschleunigten Fraktionierung mit der Standard-Fraktionierungsstrahlentherapie für Plattenepithelkarzinome im Kopf-Hals-Bereich: erster Bericht über RTOG 9003". Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 48 (1): 7–16. doi : 10.1016/S0360-3016(00)00663-5 . PMID 10924966 .
- Garten, Adam S.; Dong, Lei; Morrison, William H.; et al. (März 2013). „Muster des Wiederauftretens von Krankheiten nach der Behandlung von Oropharynxkarzinom mit intensitätsmodulierter Strahlentherapie“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 85 (4): 941–947. doi : 10.1016/j.ijrobp.2012.08.004 . PMID 22975604 .
- Heymach, John; Krilov, Lada; Alberg, Anthony; Baxter, Nancy; Chang, Susan Marina; Corcoran, Ryan B.; Dale, William; DeMichele, Angela; Magid Diefenbach, Catherine S.; Dreicer, Robert; Epstein, Andrew S.; Gilison, Maura L.; Graham, David L.; Jones, Joshua; Ko, Andrew H.; Lopez, Ana-Maria; Maki, Robert G.; Rodriguez-Galindo, Carlos; Schilsky, Richard L.; Sznol, Mario; Westin, Shannon Neville; Burstein, Harold (April 2018). „Clinical Cancer Advances 2018: Annual Report on Progress Against Cancer from the American Society of Clinical Oncology“. Zeitschrift für klinische Onkologie . 36 (10): 1020–1044. doi : 10.1200/JCO.2017.77.0446 . PMID 29380678 .
- Kramer, Simon; Gelber, Richard D.; Schnee, James B.; Marcial, Victor A.; Lowry, Louis D.; Davis, Lawrence W.; Chandler, Richard (September 1987). „Kombinierte Strahlentherapie und Chirurgie bei der Behandlung von fortgeschrittenem Kopf-Hals-Karzinom: Abschlussbericht der Studie 73-03 der Strahlentherapie-Onkologie-Gruppe“. Kopf-Hals-Chirurgie . 10 (1): 19–30. doi : 10.1002/hed.2890100105 . PMID 3449477 .
- Langendijk, Johannes A.; Doornaert, Patricia; Verdonck-de Leeuw, Irma M.; Leemans, Charles R.; Aaronson, Neil K.; Slotman, Ben J. (August 2008). „Auswirkungen der späten behandlungsbedingten Toxizität auf die Lebensqualität von Patienten mit Kopf-Hals-Tumoren, die mit Strahlentherapie behandelt werden“. Zeitschrift für klinische Onkologie . 26 (22): 3770–3776. doi : 10.1200/JCO.2007.14.6647 . PMID 18669465 .
- Levendag, Peter C.; Teguh, David N.; Voet, Peter; et al. (Oktober 2007). "Schluckstörungen bei Patienten mit Krebs des Oropharynx werden durch die Strahlentherapiedosis des oberen und mittleren Konstriktormuskels signifikant beeinflusst: Eine Dosis-Wirkungs-Beziehung". Strahlentherapie und Onkologie . 85 (1): 64–73. doi : 10.1016/j.radonc.2007.07.009 . PMID 17714815 .
- Li, Baoqing; Li, Dan; Lau, Derick H; Abschied, D. Gregory; Luu, Quang; Rocke, David M; Newman, Kathleen; Courquin, Jean; Purdy, James A; Chen, Allen M. (2009). „Klinisch-dosimetrische Analyse der Maßnahmen der Dysphagie einschließlich der Abhängigkeit von der Gastrostomie-Sonde bei Patienten mit Kopf-Hals-Tumoren, die definitiv mit einer intensitätsmodulierten Strahlentherapie mit gleichzeitiger Chemotherapie behandelt wurden“ . Strahlenonkologie . 4 (1): 52. doi : 10.1186/1748-717X-4-52 . PMC 2785826 . PMID 19909531 .
- Maccomb, WS; Fletcher, GH (März 1957). „Geplante Kombination von Operation und Bestrahlung bei der Behandlung von fortgeschrittenen primären Kopf-Hals-Karzinomen“. Das American Journal of Röntgenologie, Radiumtherapie und Nuklearmedizin . 77 (3): 397–414. PMID 13403033 .
- Monroe, Marcus M.; Buchmann, Lukas O.; Jagd, Jason P.; Hitchcock, Ying J.; Lloyd, Shane; Hashibe, Mia (April 2017). „Der Nutzen der adjuvanten Bestrahlung bei chirurgisch behandelten T1-2 N1 oropharyngealen Plattenepithelkarzinomen“ . Laryngoskop Investigative HNO-Heilkunde . 2 (2): 57–62. doi : 10.1002/lio2.64 . PMC 5527368 . PMID 28894823 .
- O'Sullivan, B; Warde, P; Grice, B; Goh, C; Payne, D; Liu, F.-F; Waldron, J; Bayley, A; Irisch, J; Gullane, P; Cummings, B (Oktober 2001). „Die Vorteile und Fallstricke der ipsilateralen Strahlentherapie bei Karzinom der Tonsillenregion“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 51 (2): 332–343. doi : 10.1016/S0360-3016(01)01613-3 . PMID 11567806 .
- Parsons, James T.; Mendenhall, William M.; Stringer, Scott P.; et al. (1. Juni 2002). „Plattenepithelkarzinom des Oropharynx: Chirurgie, Strahlentherapie oder beides“ . Krebs . 94 (11): 2967-2980. doi : 10.1002/cncr.10567 . PMID 12115386 . S2CID 34438428 .
- Peters, LesterJ; Göpfert, Helmuth; Ang, K. Kian; et al. (April 1993). „Bewertung der Dosis für die postoperative Strahlentherapie von Kopf-Hals-Tumoren: Erster Bericht einer prospektiven randomisierten Studie“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 26 (1): 3–11. doi : 10.1016/0360-3016(93)90167-T . PMID 8482629 .
- Rich, Jason T.; Milov, Simon; Lewis, James S.; Thorstad, Wade L.; Adkins, Douglas R.; Haughey, Bruce H. (September 2009). "Transorale Lasermikrochirurgie (TLM) ± adjuvante Therapie bei Oropharynxkarzinom im fortgeschrittenen Stadium" . Das Laryngoskop . 119 (9): 1709–1719. doi : 10.1002/lary.20552 . PMC 3877921 . PMID 19572271 .
- Robin, TylerP.; Gan, Gregory N.; Tam, Moses; Westlich, David; Riaz, Nadeem; Karam, Sana D.; Lee, Nancy; Raben, David (April 2016). „Sicherheit der kontralateralen submandibulären Drüsenschonung bei lokal fortgeschrittenem oropharyngealen Karzinomen: Eine multizentrische Überprüfung“. Kopf & Hals . 38 (4): 506–511. doi : 10.1002/hed.23928 . PMID 25482748 . S2CID 2317606 .
- Rosenthal, David I.; Mohamed, Abdallah SR; Garten, Adam S.; Morrison, William H.; El-Naggar, Adel K.; Kamal, Mona; Weber, RandalS.; Fuller, Clifton D.; Peters, Lester J. (August 2017). "Abschlussbericht einer prospektiven randomisierten Studie zur Bewertung der Dosis-Wirkungs-Beziehung für die postoperative Strahlentherapie und pathologische Risikogruppen bei Patienten mit Kopf-Hals-Tumoren" . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 98 (5): 1002–1011. doi : 10.1016/j.ijrobp.2017.02.218 . PMC 5518636 . PMID 28721881 .
- Sher, David J.; Adelstein, David J.; Bajaj, Gopal K.; et al. (Juli 2017). "Strahlentherapie für oropharyngeale Plattenepithelkarzinome: Zusammenfassung einer ASTRO Evidence-Based Clinical Practice Guideline" . Praktische Strahlenonkologie . 7 (4): 246–253. doi : 10.1016/j.prro.2017.02.002 . PMID 28428019 .
- Tsai, Chiaojung Jillian; Jackson, Andrew; Setton, Jeremy; Riaz, Nadeem; McBride, Sean; Leeman, Jonathan; Kowalski, Alex; Happersett, Laura; Lee, Nancy Y. (November 2017). "Modellierung der Dosis-Antwort für späte Dysphagie bei Patienten mit Kopf-Hals-Krebs in der modernen Ära der definitiven Chemoradiation" . JCO Klinische Krebsinformatik . 1 (1): 1–7. doi : 10.1200/cci.17.00070 . PMC 6873915 . PMID 30657398 .
- Vikram, Bhadrasain; Stark, Elliot W.; Schah, Jatin P.; Spiro, Ronald (Januar 1984). „Versagen an der primären Stelle nach multimodaler Behandlung bei fortgeschrittenem Kopf-Hals-Karzinom“. Kopf-Hals-Chirurgie . 6 (3): 720–723. doi : 10.1002/hed.2890060303 . PMID 6693287 .
- Tupchong, Leslie; Phil, D.; Scott, Charles B.; et al. (Januar 1991). „Randomisierte Studie zur präoperativen versus postoperativen Strahlentherapie bei fortgeschrittenem Kopf-Hals-Karzinom: Langzeit-Follow-up der RTOG-Studie 73-03“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 20 (1): 21–28. doi : 10.1016/0360-3016(91)90133-O . PMID 1993628 .
- Woody, Neil M.; Koyfman, Shlomo A.; Xia, Ping; et al. (Februar 2016). "Die regionale Kontrolle bleibt nach einer Dosisdeeskalation der Strahlentherapie auf die beteiligten Lymphknoten bei HPV-positivem Oropharynxkarzinom erhalten". Orale Onkologie . 53 : 91–96. doi : 10.1016/j.oraloncology.2015.11.004 . PMID 26711089 .
Chemotherapie und Radiochemotherapie
- Ang, K. Kian; Zhang, Qiang; Rosenthal, David I.; et al. (20.09.2014). "Randomisierte Phase-III-Studie mit gleichzeitiger beschleunigter Bestrahlung plus Cisplatin mit oder ohne Cetuximab für Kopf-Hals-Karzinom der Stadien III bis IV: RTOG 0522" . Zeitschrift für klinische Onkologie . 32 (27): 2940–2950. doi : 10.1200/JCO.2013.53.5633 . PMC 4162493 . PMID 25154822 .
- Bachaud, Jean-Marc; Cohen-Jonathan, Elizabeth; Alzieu, Claude; David, Jean-Marc; Serrano, Elie; Daly-Schveitzer, Nicolas (Dezember 1996). „Kombinierte postoperative Strahlentherapie und wöchentliche Cisplatin-Infusion bei lokal fortgeschrittenem Kopf-Hals-Karzinom: Abschlussbericht einer randomisierten Studie“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 36 (5): 999–1004. doi : 10.1016/S0360-3016(96)00430-0 . PMID 8985019 .
- Bernier, Jacques; Domenge, Christian; Ozsahin, Mahmut; et al. (6. Mai 2004). „Postoperative Bestrahlung mit oder ohne begleitende Chemotherapie bei lokal fortgeschrittenem Kopf- und Halskrebs“. New England Journal of Medicine . 350 (19): 1945–1952. doi : 10.1056/NEJMoa032641 . PMID 15128894 .
- Bernier, Jacques; Cooper, Jay S.; Pajak, TF; et al. (Oktober 2005). „Definition von Risikoniveaus bei lokal fortgeschrittenem Kopf-Hals-Karzinom: Eine vergleichende Analyse der gleichzeitigen postoperativen Bestrahlungs- und Chemotherapie-Studien der EORTC (#22931) und RTOG (#9501)“. Kopf & Hals . 27 (10): 843–850. doi : 10.1002/hed.20279 . PMID 16161069 . S2CID 13746453 .
- Blanchard, Pierre; Baujat, Bertrand; Holostenco, Victoria; Bourredjem, Abderrahmane; Baey, Charlotte; Bourhis, Jean; Pignon, Jean-Pierre (Juli 2011). „Meta-Analyse der Chemotherapie bei Kopf-Hals-Krebs (MACH-NC): Eine umfassende Analyse nach Tumorort“. Strahlentherapie und Onkologie . 100 (1): 33–40. doi : 10.1016/j.radonc.2011.05.036 . PMID 21684027 .
- Bonner, James A; Harari, Paul M; Giralt, Jordi; et al. (Januar 2010). „Strahlentherapie plus Cetuximab bei lokoregional fortgeschrittenem Kopf-Hals-Karzinom: 5-Jahres-Überlebensdaten aus einer randomisierten Phase-3-Studie und Beziehung zwischen Cetuximab-induziertem Hautausschlag und Überleben“. Die Lancet-Onkologie . 11 (1): 21–28. doi : 10.1016/S1470-2045(09)70311-0 . PMID 19897418 .
- Calais, Gilles; Bardet, Etienne; Vater, Christian; Alfonsi, Marc; Bourhis, Jean; Rhein, Beatrix; Tortochaux, Jacques; Mann, Yooye Tao Kong; Auvray, Hugues; Garaud, Pascal (Januar 2004). "Strahlentherapie mit gleichzeitiger wöchentlicher Docetaxel für Stadien III/IV Oropharynx-Karzinom. Ergebnisse der 98-02 GORTEC Phase-II-Studie". Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 58 (1): 161–166. doi : 10.1016/S0360-3016(03)01370-1 . PMID 14697434 .
- Chen, AllenM; Felix, Carol; Wang, Pin-Chieh; et al. (Juni 2017). „Dosisreduzierte Strahlentherapie für humanes Papillomavirus-assoziiertes Plattenepithelkarzinom des Oropharynx: eine einarmige Phase-2-Studie“ . The Lancet Oncology (Eingereichtes Manuskript). 18 (6): 803–811. doi : 10.1016/S1470-2045(17)30246-2 . PMC 6488353 . PMID 28434660 .
- Chera, Bhishamjit S.; Amdur, Robert J.; Tepper, Joel; et al. (Dezember 2015). „Phase-2-Studie der de-intensivierten Chemoradiation-Therapie für günstiges humanes Papillomavirus-assoziiertes oropharyngeales Plattenepithelkarzinom“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 93 (5): 976–985. doi : 10.1016/j.ijrobp.2015.08.033 . PMID 26581135 .
- Cmelak, Anthony J.; Li, Sigui; Goldwasser, Meredith A.; Murphy, Barbara; Kanone, Michael; Pinto, Harlan; Rosenthal, David I.; Gilison, Maura; Forastiere, Arlene A. (September 2007). „Phase-II-Studie zur Chemoradiation zur Organerhaltung bei resektablen Plattenepithelkarzinomen des Larynx oder Oropharynx im Stadium III oder IV: Ergebnisse der Eastern Cooperative Oncology Group Study E2399“. Zeitschrift für klinische Onkologie . 25 (25): 3971–3977. doi : 10.1200/JCO.2007.10.8951 . PMID 17761982 .
- Cohen, E.E.; Karrison, TG; Kocherginsky, M; et al. (1. September 2014). "Randomisierte Phase-III-Studie zur Induktionschemotherapie bei Patienten mit lokal fortgeschrittenem Kopf- und Halskrebs N2 oder N3" . Zeitschrift für klinische Onkologie . 32 (25): 2735–43. doi : 10.1200/JCO.2013.54.6309 . PMC 4876357 . PMID 25049329 .
- Cooper, Jay S.; Pajak, Thomas F.; Forastiere, Arlene A.; et al. (6. Mai 2004). „Postoperative gleichzeitige Strahlentherapie und Chemotherapie für Hochrisiko-Plattenepithelkarzinom des Kopfes und Halses“. New England Journal of Medicine . 350 (19): 1937–1944. doi : 10.1056/NEJMoa032646 . PMID 15128893 .
- Cooper, Jay S.; Zhang, Qiang; Pajak, Thomas F.; et al. (Dezember 2012). „Langzeit-Follow-up der RTOG 9501/Intergroup-Phase-III-Studie: Postoperative gleichzeitige Strahlentherapie und Chemotherapie bei Hochrisiko-Plattenepithelkarzinomen des Kopf-Hals-Bereichs“ . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 84 (5): 1198–1205. doi : 10.1016/j.ijrobp.2012.05.008 . PMC 3465463 . PMID 22749632 .
- Diaz, Roberto; Jaboin, Jerry J.; Morales-Paliza, Manuel; et al. (Juni 2010). „Hypothyreose als Folge einer intensitätsmodulierten Strahlentherapie mit gleichzeitiger Taxan-basierter Chemotherapie bei lokal fortgeschrittenem Kopf-Hals-Krebs“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 77 (2): 468–476. doi : 10.1016/j.ijrobp.2009.05.018 . PMID 19577867 .
- Eisbruch, Avraham; Schwartz, Marco; Rasch, Coen; Vineberg, Karen; Damen, Eugen; Van As, Corina J.; Sumpf, Robin; Pameijer, Frank A.; Balsam, Alfons JM (Dezember 2004). "Dysphagie und Aspiration nach Radiochemotherapie bei Kopf-Hals-Tumoren: Welche anatomischen Strukturen sind betroffen und können diese durch die IMRT geschont werden?". Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 60 (5): 1425–1439. doi : 10.1016/j.ijrobp.2004.05.050 . PMID 15590174 .
- Eriksen, JG; Lassen, P.; Overgaard, J. (2010). "Profitieren alle Patienten mit Kopf-Hals-Tumoren von einer Strahlentherapie und gleichzeitiger Gabe von Cetuximab?". Die Lancet-Onkologie . 11 (4): 312–313. doi : 10.1016/S1470-2045(10)70035-8 . PMID 20359659 .
- Givens, Daniel J.; Karnell, Lucy Hynds; Gupta, Anjali K.; Clamon, Gerald H.; Pagedar, Nitin A.; Chang, Kristi E.; Van Daele, Douglas J.; Funk, Gerry F. (21. Dezember 2009). „Unerwünschte Ereignisse im Zusammenhang mit gleichzeitiger Radiochemotherapie bei Patienten mit Kopf-Hals-Krebs“ . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 135 (12): 1209–17. doi : 10.1001 / archoto.2009.174 . PMID 20026818 .
- Haddad, R; O'Neill, A; Rabinowits, G; et al. (März 2013). "Induktionschemotherapie gefolgt von gleichzeitiger Radiochemotherapie (sequentielle Radiochemotherapie) im Vergleich zu gleichzeitiger Radiochemotherapie allein bei lokal fortgeschrittenem Kopf-Hals-Karzinom (PARADIGM): eine randomisierte Phase-3-Studie". Die Lancet-Onkologie . 14 (3): 257–64. doi : 10.1016/S1470-2045(13)70011-1 . PMID 23414589 .
- Halle, SF; Irisch, JC; Gregg, RW; Groome, PA; Rohland, S. (8. Januar 2015). "Einhaltung und Übernahme von Leitlinien für die klinische Praxis: Lehren aus einer Leitlinie für die klinische Praxis zur Chemotherapie als Begleittherapie mit Strahlentherapie bei Kopf-Hals-Tumoren" . Aktuelle Onkologie . 22 (2): e61–8. doi : 10.3747/co.22.2235 . PMC 4399625 . PMID 25908922 .
- Halle, Stephen F; Liu, Fei-Fei; O'Sullivan, Brian; Shi, Willa; Rohland, Susan; Griffiths, Rebecca; Groome, Patti (22. August 2017). „Hat die gleichzeitige Chemotherapie zur konventionellen Strahlentherapie das Überleben von Patienten mit HPV+ve und HPV−ve Oropharynxkarzinom verbessert? Eine bevölkerungsbezogene Studie“ . Britisches Journal für Krebs . 117 (8): 1105–1112. doi : 10.1038/bjc.2017.275 . PMC 5674099 . PMID 28829763 .
- Jäger, Klaudia U.; Schipper, Matthäus; Feng, Felix Y.; Lyden, Teresa; Haxer, Mark; Murdoch-Kinch, Carol-Anne; Cornwall, Benjamin; Lee, Connie SY; Chepeha, Douglas B.; Eisbruch, Avraham (März 2013). "Toxizitäten, die die Lebensqualität nach Chemo-IMRT von Oropharynxkarzinom beeinträchtigen: Prospektive Studie zu patientenberichteten, von Beobachtern bewerteten und objektiven Ergebnissen" . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 85 (4): 935–940. doi : 10.1016/j.ijrobp.2012.08.030 . PMC 3556374 . PMID 23040224 .
- Machtay, Mitchell; Moughan, Jennifer; Trotti, Andrew; Garten, Adam S.; Weber, RandalS.; Cooper, Jay S.; Forastiere, Arlene; Ang, K. Kian (20. Juli 2008). „Faktoren, die mit schwerer Spättoxizität nach gleichzeitiger Radiochemotherapie bei lokal fortgeschrittenem Kopf- und Halskrebs verbunden sind: Eine RTOG-Analyse“ . Zeitschrift für klinische Onkologie . 26 (21): 3582–3589. doi : 10.1200/JCO.2007.14.8841 . PMC 4911537 . PMID 18559875 .
- Marur, Shanthi; Li, Shuli; Cmelak, Anthony J.; et al. (10. Februar 2017). „E1308: Phase-II-Studie zur Induktionschemotherapie gefolgt von reduzierter Strahlendosis und wöchentlichem Cetuximab bei Patienten mit HPV-assoziiertem resektablen Plattenepithelkarzinom des Oropharynx – ECOG-ACRIN Cancer Research Group“ . Zeitschrift für klinische Onkologie . 35 (5): 490–497. doi : 10.1200/JCO.2016.68.3300 . PMC 5455313 . PMID 28029303 .
- Nguyen-Tan, Phuc Felix; Zhang, Qiang; Ang, K. Kian; et al. (Dezember 2014). "Randomisierte Phase-III-Studie zum Testen der beschleunigten gegenüber der Standardfraktionierung in Kombination mit gleichzeitigem Cisplatin für Kopf-Hals-Karzinome in der Strahlentherapie-Onkologie-Gruppe 0129-Studie: Langzeitbericht über Wirksamkeit und Toxizität" . Zeitschrift für klinische Onkologie . 32 (34): 3858–3867. doi : 10.1200/JCO.2014.55.3925 . PMC 4239304 . PMID 25366680 .
- Olson, Brennan; Clayburgh, Daniel R. (30. August 2017). Nützlichkeit einer adjuvanten Therapie für pN1-Oropharynxkarzinom . Vorträge. Jahrestagung der American Academy of Otolaryngology, Chicago, 10.–13. September 2017. HNO-Chirurgie – Kopf- und Halschirurgie . 157 (1 Nachschub). S. S. 40–S.173. doi : 10.1177/0194599817717251d . PMID 28854010 .
- Owadally, Waheeda; Verletzt, Chris; Timmins, Hayley; et al. (27.08.2015). „PATHOS: eine Phase-II/III-Studie zur risikostratifizierten adjuvanten Behandlung mit reduzierter Intensität bei Patienten, die sich einer transoralen Operation bei humanem Papillomavirus (HPV)-positivem Oropharynxkarzinom unterziehen“ . BMC-Krebs . 15 (1): 602. doi : 10.1186/s12885-015-1598-x . PMC 4549836 . PMID 26311526 .
- Pignon, Jean-Pierre; le Maître, Aurélie; Bourhis, Jean (Oktober 2007). „Meta-Analysen der Chemotherapie bei Kopf-Hals-Krebs (MACH-NC): Ein Update“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 69 (2): S112–S114. doi : 10.1016/j.ijrobp.2007.04.088 . PMID 17848275 .
- Posner, MR; Lorch, JH; Goloubeva, O.; Tan, M.; Schumaker, LM; Sarlis, NJ; Haddad, RI; Cullen, KJ (Mai 2011). "Überleben und humanes Papillomavirus bei Oropharynx-Krebs in TAX 324: eine Untergruppenanalyse aus einer internationalen Phase-III-Studie" . Annalen der Onkologie . 22 (5): 1071–1077. doi : 10.1093/annonc/mdr006 . PMC 4351352 . PMID 21317223 .
- Seiwert, T.; Melotek, JM; Foster, CC; Blair, EA; Karrison, TG; Agrawal, N.; Portugal, L.; Gooi, Z.; Stenson, KM; Brisson, RJ; Arshad, S.; Dekker, A.; Kochanny, S.; Saloura, V.; Spiotto, MT; Villaflor, VM; Haraf, DJ; Vokes, EE (April 2018). „OPTIMA – Eine Phase-2-Studie zur Dosis- und Volumendeeskalation der Induktions-Chemotherapie-Response-stratifizierten Strahlentherapie bei HPV+ Oropharynxkarzinom: Wirksamkeit, Toxizität und HPV-Subtyp-Analyse“ . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 100 (5): 1309. doi : 10.1016/j.ijrobp.2017.12.025 .
- Su, William; Liu, Jerry; Miles, Brett A.; Genden, Eric M.; Misiukiewicz, Krzysztof J.; Posner, Marshall; Gupta, Vishal; Bakst, Richard L.; Chu, Pei-Yi (8. Dezember 2016). "Adjuvante Strahlentherapie allein für HPV-assoziierte Oropharynxkarzinome mit Hochrisikomerkmalen" . PLOS One . 11 (12): e0168061. Bibcode : 2016PLoSO..1168061S . doi : 10.1371/journal.pone.0168061 . PMC 5145232 . PMID 27930732 .
- Szturz, Petr; Seiwert, Tanguy Y.; Vermorken, Jan B. (10. Juli 2017). "Wie Standard ist Cetuximab in der Zweitlinientherapie bei rezidivierendem oder metastasiertem Kopf- und Halskrebs im Jahr 2017?". Zeitschrift für klinische Onkologie . 35 (20): 2229–2231. doi : 10.1200/JCO.2016.71.8072 . PMID 28471725 .
- Vlacich, Gregory; Spratt, Daniel E.; Diaz, Roberto; Phillips, John G.; Krass, Jostin; Li, Chung-I; Schyr, Yu; Cmelak, Anthony J. (März 2014). „Dosis des unteren pharyngealen Konstriktors prognostiziert eine verlängerte Abhängigkeit von der Gastrostomie bei gleichzeitiger intensitätsmodulierter Strahlentherapie und Chemotherapie bei lokal fortgeschrittenem Kopf-Hals-Karzinom“. Strahlentherapie und Onkologie . 110 (3): 435–440. doi : 10.1016/j.radonc.2013.12.007 . PMID 24440043 .
- Wirth, Lori J. (20. April 2016). „Cetuximab in Human Papillomavirus? Positive Oropharynx-Karzinom“. Zeitschrift für klinische Onkologie . 34 (12): 1289-1291. doi : 10.1200/JCO.2015.65.1414 . PMID 26884569 .
Deintensivierung
- An, Yi; Holsinger, F. Christopher; Husain, Zain A. (20. Dezember 2016). „De-Intensivierung der adjuvanten Therapie bei humanem Papillomavirus-assoziiertem Oropharynxkarzinom“ . Krebserkrankungen des Kopfes und des Halses (Rezension). 1 (1): 18. doi : 10.1186/s41199-016-0016-7 . PMC 6460758 . PMID 31093347 .
- Arnaoutakis, Demetri; Sumer, Baran D. (10. August 2017). „Behandlungsdetensivierung für humanen Papillomavirus-assoziierten oropharyngealen Krebs“ . Annalen der chirurgischen Onkologie . 24 (12): 3463–3465. doi : 10.1245/s10434-017-6045-6 . PMID 28799138 .
- Brotherston, Drew C.; Poon, Ian; Le, Tuyen; Leung, Martin; Kuss, Alex; Ringash, Jolie; Balogh, Judith; Lee, Justin; Wright, James R. (Februar 2013). "Patientenpräferenzen für eine Deeskalation der Behandlung von Oropharynx-Krebs" . Kopf & Hals . 35 (2): 151–159. doi : 10.1002/hed.22930 . PMID 22431201 . S2CID 30301638 .
- Chera, Bhishamjit S.; Amdur, Robert J. (Januar 2018). „Aktueller Status und zukünftige Richtungen der Behandlung Deinensification in Human Papilloma Virus-assoziierten oropharyngealen Plattenepithelkarzinomen“. Seminare in Radioonkologie . 28 (1): 27–34. doi : 10.1016/j.semradonc.2017.08.001 . PMID 29173753 .
- Kelly, Jacqueline R.; Husain, Zain A.; Burtness, Barbara (November 2016). „Strategien zur De-Intensivierung der Behandlung von Kopf-Hals-Krebs“ . Europäische Zeitschrift für Krebs . 68 : 125–133. doi : 10.1016/j.ejca.2016.09.06 . PMC 5734050 . PMID 27755996 .
- Ma, DJ; Preis, K.; Moore, EJ; Patel, SH; Hinni, ML; Chintakuntlawar, AV; Garcia, JJ; Graner, D.; Neben-Wittich, MA; Garces, Y.; Hallemeier, CL; Preis, DL; Kasperbauer, JL; Janus, JR; Foster, NR; Foote, RL (Dezember 2017). "Zwei-Jahres-Ergebnisse für MC1273, eine Phase-2-Evaluierung der aggressiven Dosisdeeskalation für die adjuvante Chemoradiation bei HPV + Oropharynx-Plattenepithelkarzinom (OPSCC)". Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 99 (5): 1320. doi : 10.1016/j.ijrobp.2017.09.021 .
- Masterson, L; Moualed, D; Liu, ZW; et al. (Oktober 2014). „Deeskalationsbehandlungsprotokolle für humanes Papillomavirus-assoziiertes oropharyngeales Plattenepithelkarzinom: eine systematische Überprüfung und Metaanalyse aktueller klinischer Studien“. Europäische Zeitschrift für Krebs . 50 (15): 2636–48. doi : 10.1016/j.ejca.2014.07.001 . PMID 25091798 .
- Mirghani, H.; Amen, F.; Blanchard, P.; Moreau, F.; Guigay, J.; Hartl, DM; Lacau St. Guily, J. (April 2015). "Deeskalation der Behandlung bei HPV-positivem Oropharynxkarzinom: Laufende Studien, kritische Fragen und Perspektiven" . Internationale Zeitschrift für Krebs . 136 (7): 1494–1503. doi : 10.1002/ijc.28847 . PMID 24622970 . S2CID 21854274 .
- Mirghani, Haitham; Blanchard, Pierre (Januar 2018). "Deeskalation der Behandlung bei HPV-induziertem Oropharynxkarzinom: Wo stehen wir?" . Klinische und translationale Radioonkologie . 8 : 4–11. doi : 10.1016/j.ctro.2017.10.005 . PMC 5862680 . PMID 29594236 .
- Quon, Harry; Richmon, Jeremy D. (August 2012). „Behandlungs Deintensification Strategien für HPV-assoziierte Kopf-Hals-Karzinome“. HNO-Kliniken in Nordamerika . 45 (4): 845–861. doi : 10.1016/j.otc.2012.04.007 . PMID 22793856 .
Prognose
- Al-Mamgani, Abrahim; van Werkhoven, Erik; Navran, Arash; Karakullukcu, Baris; Hamming-Vrieze, Olga; Machiels, Melanie; van der Velden, Lilly-Ann; Vogel, Wouter V.; Klop, W. Martin (September 2017). „Kontralaterales regionales Rezidiv nach elektiver einseitiger Halsbestrahlung bei Oropharynxkarzinom: Eine literaturbasierte kritische Überprüfung“. Krebsbehandlung Bewertungen . 59 : 102–108. doi : 10.1016/j.ctrv.2017.07.004 . PMID 28779635 .
- Ang, KK; Harris, J.; Wheeler, R.; et al. (2010). „Humanes Papillomavirus und das Überleben von Patienten mit Oropharynxkarzinom“ . New England Journal of Medicine . 363 (1): 24–35. doi : 10.1056/NEJMoa0912217 . PMC 2943767 . PMID 20530316 .
- Bhattasali, O.; Thompson, LD; Schumacher, A.; Iganej, S. (April 2018). "Nodale radiologische prognostische Faktoren beim neuen p16-positiven Oropharynxkarzinom des neuen Stadiums I der 8. Ausgabe des AJCC: Ist alle N1-Krankheit gleich?" . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 99 (2): S137. doi : 10.1016/j.ijrobp.2017.06.317 .
- Chernock, RD; El-mofty, SK; Thorstad, WL; Parvin, CA; Lewis, JS (2009). "HPV-bezogenes nicht keratinisierendes Plattenepithelkarzinom des Oropharynx: Nützlichkeit mikroskopischer Merkmale bei der Vorhersage des Patientenergebnisses" . Kopf-Hals-Pathologie . 3 (3): 186–194. doi : 10.1007/s12105-009-0126-1 . PMC 2811624 . PMID 20596971 .
- Fachry, Carole; Zhang, Qiang; Nguyen-Tân, Phuc Felix; et al. (4. August 2017). „Entwicklung und Validierung von Nomogrammen, die das allgemeine und progressionsfreie Überleben bei Patienten mit Oropharynxkarzinom vorhersagen“ . Zeitschrift für klinische Onkologie . 35 (36): 4057–4065. doi : 10.1200/JCO.2016.72.0748 . PMC 5736236 . PMID 28777690 .
- Fischer, CA; Kampmann, M.; Zlobec, I.; Grün, E.; Tornillo, L.; Lugli, A.; Wolfensberger, M.; Terracciano, LM (27. April 2010). "p16-Expression bei Oropharynxkarzinom: ihr Einfluss auf das Staging und die Prognose im Vergleich zu den konventionellen klinischen Staging-Parametern" (PDF) . Annalen der Onkologie . 21 (10): 1961–1966. doi : 10.1093/annonc/mdq210 . PMID 20423915 .
- Gillison, Maura L. (20. Dezember 2006). „Humanes Papillomavirus und Prognose von oropharyngealen Plattenepithelkarzinomen: Implikationen für die klinische Forschung bei Kopf- und Halskrebs“. Zeitschrift für klinische Onkologie (Editorial). 24 (36): 5623–5625. doi : 10.1200/JCO.2006.07.1829 . PMID 17179099 .
- Gilison, Maura L.; Zhang, Qiang; Jordan, Richard; Xiao, Weihong; Westra, William H.; Trotti, Andy; Spencer, Sharon; Harris, Jonathan; Chung, Christine H.; Ang, K. Kian (10. Juni 2012). „Tabakrauchen und erhöhtes Sterbe- und Progressionsrisiko für Patienten mit p16-positivem und p16-negativem Oropharynxkarzinom“ . Zeitschrift für klinische Onkologie . 30 (17): 2102–2111. doi : 10.1200/JCO.2011.38.4099 . PMC 3397696 . PMID 22565003 .
- Hafkamp, Harriët C.; Manni, JJ; Haesevoets, A.; Voogd, AC; Schepers, M.; Bot, FJ; Hopman, AHN; Ramaekers, FCS; Speel, Ernst-Jan M. (15. Juni 2008). "Deutliche Unterschiede in der Überlebensrate zwischen Rauchern und Nichtrauchern mit HPV-16-assoziierten Mandelkarzinomen" . Internationale Zeitschrift für Krebs . 122 (12): 2656–2664. doi : 10.1002/ijc.23458 . PMID 18360824 . S2CID 25320075 .
- Haughey, Bruce H.; Sinha, Parul (September 2012). „Prognostische Faktoren und Überleben einzigartig für chirurgisch behandelten p16+ Oropharynxkarzinom“. Das Laryngoskop . 122 (S2): S13–S33. doi : 10.1002/lary.23493 . PMID 22926949 . S2CID 31772853 .
- Huang, Shao Hui; Waldron, John N.; Milosevic, Michael; et al. (15. Februar 2015). „Prognostischer Wert von zirkulierenden Neutrophilen, Monozyten und Lymphozyten vor der Behandlung bei Oropharynxkarzinom, stratifiziert nach humanem Papillomavirus-Status“ . Krebs . 121 (4): 545–555. doi : 10.1002/cncr.29100 . PMID 25336438 . S2CID 926930 .
- Huang, K.; Banerjee, RN; Debenham, B.; Patel, A.; Sabiq, F.; Harold, L.; Skarsgard, DP; Lysack, J.; Ghosh, S.; Quon, HC (April 2018). "Was ist los mit verfilzten Knoten? Bedeutung von verfilzten Lymphknoten bei HPV-bezogenen oropharyngealen Plattenepithelkarzinomen: Eine multi-institutionelle populationsbasierte Kohortenstudie" . Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 100 (5): 1328. doi : 10.1016/j.ijrobp.2017.12.059 .
- de Jong, MC; Pramana, J.; Knegjens, JL; Balsam, AJM; Van Den Brekel, MWM; Hauptmann, M.; Begg, AC; Rasch, CRN (24. März 2010). "HPV- und Hochrisiko-Genexpressionsprofile sagen unabhängig von klinischen Faktoren das Ansprechen auf eine Radiochemotherapie bei Kopf- und Halskrebs voraus." Strahlentherapie und Onkologie . 95 (3): 365–370. doi : 10.1016/j.radonc.2010.02.001 . ISSN 1879-0887 . PMID 20346528 .
- Kato, Masanari G.; Ellis, Mark A.; Nguyen, Shaun A.; Day, Terry A. (Februar 2018). „Prädiktoren der kontralateralen-bilateralen Knotenerkrankung bei Oropharynxkarzinom: Eine nationale Krebsdatenbankstudie“. Kopf & Hals . 40 (2): 338–348. doi : 10.1002/hed.24964 . PMID 28963823 . S2CID 10627950 .
- Lewis, James S; Zimmermann, Danielle H; Thorstad, Wade L; Zhang, Qin; Haughey, Bruce H (24. Juni 2011). "Extrakapsuläre Extension ist ein schlechter Prädiktor für das Wiederauftreten der Krankheit bei chirurgisch behandelten oropharyngealen Plattenepithelkarzinomen" . Moderne Pathologie . 24 (11): 1413–1420. doi : 10.1038/modpathol.2011.105 . PMC 3925389 . PMID 21701534 .
- Licitra, Lisa; Perrone, Federica; Bossi, Paolo; et al. (20. Dezember 2006). „Humanes Papillomavirus mit hohem Risiko beeinflusst die Prognose bei Patienten mit chirurgisch behandeltem oropharyngealen Plattenepithelkarzinom“. Zeitschrift für klinische Onkologie . 24 (36): 5630–5636. doi : 10.1200/JCO.2005.04.6136 . PMID 17179101 .
- Löwy, D.; Munger, K. (2010). „Prognostische Auswirkungen von HPV bei Oropharynxkarzinom“ . Das New England Journal of Medicine (Editorial). 363 (1): 82–84. doi : 10.1056/NEJMe1003607 . PMID 20530315 .
- Martel, Maria; Alemany, Laia; Taberna, Miren; Mena, Marisa; Tous, Sara; Bagué, Silvia; Castellsagué, Xavier; Quer, Miquel; Leon, Xavier (Januar 2017). „Die Rolle von HPV auf das Risiko einer zweiten primären Neoplasie bei Patienten mit Oropharynxkarzinom“. Orale Onkologie . 64 : 37–43. doi : 10.1016/j.oraloncology.2016.11.011 . PMID 28024722 .
- Maxwell, JH; Kumar, B.; Feng, FY; et al. (9. Februar 2010). „Tabakkonsum bei Patienten mit humanem Papillomavirus-positivem fortgeschrittenem Oropharynx-Krebs im Zusammenhang mit einem erhöhten Risiko für Fernmetastasen und Tumorrezidive“ . Klinische Krebsforschung . 16 (4): 1226–1235. doi : 10.1158/1078-0432.CCR-09-2350 . PMC 2822887 . PMID 20145161 .
- Maxwell, Jessica H.; Ferris, Robert L.; Gooding, William; Cunningham, Diana; Mehta, Vikas; Kim, Seungwon; Myers, Eugene N.; Johnson, Jonas; Chiosea, Simion (September 2013). „Extrakapsuläre Ausbreitung bei Kopf-Hals-Karzinom: Einfluss der Stelle und des humanen Papillomavirus-Status“. Krebs . 119 (18): 3302–3308. CiteSeerX 10.1.1.663.564 . doi : 10.1002/cncr.28169 . PMID 23797868 . S2CID 32595866 .
- Nguyen, Nam P.; Ly, Bevan Hong; Betz, Michael; Vinh-Hung, Vincent (18. Juni 2010). „Die Bedeutung des Alters als prognostischer Faktor für Tonsillenkarzinom“. Annalen der chirurgischen Onkologie . 17 (10): 2570–2577. doi : 10.1245/s10434-010-1167-0 . PMID 20559738 . S2CID 8833627 .
- O'Sullivan, Brian; Huang, Shao Hui; Siu, Lillian L.; et al. (10. Februar 2013). „Deintensifizierungskandidaten-Untergruppen bei humanem Papillomavirus-Related Oropharyngeal Cancer nach minimalem Risiko von Fernmetastasen“. Zeitschrift für klinische Onkologie . 31 (5): 543–550. doi : 10.1200/JCO.2012.44.0164 . PMID 23295795 .
- Ragin, Camille CR; Taioli, Emanuela (15. Oktober 2007). "Überleben von Plattenepithelkarzinomen des Kopfes und Halses in Bezug auf eine Infektion mit dem humanen Papillomavirus: Überprüfung und Metaanalyse" . Internationale Zeitschrift für Krebs . 121 (8): 1813-1820. doi : 10.1002/ijc.22851 . PMID 17546592 . S2CID 23657353 .
- Rischin, Danny; Jung, Richard J.; Fischer, Richard; et al. (20.09.2010). "Prognostische Bedeutung von p16INK4A und humanem Papillomavirus bei Patienten mit Oropharynxkarzinom, die in der Phase-III-Studie TROG 02.02 behandelt wurden" . Zeitschrift für klinische Onkologie . 28 (27): 4142–4148. doi : 10.1200/JCO.2010.29.2904 . PMC 2953971 . PMID 20697079 .
- Routman, David M.; Funk, Ryan K.; Tangsriwong, Kanograt; et al. (Juni 2017). „Rückfallraten bei alleiniger Operation beim Humanen Papillomavirus – Related Intermediate- und High-Risk Group Oropharynx Plattenepithelkarzinom: Eine Multi-Institutional Review“. Internationale Zeitschrift für Radioonkologie, Biologie, Physik . 99 (4): 938–946. doi : 10.1016/j.ijrobp.2017.06.2453 . PMID 28847412 .
- Sinha, Parul; Lewis, James S.; Piccirillo, Jay F.; Kallogjeri, Dorina; Haughey, Bruce H. (15. Juli 2012). „Extrakapsuläre Ausbreitung und adjuvante Therapie beim humanen Papillomavirus-bezogenen, p16-positiven Oropharynxkarzinom“. Krebs . 118 (14): 3519–3530. doi : 10.1002/cncr.26671 . PMID 22086669 . S2CID 28111538 .
- Sinha, P.; Thorstad, WT; Nussenbaum, B.; Haughey, BH; Adkins, DR; Kallogjeri, D.; Lewis Jr., JS (Januar 2014). "Fernmetastasen in p16-positiven oropharyngealen Plattenepithelkarzinomen: Eine kritische Analyse von Mustern und Ergebnissen" . Orale Onkologie . 50 (1): 45–51. doi : 10.1016/j.oraloncology.2013.10.007 . PMC 3942323 . PMID 24211084 .
- Sinha, Parul; Kallogjeri, Dorina; Schwul, Hiram; Thorstad, Wade L.; Lewis, James S.; Chernock, Rebecca; Nussenbaum, Brian; Haughey, Bruce H. (Mai 2015). „Hohe Anzahl metastatischer Knoten, nicht extrakapsuläre Ausbreitung oder N-Klassifikation, ist ein knotenbezogener Prognostiker bei transoral reseziertem, neck-seziertem p16-positivem Oropharynxkarzinom“. Orale Onkologie . 51 (5): 514–520. doi : 10.1016/j.oraloncology.2015.02.098 . PMID 25771076 .
- Trosman, Samuel J.; Koyfman, Shlomo A.; Ward, Matthew C.; et al. (1. Mai 2015). "Wirkung des Humanen Papillomavirus auf Muster von Fernmetastasen bei oropharyngealen Plattenepithelkarzinomen, die mit Radiochemotherapie behandelt werden" . JAMA HNO-Chirurgie – Kopf-Hals-Chirurgie . 141 (5): 457–62. doi : 10.1001/jamaoto.2015.136 . PMID 25742025 .
- Ward, MJ; Thirdborough, SM; Mellows, T; et al. (29. Oktober 2013). „Tumor-infiltrierende Lymphozyten sagen das Ergebnis bei HPV-positivem Oropharynxkarzinom voraus“ . Britisches Journal für Krebs . 110 (2): 489–500. doi : 10.1038/bjc.2013.639 . PMC 3899750 . PMID 24169344 .
Epidemiologie
- Anantharaman, Devasena; Müller, David C; Lagiou, Pagona; et al. (Juni 2016). „Kombinierte Wirkungen von Rauchen und HPV16 bei Oropharynxkarzinom“ . Internationale Zeitschrift für Epidemiologie . 45 (3): 752–761. doi : 10.1093/ije/dyw069 . PMC 5841602 . PMID 27197530 .
- Chaturvedi, A.; Engels, E.; Anderson, W.; Gillison, M. (Februar 2008). „Inzidenztrends für humane Papillomavirus-verwandte und -nicht verwandte orale Plattenepithelkarzinome in den Vereinigten Staaten“. Zeitschrift für klinische Onkologie . 26 (4): 612–619. doi : 10.1200/JCO.2007.14.1713 . PMID 18235120 .
- Chaturvedi, Anil K.; Engels, Eric A.; Pfeiffer, Ruth M.; et al. (10. November 2011). "Humanes Papillomavirus und steigende Oropharynx-Krebsinzidenz in den Vereinigten Staaten" . Zeitschrift für klinische Onkologie . 29 (32): 4294–4301. doi : 10.1200/JCO.2011.36.4596 . PMC 3221528 . PMID 21969503 .
- Chaturvedi, Anil K.; Anderson, William F.; Lortet-Tieulent, Joannie; Curado, Maria Paula; Ferlay, Jacques; Franceschi, Silvia; Rosenberg, Philip S.; Bray, Freddie; Gillison, Maura L. (20. Dezember 2013). "Weltweite Trends in Inzidenzraten für Mundhöhlen- und Oropharynxkarzinome" . Zeitschrift für klinische Onkologie . 31 (36): 4550–4559. doi : 10.1200/JCO.2013.50.3870 . PMC 3865341 . PMID 24248688 .
- Chenevert, J; Chiosea, S (Januar 2012). "Inzidenz des humanen Papillomavirus in oropharyngealen Plattenepithelkarzinomen: jetzt und vor 50 Jahren". Pathologie des Menschen . 43 (1): 17–22. doi : 10.1016/j.humpath.2011.03.009 . PMID 21777945 .
- Koch, M.; Dawsey, S.; Freedman, N.; Inskip, P.; Wichner, S.; Quraishi, S.; Devesa, S.; McGlynn, K. (2009). „Geschlechtsunterschiede bei der Krebsinzidenz nach Zeitraum und Alter“ . Krebsepidemiologie, Biomarker & Prävention . 18 (4): 1174–1182. doi : 10.1158/1055-9965.EPI-08-1118 . PMC 2793271 . PMID 19293308 .
- Dayyani, Farshid; Etzel, CarolJ; Liu, Mei; Ho, Chung-Han; Lippman, Scott M; Tsao, Anne S. (2010). „Meta-Analyse der Auswirkungen des humanen Papillomavirus (HPV) auf das Krebsrisiko und das Gesamtüberleben bei Plattenepithelkarzinomen des Kopf-Hals-Bereichs (HNSCC)“ . Onkologie im Kopf-Hals-Bereich . 2 (1): 15. doi : 10.1186/1758-3284-2-15 . PMC 2908081 . PMID 20587061 .
- D'Souza, G.; Kreimer, A.; Viscidi, R.; Pawlita, M.; Fachry, C.; Koch, W.; Westra, W.; Gillison, M. (Mai 2007). "Fall-Kontroll-Studie von humanem Papillomavirus und oropharyngealen Krebs" . Das New England Journal of Medicine . 356 (19): 1944–1956. doi : 10.1056/NEJMoa065497 . ISSN 0028-4793 . PMID 17494927 . S2CID 18819678 .
- de Martel, Catherine; Ferlay, Jacques; Franceschi, Silvia; Vignat, Jérôme; Bray, Freddie; Forman, David; Plummer, Martyn (Juni 2012). „Globale Krebsbelastung aufgrund von Infektionen im Jahr 2008: eine Überprüfung und synthetische Analyse“. Die Lancet-Onkologie . 13 (6): 607–615. doi : 10.1016/S1470-2045(12)70137-7 . PMID 22575588 .
- de Martel, Catherine; Plummer, Martyn; Vignat, Hieronymus; Franceschi, Silvia (15. August 2017). "Weltweite Krebsbelastung durch HPV nach Standort, Land und HPV-Typ" . Internationale Zeitschrift für Krebs . 141 (4): 664–670. doi : 10.1002/ijc.30716 . PMC 5520228 . PMID 28369882 .
- Ernster, J.; Sciotto, C.; O'Brien, M.; Finch, J.; Robinson, L.; Willson, T.; Mathews, M. (Dezember 2007). „Zunehmende Inzidenz von Oropharynxkarzinom und die Rolle des onkogenen humanen Papillomavirus“. Das Laryngoskop . 117 (12): 2115–2128. doi : 10.1097/MLG.0b013e31813e5fbb . ISSN 0023-852X . PMID 17891052 . S2CID 38017888 .
- Forman, David; de Martel, Catherine; Lacey, Charles J.; et al. (November 2012). "Globale Belastung des Humanen Papillomavirus und verwandter Krankheiten" . Impfstoff . 30 : F12–F23. doi : 10.1016/j.vaccine.2012.07.055 . PMID 23199955 .
- Gilison, Maura L.; Chaturvedi, Anil K.; Anderson, William F.; Fachry, Carole (10. Oktober 2015). „Epidemiologie des humanen Papillomavirus-positiven Kopf-Hals-Plattenepithelkarzinoms“ . Zeitschrift für klinische Onkologie . 33 (29): 3235–3242. doi : 10.1200/JCO.2015.61.6995 . PMC 4979086 . PMID 26351338 .
- Habbous, Steven; Chu, Karen P.; Lau, Harold; et al. (13.08.2017). "Humanes Papillomavirus bei Oropharynxkarzinom in Kanada: Analyse von 5 umfassenden Krebszentren mit multipler Imputation" . Zeitschrift der kanadischen Ärztekammer . 189 (32): E1030–E1040. doi : 10.1503/cmaj.161379 . PMC 5555753 . PMID 28808115 .
- Hammarstedt, L.; Lindquist, D.; Dahlstrand, H.; et al. (Dezember 2006). „Humanes Papillomavirus als Risikofaktor für die Zunahme der Inzidenz von Mandelkrebs“ . Internationale Zeitschrift für Krebs . 119 (11): 2620–2623. doi : 10.1002/ijc.22177 . ISSN 0020-7136 . PMID 16991119 . S2CID 20541360 .
- Heck, Julia E; Berthiller, Julien; Vaccarella, Salvatore; et al. (Februar 2010). "Sexualverhalten und das Risiko von Kopf- und Halskrebs: eine gepoolte Analyse im Konsortium International Head and Neck Cancer Epidemiology (INHANCE)" . Internationale Zeitschrift für Epidemiologie . 39 (1): 166–181. doi : 10.1093/ije/dyp350 . PMC 2817092 . PMID 20022926 .
- Hemminki, K; Dong, C; Frisch, M. (Dezember 2000). „Tonsillen- und andere Krebserkrankungen des oberen Aerodigestivtraktes bei Gebärmutterhalskrebspatienten und ihren Ehemännern“. Europäische Zeitschrift für Krebsprävention . 9 (6): 433–437. doi : 10.1097/00008469-200012000-00010 . PMID 11201683 . S2CID 10517792 .
- Hong, Angela M.; Grulich, Andrew E.; Jones, Deanna; Lee, C. Bald; Girlande, Suzanne M.; Dobbins, Timothy A.; Clark, Jonathan R.; Harnett, Gerald B.; Milross, Christopher G.; O'Brien, Christopher J.; Rose, Barbara R. (April 2010). „Plattenepithelkarzinom des Oropharynx bei australischen Männern, die durch humane Papillomavirus-Impfstoffziele induziert werden“. Impfstoff . 28 (19): 3269–3272. doi : 10.1016/j.vaccine.2010.02.098 . PMID 20226244 .
- Hong, Angela; Lee, C. Bald; Jones, Deanna; et al. (Mai 2016b). „Steigende Prävalenz von humanem Papillomavirus-assoziiertem Oropharynxkarzinom in Australien in den letzten 2 Jahrzehnten“. Kopf & Hals . 38 (5): 743–750. doi : 10.1002/hed.23942 . PMID 25521312 . S2CID 1974978 .
- Hwang, Tzer-Zen; Hsiao, Jenn-Ren; Tsai, Chia-Rung; Chang, Jeffrey S. (15. Juli 2015). "Inzidenztrends von Kopf- und Halskrebs im Zusammenhang mit dem humanen Papillomavirus in Taiwan, 1995-2009" . Internationale Zeitschrift für Krebs . 137 (2): 395–408. doi : 10.1002/ijc.29330 . PMID 25395239 . S2CID 20551422 .
- Jemal, A.; Siegel, R.; Ward, E.; Hao, Y.; Xu, J.; Murray, T.; Thun, MJ (28. Januar 2008). "Krebsstatistik, 2008" . CA: Ein Krebsjournal für Kliniker . 58 (2): 71–96. doi : 10.3322/CA.2007.0010 . PMID 18287387 . S2CID 43737426 .
- Marur, S.; D'souza, G.; Westra, WH; Forastiere, AA (2010). "HPV-assoziierter Kopf-Hals-Krebs: eine virusbedingte Krebsepidemie" . Die Lancet-Onkologie . 11 (8): 781–789. doi : 10.1016/S1470-2045(10)70017-6 . PMC 5242182 . PMID 20451455 .
- Näsman, A.; Attner, P.; Hammarstedt, L.; et al. (Juli 2009). "Inzidenz von humanem Papillomavirus (HPV)-positivem Mandelkarzinom in Stockholm, Schweden: eine Epidemie von viral induziertem Karzinom?" . Internationale Zeitschrift für Krebs . 125 (2): 362–366. doi : 10.1002/ijc.24339 . PMID 19330833 . S2CID 36268685 .
- Salem, A. (2010). "Ablehnung von Verbindungen zwischen HPV und aggressivem Zungenkrebs bei jungen Patienten" . Annalen der Onkologie . 21 (1): 13–17. doi : 10.1093/annonc/mdp380 . PMID 19825879 .
- Schwartz, SM; Daling, JR; Madeleine, MM; et al. (4. November 1998). „Mundkrebsrisiko in Bezug auf die sexuelle Vorgeschichte und den Nachweis einer humanen Papillomavirus-Infektion“ . JNCI Journal des National Cancer Institute . 90 (21): 1626–1636. doi : 10.1093/jnci/90.21.1626 . PMID 9811312 .
- Siegel, Rebecca; Naishadham, Deepa; Jemal, Ahmedin (Januar 2013). "Krebsstatistik, 2013" . CA: Ein Krebsjournal für Kliniker . 63 (1): 11–30. doi : 10.3322/caac.21166 . PMID 23335087 . S2CID 24926725 .
- Siegel, Rebecca L.; Miller, Kimberly D.; Jemal, Ahmedin (Januar 2015). "Krebsstatistik, 2015" . CA: Ein Krebsjournal für Kliniker . 65 (1): 5–29. doi : 10.3322/caac.21254 . PMID 25559415 . S2CID 10193624 .
- Siegel, Rebecca L.; Miller, Kimberly D.; Jemal, Ahmedin (Januar 2017). "Krebsstatistik, 2017" . CA: Ein Krebsjournal für Kliniker . 67 (1): 7–30. doi : 10.3322/caac.21387 . PMID 28055103 .
- Smith, E.; Ritchie, J.; Summersgill, K.; Klussmann, J.; Lee, J.; Wang, D.; Haugen, T.; Turek, L. (Februar 2004). „Alter, Sexualverhalten und humane Papillomavirus-Infektion in Mundhöhle und Oropharynx-Krebs“. Internationale Zeitschrift für Krebs . 108 (5): 766–772. doi : 10.1002/ijc.11633 . ISSN 0020-7136 . PMID 14696105 . S2CID 25146008 .
- Sturgis, E.; Cinciripini, P. (Okt. 2007). "Trends bei der Inzidenz von Kopf- und Halskrebs im Verhältnis zur Prävalenz des Rauchens: eine aufkommende Epidemie von Krebserkrankungen, die mit dem humanen Papillomavirus in Verbindung stehen?". Krebs . 110 (7): 1429–1435. doi : 10.1002/cncr.22963 . ISSN 0008-543X . PMID 17724670 . S2CID 20189903 .
- Sturgis, EM; Ang, KK (1. Juni 2011). "Die Epidemie des HPV-assoziierten Oropharynxkarzinoms ist da: Ist es an der Zeit, unsere Behandlungsparadigmen zu ändern?". Zeitschrift des nationalen umfassenden Krebsnetzwerks . 9 (6): 665–73. doi : 10.6004/jnccn.2011.0055 . PMID 21636538 .
- Tachezy, R. (Mai 2005). „HPV und andere Risikofaktoren für Mundhöhlen-/Oropharynxkarzinom in der Tschechischen Republik“. Mundkrankheiten . 11 (3): 181–185. doi : 10.1111/j.1601-0825.2005.01112.x . PMID 15888110 .
- Tezal, meins; Sullivan Nasca, Maureen; Stoler, Daniel L.; Melendy, Thomas; Hyland, Andrew; Smaldino, Philip J.; Rigual, Nestor R.; Loree, Thom R. (1. April 2009). "Chronische Parodontitis-Humane Papillomavirus-Synergie in der Basis von Zungenkrebs" . Archiv für Hals-Nasen-Ohren-Heilkunde-Kopf-Hals-Chirurgie . 135 (4): 391–6. doi : 10.1001/archoto.2009.6 . PMID 19380363 .
- Tezal, M.; Sullivan, MA; Hyland, A.; et al. (10.09.2009). „Chronische Parodontitis und das Auftreten von Plattenepithelkarzinomen im Kopf-Hals-Bereich“ . Krebsepidemiologie, Biomarker & Prävention . 18 (9): 2406–2412. doi : 10.1158/1055-9965.EPI-09-0334 . PMID 19745222 .
- Wien, Laura J.; Henley, S. Jane; Watson, Meg; Markowitz, Lauri E.; Thomas, Cheryll C.; Thompson, Trevor D.; Razzaghi, Hilda; Saraiya, Mona (8. Juli 2016). „Humanes Papillomavirus-assoziierte Krebserkrankungen – USA, 2008-2012“ . MMWR. Wöchentlicher Bericht über Morbidität und Mortalität . 65 (26): 661–666. doi : 10.15585/mmwr.mm6526a1 . PMID 27387669 .
Bücher und Tagungsbände
- Bernier , Jacques, Hrsg. (2016). Kopf-Hals-Krebs: Multimodalitätsmanagement . Springer Internationaler Verlag . ISBN 978-3-319-27601-4.
- Brierley, JD; Gospodarowicz, MK; Wittekind, Ch., Hrsg. (2017). TNM-Klassifikation von malignen Tumoren (8. Aufl.). Chichester, West Sussex, Großbritannien: Wiley-Blackwell . ISBN 978-1-4443-3241-4.
- Cardesa, Antonio; Slootweg, Pieter J.; Gale, Nina; Franchi, Alessandro, Hrsg. (2017). Pathologie von Kopf und Hals (2. Aufl.). Springer . ISBN 978-3-662-49672-5.
- Golusiński, Wojciech; Leemans, C. René; Dietz, Andreas, Hrsg. (2017). HPV-Infektion bei Kopf-Hals-Krebs . Aktuelle Ergebnisse in der Krebsforschung. 206 . Springer . ISBN 978-3-319-43580-0.
- DeVita, Vincent T. ; Lawrence, Theodore S.; Rosenberg, Steven A., Hrsg. (2008) [1982]. DeVita, Hellman und Rosenbergs Krebs: Prinzipien und Praxis der Onkologie (8. Aufl.). Philadelphia: Lippincott Williams & Wilkins . ISBN 978-0-7817-7207-5.
- Hayat, MA, Hrsg. (2010). Methoden der Krebsdiagnose, -therapie und -prognose: Band 7 - Allgemeine Übersichten, Kopf- und Halskrebs und Schilddrüsenkrebs . Springer Wissenschaft & Wirtschaftsmedien . ISBN 978-90-481-3186-0.
- Kerr, David J. ; Haller, Daniel G.; van de Velde, Cornelis JH; Baumann, Michael, Hrsg. (2016) [1995]. Oxford Lehrbuch der Onkologie (3. Aufl.). Oxford University Press . ISBN 978-0-19-965610-3.
- Myers, Jeffrey N.; Sturgis, Erich M., Hrsg. (2013). Mundhöhle und oropharyngealer Krebs, eine Ausgabe der HNO-Kliniken, E-Book . Elsevier Gesundheitswissenschaften . ISBN 978-0-323-18632-2.
- Olshan, Andrew F., Hrsg. (2010). Epidemiologie, Pathogenese und Prävention von Kopf-Hals-Krebs . Springer Wissenschaft & Wirtschaftsmedien . ISBN 978-1-4419-1471-2.
- Sobin, LH; Gospodarowicz, MK; Wittekind, Ch., Hrsg. (2010). TNM-Klassifikation maligner Tumoren (7. Aufl.). Chichester, West Sussex, Großbritannien: Wiley-Blackwell . ISBN 978-1-4443-3241-4.
- Standring, Susan , Hrsg. (2015). Gray's Anatomy: Die anatomische Basis der klinischen Praxis (41. Aufl.). Elsevier Gesundheitswissenschaften . ISBN 978-0-7020-6851-5., siehe auch Gray's Anatomy
Kapitel, Monographien, Berichte und Abschlussarbeiten
- Bruni, L; Barrionuevo-Rosas, L; Albero, G; Serrano, B; Mena, M; Gómez, D; Muñoz, J; Bosch, FX; de Sanjosé, S (7. Juli 2017). Humanes Papillomavirus und verwandte Krankheiten in der Welt (PDF) . HPVIC . Abgerufen am 11. August 2017 ., in HPVIC (2017)
- Chaturvedi, Anil; Gillison, Maura L. (2010-03-04). Humanes Papillomavirus und Kopf-Hals-Krebs . S. 87–116. ISBN 978-1-4419-1471-2., in Olshan (2010)
- Chung, Christine H; Dietz, Andreas; Gregor, Vincent; et al. (2016). Kopf- und Halskrebs . S. 329–364. ISBN 9780199656103., in Kerr et al. (2016)
- Hammarstedt, Lalle (25. April 2008), Tonsillenkrebs - Inzidenz, Prävalenz von HPV und Überleben (PhD), Stockholm: Department of Clinical Neuroscience, Karolinska Institutet , ISBN 978-91-7357-587-4, abgerufen am 3. Juni 2017
- McHanwell, Stephen (2015-08-07). Pharynx . S. 571–585. ISBN 9780702068515., in Standring (2015)
- Helliwell, T; Woolgar, JA (1998). Standards und Mindestdatensätze für die Meldung häufiger Krebserkrankungen. Mindestdatensatz für histopathologische Berichte von Kopf und Hals . London: Das Royal College of Pathologists .
- Johnson, Newell; Chaturvedi, Anil (2016). Globale Belastung durch Mundhöhlen- und Rachenkrebs (PDF) (Whitepaper der Konferenz) . Abgerufen am 12. August 2017 ., in GOCF (2016)
- Mehanna, H. "Update on De-Intensification and Intensification Studies in HPV". In Golusiński, Leemans & Dietz (2017) , S. 251–256. . Auszug hier
- Munck-Wikland, Eva; Hammarstedt, Lalle; Dahlstrand, Hanna (2010-04-07). Rolle des Humanen Papillomavirus bei Tonsillenkrebs . S. 271–283. ISBN 9789048131860., in Hayat (2010) ( zusätzlicher Auszug hier )
- IARC-Arbeitsgruppe zur Bewertung karzinogener Risiken für den Menschen (1995). "Humane Papillomaviren" . IARC-Monographien zur Bewertung karzinogener Risiken für den Menschen . 64 : 1–378. PMC 5366848 . PMID 16755705 .
- IARC-Arbeitsgruppe zur Bewertung karzinogener Risiken für den Menschen (2007). "Humane Papillomaviren" . IARC-Monographien zur Bewertung karzinogener Risiken für den Menschen . 90 : 1–636. PMC 4.781.057 . PMID 18354839 .
- IARC-Arbeitsgruppe zur Bewertung karzinogener Risiken für den Menschen (2012). "Humane Papilloviren" . Biologische Wirkstoffe . IARC-Monographien zur Bewertung karzinogener Risiken für den Menschen . 100B . Lyon: Internationale Agentur für Krebsforschung . S. 255–314. ISBN 978-9283213192.
Webseiten
- Bath, Charlotte (25. April 2017). „Die Intensivierung der Behandlung von HPV-positivem Oropharynxkarzinom könnte die Toxizität reduzieren und gleichzeitig die Funktion und das Überleben erhalten“ . ASCO Post (Bericht des multidisziplinären Head & Neck Symposiums 2016). ASCO . Abgerufen am 3. August 2017 .
- Jagd, Jennifer L (21. März 2010). "Molekulare Bewertung von HPV bei Patienten mit Kopf-Hals-Tumoren" (PDF) . Gesellschaft für Molekulare Pathologie . USA und Canadian Academy of Pathology . Archiviert vom Original (PDF) am 16. Juli 2011 . Abgerufen am 30. Mai 2017 .
- "Krebs der Mundhöhle und des Rachens von Subsite" (PDF) . SEER Cancer Statistics Review 1975-2007 . Programm für Überwachung, Epidemiologie und Endergebnisse (SEER). 15.04.2010 . Abgerufen am 3. Juni 2017 .
- "Der Pharynx" . TeachMeAnatomy . Lehre mich. 29.04.2017 . Abgerufen am 20. Juni 2017 .
- Dubner, Sanford (19. Juni 2017). "Kopf-Hals-Krebs - Resektion und Halsdissektion: Relevante Anatomie" . Medscape . WebMD . Abgerufen am 17. Juli 2017 .
- Joshi, ArjunS; Vashishta, Rishi; George, Philip E (18. November 2013). "Anatomie des Pharynx" . Medscape . WebMD . Abgerufen am 20. Juni 2017 .
- "Behandlung von Oropharynxkarzinomen" . Kopf-Hals-Krebs – Patientenversion . Nationale Gesundheitsinstitute - Nationales Krebsinstitut . Dezember 2016 . Abgerufen am 12. Juni 2017 .
- "Oropharyngeal Cancer Treatment (Adult) (PDQ®): Health Professional Version" . Oropharyngeale Krebsbehandlung (Erwachsene) (PDQ®) . Kopf-Hals-Krebs. Version für medizinisches Fachpersonal . Nationale Gesundheitsinstitute - Nationales Krebsinstitut . 28. März 2018 . Abgerufen am 1. Juli 2018 .
- "Behandlung von Oropharynxkarzinomen" . emedizinGesundheit . WebMD . 1. August 2017 . Abgerufen am 6. August 2017 .
- Ist Oralsex sicher? (Fernsehproduktion). England: BBC Drei . 10. Januar 2011.
- "HPV-Informationszentrum" . Lyon : Internationale Agentur für Krebsforschung und katalanisches Institut für Onkologie . Abgerufen am 11. August 2017 .
- "The Global Oral Cancer Forum 2016" (Konferenzbericht). Henry Schein Cares-Stiftung. 2017 . Abgerufen am 12. August 2017 .
- „Cetuximab mit Bestrahlung ist der Standardbehandlung bei HPV-positivem Oropharynxkarzinom unterlegen“ . Pressemitteilungen . Nationale Gesundheitsinstitute . 14. August 2018 . Abgerufen am 15. August 2018 .
Behandlungsrichtlinien
- "Kopf-Hals-Krebs-Evidenz-basierte Serie (EBS) und Praxisrichtlinien (PG)" . Evidenzbasierte Leitlinien . Krebsversorgung Ontario . 31. März 2017 . Abgerufen am 22. Mai 2017 .
- "Das Management von Kopf-Hals-Krebs in Ontario. EBS 5-3" . Dezember 2009 . Abgerufen am 22. Mai 2017 ., in CCO (2017)
- "Routine HPV Testing in Kopf-Hals-Plattenepithelkarzinom. EBS 5-9" . Mai 2013 . Abgerufen am 22. Mai 2017 ., in CCO (2017)
- "Kopf-Hals-Krebs" (PDF) . NCCN-Richtlinien 2.2018 . Nationales umfassendes Krebsnetzwerk . 20. Juni 2018 . Abgerufen am 22. Juni 2018 .
- "Kopf und Hals" . Leitlinien für das Krebsmanagement . British Columbia: BC Cancer Agency . 2017 . Abgerufen am 30. Juni 2017 .
Externe Links
| Einstufung | |
|---|---|
| Externe Ressourcen |