TRPV6 - TRPV6
TRPV6 ist ein Membran- Calcium-(Ca 2+ ) -Kanalprotein, das insbesondere am ersten Schritt der Ca 2+ -Resorption im Darm beteiligt ist .
Einstufung
Transientes Rezeptorpotential Das Vanilloid-Subfamilienmitglied 6 (TRPV6) ist ein epithelialer Ca 2+ -Kanal , der zur Familie des transienten Rezeptorpotentials (TRP) von Proteinen gehört. Die TRP-Familie ist eine Gruppe von Kanalproteinen, die für die ionische Homöostase und die Wahrnehmung verschiedener physikalischer und chemischer Reize entscheidend sind. TRP - Kanäle erfassen können , Temperatur , osmotischen Druck , olfaction , Geschmack und mechanische Kräfte. Das menschliche Genom kodiert für 28 TRP-Kanäle, darunter sechs TRPV- Kanäle. Die hohe Ca 2+ -Selektivität von TRPV5 und TRPV6 unterscheidet diese Kanäle von den anderen vier TRPV-Kanälen (TRPV1-TRPV4). TRPV5 und TRPV6 sind am Ca 2+ -Transport beteiligt , während TRPV1 bis TRPV3 Wärmesensoren mit unterschiedlichen Temperaturschwellen für die Aktivierung sind und TRPV4 an der Erfassung der Osmolarität beteiligt ist . Genetische Defekte im TRPV6-Gen sind mit einem vorübergehenden neonatalen Hyperparathyreoidismus und einer früh einsetzenden chronischen Pankreatitis verbunden . Eine Fehlregulation von TRPV6 ist auch an Hyperkalziurie , Nierensteinbildung , Knochenerkrankungen, Defekten in der Keratinozytendifferenzierung , Skelettdeformitäten, Osteoarthritis , männlicher Sterilität , Pendred-Syndrom und bestimmten Unterarten von Krebs beteiligt .
Identifikation
Peng et al identifizierter TRPV6 1999 aus Ratten Duodenum in dem Bemühen , für Ca suchen 2+ Proteine in Ca beteiligt Transport 2+ Absorption. TRPV6 wurde anfangs auch als Calciumtransportprotein 1 (CaT1) bezeichnet, obwohl in frühen Studien auch die Namen epithelialer Calciumkanal 2 (ECaC2) und CaT1-like (CaT-L) verwendet wurden, um den Kanal zu beschreiben. Die Human- und Maus- Orthologe von TRPV6 wurden von Peng et al. bzw. Weber et al. kloniert. Der Name TRPV6 wurde 2005 bestätigt.
Genlokalisation, chromosomaler Ort und Phylogenie
Das humane TRPV6- Gen befindet sich auf dem chromosomalen Locus 7q33-34 in unmittelbarer Nähe zu seinem Homolog TRPV5 auf 7q35. Das TRPV6- Gen beim Menschen kodiert für 2906 bp lange mRNA . Im Gegensatz zu den meisten anderen Proteinen, die die Translation mit einem AUG- Codon initiieren, wird die TRPV6-Translation durch nicht-AUG-Codon-vermitteltes Lesen initiiert. Das TRPV6-Protein trägt im Vergleich zur annotierten Version des Proteins, die in biologischen Studien verwendet wird, eine 40-AA-lange N-terminale Verlängerung in der Plazenta und in einigen physiologischen Situationen. Ob die lange Version des TRPV6-Proteins in verschiedenen Geweben die dominante Form ist, muss jedoch noch ermittelt werden.
| Spezies | Menschlich | Ratte | Maus |
| Chromosomenort | 7q33-q34 | 4q22 | 6B2 |
| Annotierte aa-Länge | 725 | 727 | 727 |
| In vivo aa Länge a | 765 | 767 | 767 |
| RefSeq-Nukleotid | NM_018646 | NM_053686 | NM_022413 |
| RefSeq-Protein | NP_061116 | NP_446138 | NP_071858 |
a In verschiedenen Geweben zu überprüfen.
Es wurde die Hypothese aufgestellt, dass Trpv5- und Trpv6- Gene durch Genduplikationsereignisse aus einem einzigen Vorfahrengen erzeugt wurden . Die phylogenetische Analyse hat gezeigt, dass TRPV6- Paraloge bei Säugetieren , Sauropsiden , Amphibien und Chondrichthyen aus unabhängigen Duplikationsereignissen bei den Vorfahren jeder Gruppe entstanden sind. Es wird spekuliert, dass zwei spezialisierte Ca 2+ -selektive Trpv- Homologe als Anpassung entstanden sind, um einen höheren Grad an funktioneller Spezialisierung für die Navigation unterschiedlicher renaler Herausforderungen von Landtieren zu erreichen.
Beim Menschen wurden zwei Allele des TRPV6- Gens identifiziert (ursprünglich als CaT-La und CaT-Lb bezeichnet). Diese Allele weisen gekoppelte Polymorphismen auf, die zwei Versionen desselben Gens erzeugen. Die Polymorphismen führen zu einer „Vorfahrenvariante“ und einer „abgeleiteten Variante“, die sich in fünf Basen und drei Aminosäuren unterscheiden. Die Vorfahren-Allelcodes für C197(157, in Klammern sind annotierte Aminosäurenummerierungen), M418(378) und M721(681), während die abgeleiteten Allelcodes für R197(157), V418 (378) und T721(681) kodieren. Die Häufigkeit des angestammten TRPV6- Allels variiert zwischen verschiedenen Bevölkerungsgruppen. Es wird die Hypothese aufgestellt, dass Selektionsdrucke, die die TRPV6- Allelverteilung verändert haben könnten, Veränderungen im Muster des Milchkonsums, Domestikation von Tieren, Veränderungen der ultravioletten Lichtexposition aufgrund der transäquatorialen Migration und genomische Anpassungen beinhalten, die Populationen, die auf neue Krankheitserreger treffen, Immunvorteile bieten.
Gewebeverteilung
Das TRPV6-Protein wird in Epithelgeweben wie Darm , Niere , Plazenta , Nebenhoden und exokrinen Drüsen wie Pankreas , Prostata und Speichel , Schweiß- und Brustdrüsen exprimiert . Die Expression des TRPV6-Proteins beim Menschen wurde durch immunhistochemische Verfahren in der Speiseröhre , im Magen , im Dünndarm , im Dickdarm , in der Bauchspeicheldrüse, in den Brustdrüsen, in den Eierstöcken , in der Schilddrüse und in der Prostata nachgewiesen . Die TRPV6-Expression beschränkt sich hauptsächlich auf die apikale Membran von Epithelzellen. Im Darm wird das Protein auf der Bürstensaummembran der Enterozyten exprimiert .
Unterschiede im TRPV6-Expressionsprofil wurden möglicherweise aufgrund von Variationen im Assay-abhängigen Primerdesign , Hybridisierungssonden , PCR vs. Northern-Blotting , semiquantitativer PCR vs. RT-PCR und Antikörpern, die für den Immunnachweis verwendet werden, berichtet . Das TRPV6-Expressionsprofil wird auch durch Alter, Geschlecht, Ca 2+ und Vitamin D 3 -Spiegel in der Nahrung, Hormonstatus, Lage im Gewebe, Zelllage, Fortpflanzungsstatus und Entwöhnungsstatus beeinflusst (siehe Abschnitt Verordnung ).
Beim Menschen wurden TRPV6-Transkripte in Plazenta, Bauchspeicheldrüse, Prostatakrebs, Duodenum und Prostata durch Northern-Blotting nachgewiesen; und in Duodenum, Jejunum, Plazenta, Pankreas, Hoden, Niere, Gehirn und Dickdarm durch semiquantitative PCR. Bei Nagetieren wurde die TRPV6-Expression im Zwölffingerdarm, Blinddarm, Dünndarm, Dickdarm, Plazenta, Bauchspeicheldrüse, Prostata und Nebenhoden durch Northern Blotting validiert. Bei Mäusen ist die durch RT-PCR gemessene TRPV6-Transkript-Abundanz wie folgt: Prostata > Magen, Gehirn > Lunge > Zwölffingerdarm, Blinddarm, Herz, Niere, Knochen > Dickdarm > Skelettmuskel > Pankreas.
Daten aus Human Protein Atlas und RNA-Seq-basiert deuten darauf hin, dass TRPV6-mRNA in den meisten Geweben mit Ausnahme der Plazenta, der Speicheldrüse, der Bauchspeicheldrüse und der Prostata niedrig ist. TRPV6-mRNA wird in der apikalen Domäne von murinen Osteoklasten des kortikalen Knochens exprimiert. Kortikale und trabekuläre Osteozyten exprimieren keine TRPV6-mRNA, während Osteoblasten eine schwache Expression zeigen.
Struktur und biophysikalische Eigenschaften
Primär- und Sekundärstruktur
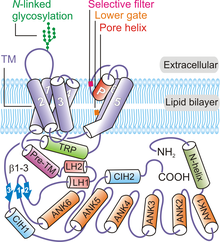
Insgesamt ordnen sich vier Untereinheiten von TRPV6 an, um einen tetrameren Kanal zu bilden, der eine vierzählige Symmetrie zeigt . Beginnend am N-Terminus und in Richtung des C-Terminus des Proteins enthält jedes TRPV6- Polypeptid : eine N-terminale Helix, eine Ankyrin-Repeat- Domäne (ARD), die sechs Ankyrin-Repeats enthält, eine β-Haarnadelstruktur- Linkerdomäne aus zwei β -Stränge , ein Helix-Turn-Helix-Motiv, eine Prä-SI-Helix, TM-Domäne bestehend aus sechs TM-Helices (S1 bis S6), eine Porenschleife (auch P-Schleife genannt), amphipathische TRP-Helix, C-terminal Haken, und ein β-Strang mit sechs Resten (β3) ( 1 ).
Tertiär- und Quartärstruktur

Das TRPV6-Kanalprotein weist eine vierfache Symmetrie auf und enthält zwei Hauptkompartimente: eine 30 hohe Transmembrandomäne mit einer zentralen Ionenkanalpore und einen ~70 hohen und einen ~110 Å breiten intrazellulären Rand, der ein 50 Å × 50 umschließt Å Hohlraumbreite Hohlraum unter dem Ionenkanal. Die Anhäufung von vier TRPV6-Untereinheiten bildet eine wässrige Pore mit einer vierzähligen Symmetrie ( Abbildung 2 ). Eine Prä-SI-Helix verbindet den intrazellulären Teil des Proteins mit der TM-Domäne über eine Linkerdomäne, die aus einer β-Haarnadelstruktur und einem Helix-Turn-Helix-Motiv besteht. Die Helices S1 bis S4 bilden ein Transmembran-Helixbündel oder eine TM-Domäne, die fast senkrecht zur Ebene der Plasmamembran eingefügt ist.
Die Porenmodulelemente bestehen aus S5, S6 und der P-Schleife in TM-Domänen. Das Porenmodul von jedem TRPV6-Polypeptid nimmt an Wechselwirkungen zwischen Untereinheiten teil, um eine zentrale Ionenpore zu bilden ( 1 ). Die porenbildenden Elemente jeder TRPV6-Untereinheit interagieren auch mit S1-S4-Domänen des benachbarten Polypeptids in einer domänentauschierten Anordnung. Interaktionen zwischen den Untereinheiten treten auch zwischen extrazellulären S1-S2-Schleifen und S5-P- und S6-P-Schleifen der benachbarten TRPV6-Untereinheiten auf. Die konservierte N-verknüpfte Glykosylierungsstelle an der S1-S2-Schleife wird für die Klotho- vermittelte Aktivierung benötigt. Der intrazelluläre Randteil des TRPV6-Proteins besteht hauptsächlich aus den Ankyrin-Repeats. Die TRP-Domäne ist parallel zur Membran ausgerichtet und nimmt an hydrophoben Wechselwirkungen mit der TM-Domäne und den hydrophilen Wechselwirkungen im intrazellulären Rand teil. Die N-terminale Helix, der C-terminale Haken und die β-Faltblätter (gebildet durch die β-Haarnadelstruktur in der Linkerdomäne) im Kanal nehmen an Interaktionen zwischen den Untereinheiten mit den ARDs teil, um einen Rahmen zum Halten der Elemente des intrazellulären Rocks bereitzustellen zusammen.
Porenarchitektur und Kationenbindungsstellen
Die TRPV6-Poren bestehen aus vier Hauptelementen, nämlich dem extrazellulären Vestibulum, einem Selektivitätsfilter, einem hydrophoben Hohlraum und einem unteren Tor. Gegenüber dem zentralen Lumen des Kanals ist ein Selektivitätsfilter mit vier Resten ( 538 TIID 541 ), der vier Aspartat 541 (D541) -Seitenketten (eine von jedem Protomer) enthält, entscheidend für die Ca 2+ -Selektivität und andere biophysikalische Eigenschaften des Kanals. Dieser Filter bildet einen negativ geladenen Ring, der Ionen aufgrund ihrer Größe und Ladung unterscheidet. Mutationen im kritischen porenbildenden Rest von TRPV6 blockieren die Ca 2+ -Aufnahme , eine Strategie wurde verwendet, um TRPV6-Funktionsverlustmodelle zu generieren, um die Rolle des Kanals in der Tierphysiologie zu untersuchen. Es wird angenommen, dass im TRPV6-Kanal vier verschiedene Typen von Kationenbindungsstellen existieren. Stelle 1 befindet sich in der zentralen Pore und teilt dieselbe Ebene, die von den selektiven Schlüsselresten D541 besetzt wird. Es wird angenommen, dass Standort 2 etwa 6-8 unterhalb von Standort 1 vorhanden ist, gefolgt von Standort 3, der sich in der zentralen Porenachse etwa 6,8 unterhalb von Standort 2 befindet Ca 2+ -Ionen. Schließlich vermitteln vier symmetrische Kationenbindungsstellen im extrazellulären Vestibulum die Rekrutierung von Kationen zum extrazellulären Vestibulum von TRPV6 und werden als Rekrutierungsstellen bezeichnet.
Ionenpermeation
Die Leitfähigkeit von TRPV6 für zweiwertige Kationen folgt der Präferenz: Ca 2+ > Ba 2+ > Sr 2+ > Mn 2 . Intrazelluläres Mg 2+ hemmt TRPV6 und trägt zur starken Einwärtskorrektur des Kanals bei. Die Aufnahmeaktivität von TRPV6 wird durch zweiwertige Pb 2 , Cu 2+ , Cd 2+ , Zn 2 , Co 2+ , Fe 2+ und die dreiwertigen Kationen La 3+ , Fe 3+ , Gd 3+ gehemmt . Die Konzentration der Ionen, um die Hemmung zu erreichen, reicht von 1 bis 10 µM. Das TRPV6-Protein ist konstitutiv mit einer Einzelkanalleitfähigkeit von 42-58 ps. Bei niedrigen Ca 2+ -Konzentrationen bindet ein einzelnes Ca 2+ -Ion in den von D541 gebildeten Selektivitätsfilter und ermöglicht die Na + -Permeation. Bei hoher Ca 2+ -Konzentration erfolgt die Ca 2+ -Permeation durch einen Knock-Off-Mechanismus, der die Bildung kurzlebiger Konformationen beinhaltet, die die Bindung von drei Ca 2+ -Ionen an den Rest D541 beinhalten.
Kanal-Gating

Die an der Kanalöffnung beteiligten Konformationsänderungen sind um den Rest Alanin 566 (A566) gelenkt und treten in der porenauskleidenden Helix S6 auf ( Abbildung 3 ). Der obere Teil der S6-Helix durchläuft einen helikalen Übergang von α zu , der den unteren Teil der Helix dazu zwingt, sich um 100 Grad zu drehen und um 11 Grad von der Porenachse weg zu neigen. Diese Konformationsänderung bewegt den unteren Teil der Helix, die die Pore ansteuert, und erweitert dadurch die Porengröße. Die Konformationsänderung verändert die der Porenachse zugewandten Reste und löst die Bildung neuer elektrostatischer Bindungsuntereinheiten und Salzbrücken aus , die die hohen energetischen Kosten des ungünstigen α-zu-π-Helixübergangs ausgleichen, der während der Kanalöffnung auftritt.
Regulation durch Phosphatidylinositol 4,5-Bisphosphat (PIP 2 ) und Calmodulin (CaM)
Der Einstrom von Ca 2+ in die Zelle löst negative Rückkopplungsmechanismen aus, um die TRPV6-Aktivität zu unterdrücken und eine Ca 2+ -Überladung zu verhindern . TRPV6 Kanalaktivität wird durch die intrazellulären Pegel des regulierten Phospholipid Phosphatidylinositol - 4,5-bisphosphat (PIP 2 ) und Wechselwirkungen mit Ca 2+ - Calmodulin (CaM) -Komplex. Die Verarmung von PIP 2 oder CaM-Bindung inaktiviert TRPV6. Der Einstrom von Ca 2+ in TRPV6-exprimierende Zellen aktiviert Phospholipase C (PLC), die wiederum PIP 2 hydrolysiert . Eine Erschöpfung der PIP- 2- Spiegel führt zu einer Abnahme der Kanalaktivität, da die meisten TRP-Kanäle dieses Lipid zur Aktivierung benötigen. Das Lipid PIP 2 kann die Ca 2+ -CaM-vermittelte Hemmung von TRPV6 außer Kraft setzen. Insgesamt wird die TRPV6-Inaktivierung durch Calmodulin durch ein Gleichgewicht der intrazellulären Ca 2+ - und PIP 2 -Konzentration orchestriert .
Wechselwirkende Proteine
Unter den bisher identifizierten 20+ TRPV6-Interaktoren wurden die funktionellen Konsequenzen des Ca 2+ -bindenden Proteins Calmodulin (CaM) und der Glucuronidase Klotho am umfassendsten charakterisiert [36, 37, 41, 42]. Die funktionellen Konsequenzen der TRPV6-Kanalaktivierung sind in der folgenden Tabelle zusammengefasst).
| Interaktor | Folge |
| BSPRY | N / A |
| Calbindin-D 28k | N / A |
| Calmodulin | Hemmung |
| Cyclophilin B | Aktivierung |
| FYN | PO 4 lyation |
| I-MFA | N / A |
| Klotho | Aktivierung, Glykosylierung (Asn-357) |
| NHERF4 | Aktivierung |
| NIPSNAP1 | Hemmung |
| GEFÜHLLOS | Hemmung |
| PTEN | N / A |
| PTP1B | DePO 4 lyation
(Tyr-161 und Tyr-162) |
| RAB11A | Aktivierung,
Erhöhung des Plasmamembranspiegels |
| RGS2 | N / A |
| RYR1 | N / A |
| S100A10 | Aktivierung,
Erhöhung des Plasmamembranspiegels |
| SRC | PO 4 -Lierung (Tyr-161, 162) |
| TRPC1 | Behält in ER, Hemmung |
| TRPML3 | N / A |
| TRPV5 | Tetramerbildung,
Erstellung eines neuen Kanals |
Abkürzungen
Protein-Interaktor
BSPRY: B-Box und Spry-Domäne, die Protein enthält; FYN: Fyn-Kinase, die zur Src-Kinasenfamilie gehört; I-MFA: Inhibitor der Myo-D-Familie; NHERF: Regulatorischer Faktor für Na-Austauscher; NIPSNAP14-Nitrophenylphosphatase-Domäne und nicht-neuronales SNAP25-ähnliches Protein Homolog 1; Taub: Drosophila-Mutation, die die meisten sensorischen Neuronen im sich entwickelnden peripheren Nervensystem entfernt; PTP: Protein-Tyrosin-Phosphatase; Rab11a: Mitglied der RAS-Onkogenfamilie; RGS2: Regulator der G-Protein-Signalgebung 2; RyR1: Ryanodin-Rezeptor 1; TRPC1: Transientes Rezeptorpotential kanonisch 1; TRPML3: Transientes Rezeptorpotential Mucolipin-3.
Physiologische Funktionen
Die Ca 2+ -selektiven Kanalproteine TRPV6 und TRPV5 kooperieren, um die Calciumkonzentration in bestimmten Organen aufrechtzuerhalten. TRPV6 fungiert als apikale Ca 2+ -Eintrittskanäle , die den transzellulären Transport dieses Ions im Darm, in der Plazenta und möglicherweise in einigen anderen exokrinen Organen vermitteln. TRPV6 spielt auch eine wichtige Rolle beim maternal-fetalen Calciumtransport, der Keratinozytendifferenzierung und der Ca 2+ -Homöostase im endolymphatischen System des Vestibularsystems und der Aufrechterhaltung der männlichen Fertilität.
C a 2+ Aufnahme im Darm
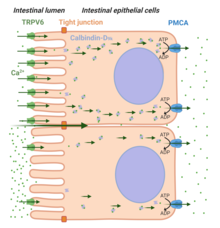
Es werden zwei Wege der Ca 2+ -Absorption erkannt: parazellulärer Transport und transzellulärer Transport (siehe 4 ). Eine Ernährung mit hohem Ca 2+ -Gehalt begünstigt den parazellulären Transport des Ions über die gesamte Länge des Darms, so dass es zwischen den interzellulären Tight Junctions passieren kann , die Epithelzellen verbinden. Im Gegensatz dazu ist unter Bedingungen, bei denen [Ca 2+ ] im Lumen des Darms im Vergleich zu seiner Konzentration im Plasma niedriger ist (z. B. bei niedrigem Ca 2+ ) der Nahrung , der transzelluläre Weg für eine ausreichende Ca 2+ -Absorption erforderlich . Drei wichtige Schritte beim transzellulären Ca 2+ -Transport werden erkannt: zellulärer Eintritt des Ca 2+ -Ions auf der apikalen Seite über TRPV6 (Schritt-1), die Bindung des Ca 2+ -Ions mit Calbindin -D 9k (Schritt-2) , und Austritt von Ca 2+ von der basolateralen Seite über die Plasmamembran Ca 2+ ATPase (PMCA1b). Das Hormon Vitamin D 3 (oder 1,25(OH) 2 D 3 ) spielt eine wichtige Rolle bei der TRPV6-vermittelten intestinalen Ca 2+ -Absorption ).
Ca 2+ Resorption in der Niere
Im Gegensatz zum Darm, wo TRPV6 der Gatekeeper der Ca 2+ -Absorption ist , erfolgt die transzelluläre Rückresorption dieses Ions in der Niere durch TRPV5. Obwohl TRPV5 ein anerkannter Gatekeeper für die transzelluläre Reabsorption von Ca 2+ -Ionen in der Niere ist, haben TRPV6- Knockout (KO)-Mäuse auch Schwierigkeiten , ihren Urin zu konzentrieren und zeigen Hyperkalziurie. Es ist bekannt, dass TRPV6 mit TRPV5 Calbindin-D 28K in apikalen Domänen von distalen gewundenen Tubuli und Verbindungstubuli kolokalisiert [20]. TRPV5-KO-Mäuse kompensieren den Ca 2+ -Verlust durch Erhöhung der TRPV6-Expression im Duodenum. Darüber hinaus ist eine kürzlich durchgeführte Studie analysiert Vitamin - D - responsiven Genen in Schafen , Hunde und Pferde- Niere schlug vor , dass TRPV6, cald 9k / cald 28k und PMCA die Hauptwege Ca orchestriert transzellularen sein könnte 2+ Transport in der Niere von Schafen, Hunden und Pferde.
Maternal-fetaler Ca 2+ Transport
TRPV6 spielt eine unverzichtbare Rolle beim plazentaren Ca 2+ -Transport . Die Knochenmineralisierung des Fötus erreicht ihren Höhepunkt während der späten Schwangerschaft. In diesem Stadium weist fetales Blut im Vergleich zu mütterlichem Blut eine höhere Ca 2+ -Konzentration auf, wodurch Bedingungen geschaffen werden, die einen aktiven transzellulären Transport von Ca 2+ von der Mutter zum Fötus erfordern . Dieser Prozess ist sehr wichtig, da Defekte im plazentaren Calciumtransport Vorläufer für Ca 2+ -Mangelsyndrome und intrauterine Wachstumseinschränkungen sein können . Die Expression von TRPV6 erhöht die 14-fach in den letzten 4 Tagen der Maus Schwangerschaftsperiode und fällt mit der Hochphase der fetalen Knochenmineralisation. Das Protein TRPV6 wird im Plazentagewebe von Säugetieren reichlich exprimiert. Tatsächlich ist die TRPV6-Expression im Vergleich zu TRPV5 etwa 1000-fach höher. In der Plazenta wird TRPV6 in Trophoblasten und Syncytiotrophoblasten exprimiert . Bei Mäusen werden TRPV6-mRNA und -Protein im intraplazentaren Dottersack und der viszeralen Schicht des extraplazentaren Dottersacks exprimiert . Am wichtigsten ist, dass TRPV6 KO-Föten eine 40%ige Verringerung der 45 Ca 2+ -Transportaktivität und eine dramatische Abnahme des Aschegewichts (ein Maß für die Knochengesundheit des Fötus) aufweisen. Beim Menschen ist bekannt, dass Trophoblasten-Flüssigkeitsscherstress (FSS) einen TRPV6-vermittelten Ca 2+ -Einstrom induziert und die Mikrovilli- Bildung durch einen Mechanismus mit Ezrin- und Akt-Phosphorylierung fördert .
Nebenhoden-Ca 2+ -Regulierung und Auswirkungen auf die männliche Fertilität
Die Regulierung der Calciumkonzentration im Nebenhodenlumen ist entscheidend für die Beweglichkeit der Spermien . Die TRPV6-vermittelte Reduktion der luminalen Ca 2+ -Konzentration im Nebenhoden ist entscheidend für die männliche Fertilität bei Mäusen. TRPV6-KO-Mäuse oder Mäuse, die eine funktionslose Version des TRPV6-Kanals exprimieren ( Trpv6 D541A homozygote Mäuse) haben eine stark beeinträchtigte Fertilität . Mäuse, die nicht-funktionelles TRPV6 exprimieren, haben eine 10-fach höhere Konzentration von Ca 2+ im Nebenhodenlumen und die Ca 2+ -Aufnahme in diesem Raum ist um das 7- bis 8-fache reduziert. Das erhöhte Ca 2+ -Ion in der Nebenhodenlumenkonzentration führt zu signifikanten Defekten in der Motilität, Befruchtungsfähigkeit und Lebensfähigkeit von Spermien in TRPV6 D541A- Mäusen. Es scheint, dass TRPV6 und Chloridkanal-Transmembran-Art 16 A ( TMEM16A ) kooperativ wirken, um die luminale Konzentration von Ca 2+ im Nebenhodenlumen zu reduzieren .
Knochen Gesundheit
Unter Bedingungen von suboptimalem Ca 2+ in der Nahrung werden normale Serumcalciumspiegel in TRPV6 KO-Mäusen auf Kosten der Knochen aufrechterhalten. TRPV6 spielt eine wichtige Rolle in Osteoklasten, jedoch nicht in Osteoblasten. Bei Mäusen führt eine TRPV6-Depletion zu einer erhöhten Osteoklastendifferenzierung, während TRPV5 für eine ordnungsgemäße osteoklastische Knochenresorption unerlässlich ist.
Keratinozytendifferenzierung
Die Differenzierung von Keratinozyten wird durch einen Calcium-Switch orchestriert, ein Prozess, der einen Einstrom von Ca 2+ in Keratinozyten mit sich bringt, der breite Transkriptionsänderungen induziert, die für die Desmosomenbildung , Stratifizierung und Verhornung notwendig sind . TRPV6 KO-Mäuse zeigen dünnere Schichten des Stratum corneum und 20% der Mäuse zeigen auch Alopezie und Dermatitis . Das Stummschalten von TRPV6 beeinträchtigt die Ca 2+ -vermittelte Differenzierung von menschlichen primären Keratinozyten und reguliert Differenzierungsmarker wie Involucrin , Transglutaminase-1 und Cytokeratin-10 herunter . Das Hormon 1,25-Dihydroxyvitamin-D3 reguliert TRPV6 in Keratinozyten hoch und löst einen Ca 2+ -Einstrom aus . Dies wiederum induziert die Expression von Keratinozyten-Differenzierungs-spezifischen Signalwegen.
Rolle im Innenohr
Die Proteine TRPV5 und TRPV6 werden in mehreren Regionen des Innenohrs sowie in Primärkulturen des Bogengangsepithels (SCCD) exprimiert. Einige Studien haben gezeigt, dass TRPV5 und TRPV6 benötigt werden, um die Ca 2+ -Konzentration im Lumen der Endolymphe von Säugetieren zu senken , eine Voraussetzung, die für normales Hören und Gleichgewicht unerlässlich ist .
Uterine und plazentare Expression von TRPV6 und Auswirkungen auf die Schwangerschaft
Die endometriale und uterine Expression von TRPV6 wurde bei Säugetieren berichtet. Es wird angenommen, dass die Expression von TRPV6 im Uterus bei Nagetieren hormonell durch 17β-Östradiol und Progesteron reguliert wird . Bei Nagetieren wird TRPV6-mRNA im Labyrinth und in der schwammigen Zone sowie in Bereichen der Gebärmutter ohne Plazenta exprimiert. Das Schwangerschaftsstadium ist ein wichtiger Regulator der TRPV6-Expression. Es wird angenommen, dass die Herunterregulierung der TRPV5/6-Expression und eine daraus resultierende Abnahme des Ca 2+ -Transports das proliferative Profil menschlicher Trophoblasten verändert; ein Prozess, der wiederum mit der Entwicklung einer Präeklampsie verbunden ist . Dieses Nebeneinander von TRPV6 Ausdruck und seine strengen Regulierung durch Sexualhormone während der Schwangerschaft deutet darauf hin , dass das Protein für wichtig sein kann , die Einnistung des Embryos , aber schlüssiger Beweis für diese Verbindung nicht existiert.
Auswirkungen auf menschliche Krankheiten
Transienter neonataler Hyperparathyreoidismus
Der Verlust von TRPV6 in der murinen Plazenta beeinträchtigt den Ca 2+ -Transport durch den Trophoblasten stark und reduziert das Embryowachstum , induziert Knochenverkalkung und beeinträchtigt die Knochenentwicklung. Beim Menschen wird angenommen, dass der unzureichende maternal-fetale Transport durch pathogene genomische Varianten von TRPV6 eine Ursache für Skelettdefekte ist, die in ausgewählten Fallberichten von transientem neonatalem Hyperparathyreoidismus (TNHP) beobachtet wurden. Es wird angenommen, dass diese Varianten die Plasmamembranlokalisierung des Proteins beeinträchtigen. Exome Sequenzierung eines Säuglings mit schweren vorgeburtlichen Beginn Thoraxinsuffizienz mit fetalen Fehlbildungen des Skeletts Begleit zeigt die kritische Rolle der TRPV6 in mütterlich-fetalen Transport. Die Studie zeigte, dass zusammengesetzte heterozygote Varianten von TRPV6 zu schwerer Untermineralisierung und schwerer Dysplasie des fetalen Skeletts führen.
Chronische Pankreatitis
Neuere Beweise deuten darauf hin, dass natürlich vorkommende TRPV6-Funktionsverlustvarianten bestimmte demografische Merkmale für chronische Pankreatitis (CP) prädisponieren, indem sie die Calciumhomöostase in den Pankreaszellen fehlregulieren. Sequenzierungsstudien bei Patienten mit chronischer Pankreatitis zeigten das Vorhandensein von 33 Missense- und 2 Nonsense- Varianten, die japanische , deutsche und französische Patienten für ein höheres CP-Risiko prädisponierten . Insgesamt haben diese Studien gezeigt, dass krankheitsauslösende genomische Varianten mit TRPV6-Funktionsverlust bei deutschen, französischen, chinesischen und japanischen CP-Patienten im Vergleich zu Kontrollen in ihren jeweiligen Gruppen überrepräsentiert sind . Es wird angenommen, dass die Varianten mit Funktionsverlust den Calciumtransport in der Bauchspeicheldrüse beeinträchtigen, indem sie entweder den Gesamtproteinspiegel reduzieren und/oder die Ca 2+ -Aufnahmeaktivität durch den Kanal beeinträchtigen .
Bildung von Nierensteinen
Die Rolle von TRPV6 bei der Nierensteinbildung wurde durch Sequenzierungsstudien an einer Kohorte von 170 Patienten in der Schweiz vorgeschlagen . Die Studien zeigten, dass die Häufigkeit des TRPV6 Gain-of-Function-Haplotyps bei Ca 2+ -Steinbildnern ( Nephrolithiasis ) im Vergleich zu Nichtbildnern signifikant höher ist . Die beobachteten Hyperkalziurie- Phänotypen aus Tierstudien und Studien zu TRPV6- Single-Nucleotid-Polymorphismen (SNPs) legen nahe, dass der TRPV6-Haplotyp ein wichtiger Risikofaktor für eine resorptive und renale Hyperkalziurie (Nierensteine aufgrund einer gestörten intestinalen Resorption bzw. renalen Resorption) sein könnte. Die geringere Inzidenz von Nierensteinerkrankungen bei Afroamerikanern und eine relativ höhere Prävalenz des angestammten Haplotyps legen eine Theorie nahe, nach der dieser Haplotyp in dieser Bevölkerungsgruppe einen Vorteil einer erhöhten Ca 2+ -Reabsorption bietet und die Inzidenz von Nierensteinen reduziert.
Knochenresorptive Erkrankungen
TRPV6 KO-Mäuse zeigen Osteoporose-ähnliche Symptome wie eine verringerte Knochenmineraldichte und Hyperkalziurie. Das Hormon Östrogen , dessen Mangel mit postmenopausaler Osteoporose in Verbindung steht , reguliert auch die Expression von TRPV6 beim Menschen. Tatsächlich wird eine niedrigere Kalziumabsorption, die bei älteren postmenopausalen Frauen beobachtet wurde, einem reduzierten TRPV6 zugeschrieben. Der C-terminale Teil von Soricidin ist ein Medikament, das die Ca 2+ -Aufnahmeaktivität durch Bindung an TRPV6 hemmt. Präklinische Studien dieses Medikaments haben sich bei der Behandlung von knochenresorptiven Erkrankungen als vielversprechend erwiesen.
Die hohe Ähnlichkeit zwischen den Symptomen der hereditären Vitamin D-resistenten Rachitis (HVDRR) und den beobachteten Phänotypen bei TRPV6-KO-Mäusen hat einige Experten dazu veranlasst, pathologische Zusammenhänge zwischen der Krankheit und der TRPV6-Dysfunktion zu postulieren. TRPV6 spielt eine wichtige chondroprotektive Rolle, indem es mehrere Aspekte der Chondrozytenfunktion reguliert , wie die Sekretion der extrazellulären Matrix , die Freisetzung von matrixabbauenden Enzymen, Zellproliferation und Apoptose . Darüber hinaus zeigen TRPV6-Knockout-Mäuse multiple Osteoarthritis (OA) -Phänotypen wie Knorpelflimmern , Eburnation und Verlust von Proteoglykanen .
Pendred-Syndrom
Das Dysfunktionsgen Slc26a4 wurde mit dem Pendred-Syndrom in Verbindung gebracht – einer genetischen Störung, die bei Kindern zu syndromaler Taubheit führt . Die Krankheit wird durch Mutationen in dem Kompromiss der Funktion des kodierten Proteins verursacht Pendrin - ein Anion Cl - / HCO3 - Tauscher im Innenohr exprimiert. Es wird angenommen, dass der Funktionsverlust in diesem Gen den pH- Wert der Säugetier-Endolymphe senkt und die Ca 2+ -Absorption über TRPV5 und TRPV6 beeinträchtigt. Dies wiederum könnte die Aufnahme von Ca 2+ verhindern und die luminale Reduktion der Ca 2+ -Konzentration im endolymphatischen System des Ohrs beeinträchtigen .
Krebs
Die Überexpression von TRPV6 wurde bei Dickdarm-, Nebenschilddrüsen- , Bauchspeicheldrüsen- und Schilddrüsenkrebs validiert, während seine Expression bei Speiseröhrenkrebs , nicht-kleinzelligem Lungenkrebs und Nierenkrebs Berichten zufolge herunterreguliert ist . TRPV6 gilt als Onkokanal, von dem angenommen wird, dass er die Krebsprogression vermittelt, indem er durch Ca 2+ -Eintritt induzierte Aberrationen in molekularen Treibern auslöst , die Prozesse wie Zellzyklus , Apoptose und Migration regulieren ; wodurch Krebszellen proliferative und Überlebensvorteile verliehen werden. Die Überexpression von TRPV6 korreliert stark mit pathologischem Stadium , Tumorgrad , extra-Prostata - Invasion, Lymphknotenmetastasen und Beständigkeit gegen Androgen -targeted Therapien in Prostatakrebs . Die Expression von TRPV6 wurde als prognostischer Marker für fortgeschrittenen Prostatakrebs angepriesen, da seine Expression stark vom Grad des Tumors abhängt. Die Expression von TRPV6 ist in Brust- Adenokarzinom- Gewebe im Vergleich zu normalem Brustgewebe signifikant erhöht . TRPV6 Ausdruck hat mehrere Brust berichtet Krebszelllinien und Prostatakrebs-Zelllinien. Die Prostatakrebszelllinien PC-3 und LnCAP überexprimieren TRPV6 im Vergleich zu den gutartigen Epithelzellen PrEC und BPH-1. Das Stummschalten von TRPV6 in Prostatakrebszellen verringert die Proliferationsrate, die S-Phasen- Akkumulation und die Expression der Expression des Tumormarker- proliferativen Zellkernantigens (PCNA). TRPV6 Überexpression wird angenommen , dass anomale Ca induzieren 2 + - Aufnahme in Prostatakrebs Linie und activate Transkriptionsfaktor Nuclear Factor of Activated T - Zellen (NFAT).
Die Expression von TRPV6 wird durch Östrogen, Progesteron und Östradiol in der Brustkrebszelllinie T47D hochreguliert . In Übereinstimmung mit diesen Beobachtungen reduziert der Östrogenrezeptor- Antagonist Tamoxifen die TRPV6-Expression in T47D-Zellen und unterdrückt die Ca 2+ -Aufnahme des Kanals sowohl in ER-positiven als auch ER-negativen Brustkrebszelllinien. Die Überexpression von TRPV6 wird mit Dickdarmkrebs im Frühstadium in Verbindung gebracht, und seine Stilllegung bei Dickdarmkrebs induziert Apoptose und hemmt die Proliferation von Krebszellen. In Bezug auf den Mechanismus verleihen Mutationen innerhalb der Calmodulin-bindenden Domänen von TRPV6-Kanälen den Zellen des Kolon-Adenokarzinoms invasive Eigenschaften. Es wird angenommen, dass die Proteine p38α und GADD45α die TRPV6-Expressionssignalisierung in SW480-Darmkrebszellen hochregulieren, indem sie die Vitamin-D-Signalübertragung verstärken. Es wurde berichtet, dass TRPV6 Insulin-ähnliche Wachstumsfaktoren (IGF)-induzierte PI3K – PDK1 – Akt- Signalgebung bei humanem Dickdarmkrebs verstärkt und Dickdarmkrebs fördert.
TRPV6 wird in primären Krebsgeweben von Patienten mit Bauchspeicheldrüsenkrebs hochreguliert und fördert die Proliferation von neuroendokrinen Pankreastumoren NFAT-abhängigen Mechanismen. Die Stilllegung von TRPV6 induziert Apoptose und Zellzyklusarrest in Bauchspeicheldrüsenkrebszellen und hemmt deren Invasion, Proliferation und Migration. Die erzwungene Expression von TRPV6 in Magenkrebszellen erhöht deren Empfindlichkeit gegenüber Capsaicin- induzierter Apoptose, während die siRNA- vermittelte Stummschaltung des Kanals diese Empfindlichkeit unterdrückt. Die Herunterregulierung von TRPV6 beim Ösophaguskarzinom wurde als prognostischer Marker für das krankheitsspezifische Überleben bei Patienten mit Speiseröhrenkrebs vorgeschlagen . Niedrige TRPV5- und TRPV6-Koexpressionen wurden als prädiktive Marker für ein schlechtes rezidivfreies Überleben bei nicht-kleinzelligem Lungenkrebs vorgeschlagen .
Pharmakologisches Targeting
Es ist bekannt, dass mehrere chemische Inhibitoren TRPV6 hemmen. Einige Verbindungen , die inhibitorische Aktivität gezeigt haben , in Richtung TRPV6 umfassen TH-1177, 2-Aminoethoxydiphenyl Borat (2-APB), 2-APB - Derivat 22b, Econazol , Miconazol , Piperazin - Derivat Cis-22a, Capsaicin , Δ 9 - Tetrahydrocannabivarin , Xestospongin C, Lidocain , Goldkäfig -Nanopartikel (PTX-PP@Au-NPs) und synthetisches Peptid Sorcidin C-13 (SOR-C13). Unter den verschiedenen bisher getesteten Hemmstrategien hat sich das 13-Aminosäuren-Peptid SOR-C13 am vielversprechendsten erwiesen. Dieses 13-Aminosäuren-Peptid, abgeleitet von 54-Aminosäuren-Peptid, das im paralytischen Gift der nördlichen Kurzschwanzspitzmaus ( Blarina brevicauda ) gefunden wird, reduziert das Krebswachstum in Zell- und Tiermodellen. Dieser Krebswirkstoff hat kürzlich eine klinische Sicherheitsstudie der Phase I abgeschlossen , an der 23 Patienten mit fortgeschrittenen soliden Tumoren epithelialen Ursprungs teilnahmen, die nicht auf alle Standardbehandlungen ansprachen.
Verordnung
Die Regulation von TRPV6 kann hauptsächlich im Kontext seiner physiologischen, hormonellen und molekularen Faktoren untersucht werden. Die hormonelle Regulation von TRPV6 wurde am ausführlichsten charakterisiert. In diesem Zusammenhang wurde seine Regulation durch das Hormon Vitamin D 3 und Sexualhormone sehr ausführlich untersucht. Nagetierstudien legen nahe, dass der TRPV6-Kanal durch eine Vielzahl physiologischer Faktoren wie Ernährung, Alter, Geschlecht, Schwangerschaft, Stillzeit, Sexualhormone, Bewegung, Alter und Geschlecht reguliert wird. Einige biologische und pharmakologische Wirkstoffe, von denen bekannt ist, dass sie TRPV6 regulieren, umfassen Glukokortikoide , Immunsuppressiva und Diuretika .
Vitamin-D
Mehrere Dosis-Antwort- und Zeitverlauf-Experimente an Nagetieren und Dickdarmkrebs-Zelllinien haben schlüssig gezeigt, dass TRPV6-mRNA durch dieses Vitamin D in extrem niedrigen Konzentrationen robust induziert wird. Auf TRPV6-Transkripten wurden mindestens fünf Vitamin-D-Response-Elemente (VDREs) an den Positionen –1,2, –2,1, –3,5, –4,3 und –5,5 kb relativ zur Transkriptionsstartstelle (TSS) identifiziert. Von diesen fünf Stellen reagieren VDREs an den Positionen −1.2, −2.1 und −4.3 kb signifikant stärker auf 1,25-(OH) 2 D 3 im Vergleich zu VDREs an −3.5 und −5.5 kb, die nicht tragen wesentlich zur Vitamin-D-vermittelten Transkriptionsregulation im Darm bei. Mechanismusweise wird die TRPV6-Transkription als Reaktion auf den Vitamin-D-Rezeptor (VDR)-vermittelten Signalweg initiiert , obwohl andere nicht-direkte Mechanismen nicht ausgeschlossen werden können. Wichtige Schritte in der Vitamin-D-vermittelten Transkriptionsregulation umfassen 1) die Bindung von Vitamin D an seinen verwandten Vitamin-D-Rezeptor (VDR), 2) die Translokation des Vitamin-D-Rezeptors (VDR) -Retinoid-X-Rezeptor- Heterodimer-Komplexes im Zellkern , 3) die Bindung von VDR -RXR-Komplex auf dem TRPV6 -Genpromotor , 4) Rekrutierung von Steroidrezeptor-Koaktivator 1 und RNA-Polymerase II auf dem Promotor und 5) Transkriptionsaktivierung, vermittelt durch Histon-H4- Acetylierungsereignisse .
Diät
Der Gehalt an Ca 2+ und Vitamin D in der Nahrung sind die wichtigsten Regulatoren der TRPV6-Expression. Es wird angenommen, dass die Expression von TRPV6 stark moduliert wird, um die Ca 2+ -Absorption aus der Nahrung fein abzustimmen , insbesondere unter Bedingungen, bei denen die Ca 2+ -Verfügbarkeit in der Nahrung gering ist. Bei Nagetieren führt die Einschränkung der Ca 2+ -Verfügbarkeit in der Nahrung zu einer dramatischen Hochregulierung der duodenalen Expression von TRPV6. Der Calciumeinstrom aus der Nahrung und seine anschließende Bindung an Calbindin-D 9k könnte der geschwindigkeitsbestimmende Schritt sein, der die Vitamin-D-abhängige Regulation von TRPV6 moduliert. Wenn Ca 2+ aus der Nahrung unzureichend ist, werden normale Blutkalziumspiegel bei TRPV6 KO-Mäusen auf Kosten der Knochen aufrechterhalten. In vielen Nagetierlinien beeinflussen genetische Variationen in TRPV6, Calbindin-D 9k , PMCA1b-mRNA die intestinale Ca-Absorption und deren Einfluss auf die Knochenmarkdichte.
Schwangerschaft und Stillzeit
Die duodenale Expression von TRPV6-Transkripten wird in WT- und VDR-KO-Mäusen während der Trächtigkeit und Laktation hochreguliert . Das Hormon Prolaktin reguliert die Transkription von TRPV6 hoch und erleichtert eine Erhöhung der intestinalen Ca 2+ -Absorption bei säugenden und trächtigen Ratten, möglicherweise als adaptiver Mechanismus zur Überwindung des Verlusts des Knochenmineralisierungsgehalts während der Laktation.
Altern
Die intestinale Expression von TRPV6 bei Mäusen variiert dramatisch je nach Alter und relativer Gewebelokalisation. Die duodenale Expression von TRPV6 ist bei P1 nicht nachweisbar und nimmt mit zunehmendem Alter der Mäuse bis P14 um das 6-fache zu. In ähnlicher Weise variiert die Expression auch mit dem Alter im Jejunum , wo die TRPV6-Spiegel von P1 auf P14 ansteigen, im Alter von 1 Monat schwach werden und bei älteren Mäusen nicht mehr nachweisbar werden. Die Expression von TRPV6 bei älteren Ratten (12 Monate) ist im Vergleich zu jüngeren Ratten (2 Monate alt) um mindestens 50 % geringer. Sowohl bei WT- als auch bei VDR-KO-Mäusen wird die altersbedingte Abnahme der intestinalen Absorption von Ca 2+ von einer Abnahme der duodenalen Expression von TRPV6 begleitet.
Sexualhormone
Sexualhormone spielen eine wichtige Rolle bei der Regulation von TRPV6. Im Vergleich zu männlichen Mäusen zeigen weibliche Mäuse nach einer Vitamin-D-Behandlung einen 2-fach höheren Anstieg der duodenalen Expression von TRPV6-mRNA. Es wird angenommen, dass die geschlechtshormonassoziierte differentielle Regulation von TRPV6 zwischen den Geschlechtern mit Unterschieden im relativen Risiko für Osteoporose bei älteren postmenopausalen Frauen korreliert, von denen berichtet wurde, dass sie eine niedrigere TRPV6- und VDR-Expression im Vergleich zu Männern aufweisen.
Die Östrogenbehandlung erhöht die TRPV6-Transkripte um das 8-fache bei VDR-KO-Mäusen und um das 4-fache bei ovariektomierten Mäusen. Bei Östrogenrezeptor- αKO- Mäusen wurde eine Reduktion der TRPV6-mRNA von mehr als 50% beobachtet . Es wird angenommen, dass Östrogen die Ca 2+ -Absorption im Duodenum differenziell regulieren könnte, indem es die TRPV6-Expression durch ERα erhöht. Anti-Progesteron-Mittel RU486 und Anti-Östrogen-Mittel ICI 182,780 unterdrücken die TRPV6-Expression in Nagetieren durch ihre jeweilige antagonistische Wirkung auf Progesteron- und Östrogenrezeptoren . Östrogen, Progesteron und Dexamethason sind dafür bekannt, dass sie die TRPV6-Expression in der Großhirnrinde und im Hypothalamus von Mäusen hochregulieren, was auf eine mögliche Beteiligung von TRPV6 an der Kalziumabsorption im Gehirn hindeutet .
Glukokortikoide
Die subkutane Verabreichung des Glukokortikoids Dexamethason induziert bei Mäusen innerhalb von 24 Stunden sowohl die renale als auch die intestinale Expression von TRPV6, während die orale Gabe von Prednisolon eine Verringerung von TRPV6 mit sich bringt, was auch mit einer verringerten Ca 2+ -Resorption im Duodenum einhergeht . Die intestinale Regulation von TRPV6 als Reaktion auf Glukokortikoide scheint VDR-abhängig zu sein. Das Enzym Serum und Glucocorticoid-regulierte Kinase 1 ( SKG1 ) reguliert die TRPV6-Expression, indem es die Phosphatidylinositol-3-Phosphat-5-Kinase PIKfyve (PIP5K3) verstärkt. Diese Kinase ist entscheidend für die Bildung von sekundärem Botenstoff PIP 2 , einem bekannten Lipidaktivator von TRPV6.
- TRPV
- TRPV5
- Kalziumkanäle
- Kalziumaufnahme
- transzellulärer Weg
- Gating-Mechanismus
- Calmodulin
- mütterlich-fetaler Transport
- vorübergehender neonataler Hyperparathyreoidismus
- chronische Pankreatitis
- Nierensteine
- Krebs
Verweise
Weiterlesen
- Heiner I, Eisfeld J, Lückhoff A (2004). „Rolle und Regulation von TRP-Kanälen in neutrophilen Granulozyten“. Zellkalzium . 33 (5–6): 533–40. doi : 10.1016/S0143-4160(03)00058-7 . PMID 12765698 .
- Clapham DE, Julius D, Montell C, Schultz G (Dezember 2005). „International Union of Pharmacology. XLIX. Nomenklatur und Struktur-Funktions-Beziehungen von transienten Rezeptorpotentialkanälen“. Pharmakologische Bewertungen . 57 (4): 427–50. doi : 10.1124/pr.57.4.6 . PMID 16382100 . S2CID 17936350 .
- Wissenbach U, Niemeyer BA (2007). "TRPV6". Transiente Rezeptorpotential (TRP) Kanäle . Handbuch der experimentellen Pharmakologie. 179 . S. 221–34. doi : 10.1007/978-3-540-34891-7_13 . ISBN 978-3-540-34889-4. PMID 17217060 .
- Schoeber JP, Hoenderop JG, Bindels RJ (Februar 2007). „Konzerte Wirkung von assoziierten Proteinen bei der Regulierung von TRPV5 und TRPV6“. Transaktionen der Biochemischen Gesellschaft . 35 (Teil 1): 115–9. doi : 10.1042/BST0350115 . PMID 17233615 .
Externe Links
- TRPV+Cation+Channels der US National Library of Medicine Medical Subject Headings (MeSH)
- TRPV6+protein,+human in der US National Library of Medicine Medical Subject Headings (MeSH)





